What is Gene Expression? | Protocol (Translated to Russian)
14.1: Что такое экспрессия гена?
Обзор
Экспрессия генов – это процесс, в котором ДНК направляет синтез функциональных продуктов, таких как белки. Клетки могут регулировать экспрессию генов на различных стадиях. Это позволяет организмам генерировать различные типы клеток и позволяет клеткам адаптироваться к внутренним и внешним факторам.
Генетическая информация переходит от ДНК к РНК к белку
Ген является участком ДНК, который служит в качестве плана для функциональных РНК и белков. Поскольку ДНК состоит из нуклеотидов, а белки состоят из аминокислот, необходим посредник для преобразования информации, кодируемой в ДНК, в белки. Этот посредник является мессенджером РНК (мРНК). мРНК копирует план из ДНК процессом, называемым транскрипцией. В эукариотах транскрипция происходит в ядре путем дополнительного базового сопряжения с шаблоном ДНК. Затем мРНК обрабатывается и транспортируется в цитоплазму, где она служит шаблоном для синтеза белка во время трансляции. У прокариот, в которых нет ядра, процессы транскрипции и трансляции происходят в одном и том же месте и почти одновременно, так как новообразованная мРНК подвержена быстрой деградации.
Затем мРНК обрабатывается и транспортируется в цитоплазму, где она служит шаблоном для синтеза белка во время трансляции. У прокариот, в которых нет ядра, процессы транскрипции и трансляции происходят в одном и том же месте и почти одновременно, так как новообразованная мРНК подвержена быстрой деградации.
Экспрессия генов может регулироваться на любом этапе во время транскрипции
Каждая клетка организма содержит одинаковую ДНК, и, следовательно, один и тот же набор генов. Тем не менее, не все гены в клетке «включены» или используются для синтеза белков. Ген, как говорят, «выражается», когда белок, который он кодирует, вырабатывается клеткой. Экспрессия генов регулируется для обеспечения правильного генерации белков в определенных клетках в определенное время. Различные внутренние и внешние механизмы регулируют экспрессию генов до и во время транскрипции.
Структура хроматина- уплотненной ДНК и связанных с ней белков гистона — может быть химически изменена, чтобы быть открытой или закрытой.
ДНК-связывающие белки, называемые транскрипционными факторами, регулируют транскрипцию, связываясь с определенными последовательностями ДНК вблизи или внутри кодирующих областей генов. Транскрипционные факторы, способствующие инициированию транскрипции, называются активаторами. Белки, которые предотвращают связывание механизма транскрипции с местом инициации транскрипции, называются репрессорами. Транскрипционные активаторы или репрессоры реагируют на внешние раздражители, такие как сигнальные молекулы, дефицит питательных средств, температура и кислород.
Экспрессия генов может пост-транскрипционно и пост-трансляционно регулироваться
Экспрессия генов может регулироваться посттранскрипционной обработкой мРНК.
Экспрессия генов также может быть изменена путем регулирования трансляции мРНК в белки. Трансляция может регулироваться микроРНК- малыми, некодирующих РНК, которые связываются с определенной последовательностью мРНК и блокируют инициирование трансляции или ухудшают транскрибированную мРНК. Кроме того, белки, называемые трансляционными репрессорами, могут связываться с РНК и мешать инициированию трансляции.
Переведенные полипептиды проходят обработку для формирования функциональных белков. Добавление или удаление химических групп может изменить активность, стабильность и локализацию белков в клетке. Например, добавление или удаление фосфориловых групп (-PO32)может активировать или инактивировать белки. Аналогичным образом, добавление убиквитиных групп вызывает деградацию белка. Таким образом, пост-трансляционные модификации белка являются заключительной стадией регуляции генов.
Добавление или удаление химических групп может изменить активность, стабильность и локализацию белков в клетке. Например, добавление или удаление фосфориловых групп (-PO32)может активировать или инактивировать белки. Аналогичным образом, добавление убиквитиных групп вызывает деградацию белка. Таким образом, пост-трансляционные модификации белка являются заключительной стадией регуляции генов.
Литература для дополнительного чтения
Phillips, Theresa. “Regulation of transcription and gene expression in eukaryotes.” Nature Education 1 no. 1 (2008): 199 [Source]
Ralston, Amy. “Examining histone modifications with chromatin immunoprecipitation and quantitative PCR.”
Регуляция экспрессии генов
☰
Экспрессия генов — это реализация заложенной в них информации, то есть синтез РНК и белков. Другими словами, под экспрессией генов понимают их активность.
В клетках живых организмов экспрессия генов регулируется: одни гены могут быть реализованы, другие — нет. Причем регуляция может осуществляться на разных этапах: может выполняться или нет транскрипция, из пре-мРНК в результате альтернативного сплайсинга могут образовываться разные мРНК, может блокироваться трансляция и др.
У эукариот, обладающих отграниченным от цитоплазмы ядерным содержимым и более сложным геномом, регуляция экспрессии генов намного разнообразнее и сложнее, чем у прокариот.
Регуляция экспрессии генов у прокариот
У прокариот пока молекула РНК синтезируется на участке ДНК, она тут же может транслироваться (начиная с уже синтезированного конца). Поэтому у них регуляция экспрессии (активности) генов осуществляется почти исключительно на уровне ДНК, так как в РНК часто невозможно внести какие-нибудь изменения до ее трансляции.
В 1961 г. Жакобом и Моно была предложена модель оперона как системы регуляции генов у бактерий. Оперон состоит из промотора, оператора, структурных генов оперона (их может быть разное количество) и терминатора. В области промотора прикрепляется фермент РНК-полимераза. В области оператора присоединяется белок-репрессор, который кодируется отдельно отстоящим от оперона геном-регулятором (может быть сцеплен со своим опероном, а может находиться на расстоянии).
Оперон состоит из промотора, оператора, структурных генов оперона (их может быть разное количество) и терминатора. В области промотора прикрепляется фермент РНК-полимераза. В области оператора присоединяется белок-репрессор, который кодируется отдельно отстоящим от оперона геном-регулятором (может быть сцеплен со своим опероном, а может находиться на расстоянии).
Если белок-репрессор соединяется с оператором, то транскрипция всех структурных генов оперона становится невозможной, так как РНК-полимераза не может перемещаться по цепи ДНК.
В свою очередь активность белка-репрессора может блокироваться определенным для него низкомолекулярным соединением — индуктором (тем или иным питательным веществом бактерий). В результате взаимодействия с индуктором белок-репрессор видоизменяется и уже не может присоединиться к оператору своего оперона. В этом случае гены оперона экспрессируются (т. е. на них идет синтез).
Бывает обратная ситуация, когда индуктор активирует белок-репрессор.
Таким образом, в зависимости от того, какие индукторы находятся в цитоплазме, у прокариот экспрессируются те или иные генные группы.
Вышеописанный механизм экспрессии генов относится к негативной регуляции, так как гены транскрибируются, если они не выключены репрессором. И наоборот: не транскрибируются, если выключены.
Кроме негативной регуляции у бактерий существует также позитивная. В этом случае вместо белка-репрессора действие оказывает белок-активатор. На эти белки также действуют индукторы, активируя или инактивируя их.
Также у прокариот были выявлены опероны, которые актируются двумя регуляторными белками, соединенными друг с другом.
Регуляция экспрессии генов у эукариот
У многоклеточных организмов в клетках разных тканей экспрессируются разные гены, т. е. для эукариот характерна дифференциальная экспрессия.
У эукариот, также как и у прокариот, существуют регуляторные белки с похожим механизмом действия. При этом для эукариот не характерна регуляция по типу оперона. Цистроны (транскрибируемые участки) эукариот обычно содержат по одному гену. (Это не касается геномов хлоропластов и митохондрий.)
При этом для эукариот не характерна регуляция по типу оперона. Цистроны (транскрибируемые участки) эукариот обычно содержат по одному гену. (Это не касается геномов хлоропластов и митохондрий.)
Конденсация и деконденсация хроматина. Это наиболее универсальный метод регуляции транскрипции. Когда нужно экспрессировать определенные гены, хроматин в этом месте деконденсируется.
Альтернативные промоторы. У гена может быть несколько промоторов, каждый из которых начинает транскрипцию с разных его экзонов в зависимости от типа клетки. В конечном итоге будут синтезированы разные белки.
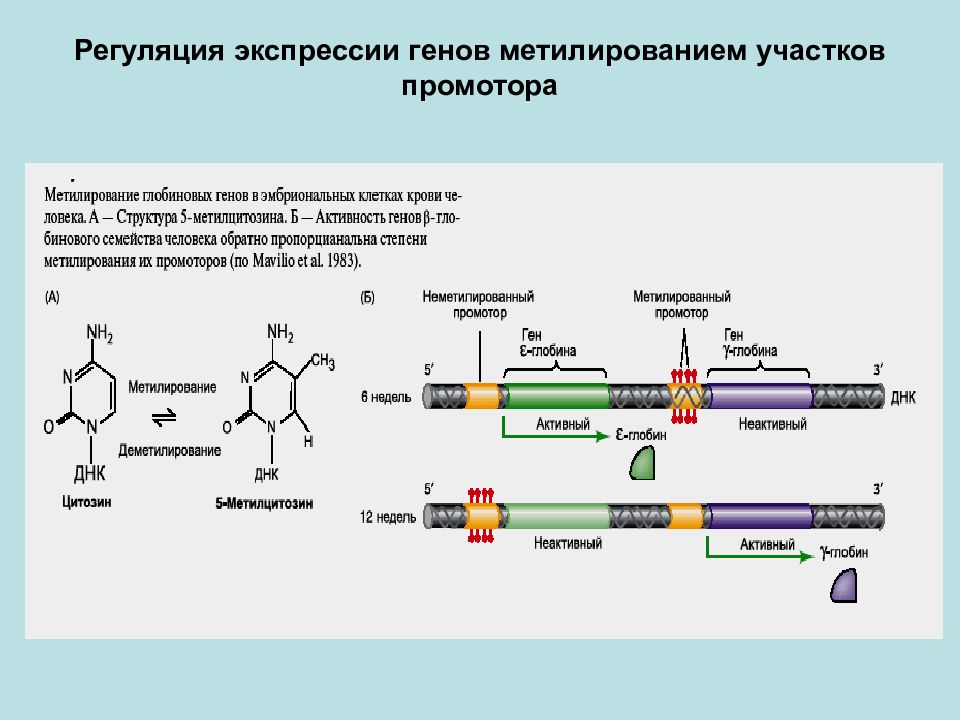
Метилирование и деметилирование ДНК. Метилирование ДНК происходит в регуляторных областях гена. Метилируется цитозин в последовательности ЦГ, после чего ген инактивируется. При деметилировании активность гена восстанавливается. Процесс регулируется ферментом метилтрансферазой.
Процесс регулируется ферментом метилтрансферазой.
Гормональная регуляция. При гормональной регуляции гены активируются в ответ на внешний химический сигнал (поступление в клетку определенного гормона). Этот гормон запускает те гены, которые имеют специфические последовательности нуклеотидов в регуляторных областях.
Геномный импринтинг. Это малоизученный способ регуляции экспрессии генов у эукариот. Он возможен только у диплоидных организмов и выражается в том, что активность генов зависит, от какого из родителей они были получены. Выключение генов осуществляется путем метилирования ДНК.
Альтернативный сплайсинг. Это регуляция на уровне процессинга. При альтернативном сплайсинге порядок сшивки экзонов может быть различным. Отсюда следует, что на основе одной и той же нуклеотидной последовательности ДНК могут быть синтезированы разные белки. Хотя их отличие друг от друга будет в основном заключаться лишь в разных сочетаниях одних и тех же аминокислот.
Тканеспецифическое редактирование РНК также протекает на уровне процессинга. Выражается в замене отдельных нуклеотидов в РНК в определенных тканях организма.
Кроме того, у эукариот иРНК часто не подвергается процессингу вообще (а распадается) или подвергается с задержкой. Это токже можно рассматривать как способ регуляции экспрессии генов.
Регуляция стабильности иРНК. У эукариот существует регуляция и на уровне трансляции, когда готовые иРНК не «допускаются» к рибосомам или разрушаются. Другие же иРНК могут дополнительно стабилизироваться для многократного использования.
Посттрансляционная модификация белка. Чтобы молекула полипептида превратилась в активную молекулу белка, в ней должны произойти различные модификации определенных аминокислот, должны быть сформированы вторичная, третичная и возможно четверичная структуры. На этом этапе также можно повлиять на реализацию генетической информации, например, не дав молекуле сформироваться.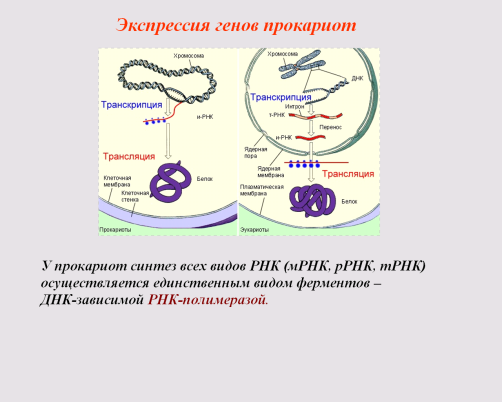
Риборегуляторы. Были обнаружены РНК, выполняющие регуляторные функции путем ослабления работы отдельных генов.
Для высокоорганизованных животных отмечается существование надклеточного уровня регуляции экспрессии генов.
Составлена самая подробная карта экспрессии генов в эмбрионе дрозофилы
Секвенирование РНК из тысяч индивидуальных клеток позволило германским биологам составить самую детальную на сегодняшний день карту экспрессии генов в эмбрионе дрозофилы на стадии начала гаструляции. Карта довольно точно отражает экспрессию 6–8 тысяч генов в каждой клетке эмбриона. Она позволяет решать разнообразные исследовательские задачи: обнаруживать неизвестные ранее регуляторы развития, анализировать общие закономерности трехмерной организации эмбриона и эволюции онтогенеза. Работа представляет собой важный шаг на пути к решению главной задачи биологии развития — полному и исчерпывающему пониманию того, как генотип воплощается в фенотипе.
Ключевую роль в эмбриональном развитии играет дифференцировка клеток, в основе которой лежит включение разных наборов генов в разных клетках в ответ на определенные сигналы (см. Как клетки понимают, что одни должны стать волосами, другие костями, третьи мозгами и т. п.?). Паттерны экспрессии генов — регуляторов развития создают пространственную разметку эмбриона, поэтапно рисуя на нем нечто вроде чертежа будущего организма (рис. 1).
Для дрозофилы Drosophila melanogaster, одного из самых изученных животных, уже известны пространственно-временные паттерны экспрессии десятков регуляторных генов. Это позволило в общих чертах разобраться в том, как формируются передний и задний концы тела, спинная и брюшная стороны, сегменты и органы (см. Михаил Никитин. Генные сети, управляющие строением тела животных). Но всё же картина остается неполной: изучены далеко не все гены, влияющие на развитие, а области их экспрессии картированы зачастую лишь приблизительно.
В идеале хотелось бы иметь точную информацию по экспрессии каждого гена в каждой клетке эмбриона на каждом этапе развития. Но возможно ли это? До сих пор такой уровень детализации был недостижим. Но наука не стоит на месте, и то, что казалось еще недавно недостижимой мечтой, вдруг становится реальностью.
Но возможно ли это? До сих пор такой уровень детализации был недостижим. Но наука не стоит на месте, и то, что казалось еще недавно недостижимой мечтой, вдруг становится реальностью.
В статье, опубликованной в журнале Science 13 октября, ученые из Центра Молекулярной Медицины Макса Дельбрюка (Max Delbrück Center for Molecular Medicine) в Берлине сообщили о создании самой детальной на сегодняшний день карты генной экспрессии эмбриона дрозофилы на этапе развития, предшествующем началу морфогенеза. В это время (так называемая стадия 6, см. Stage 6) эмбрион состоит примерно из 6000 клеток, еще не имеет видимых морфологических структур и только приступает к гаструляции.
Авторы сделали всё возможное, чтобы включить в анализ максимальное число генов (причем не только белок-кодирующих, но и генов регуляторных РНК), и чтобы добиться максимального пространственного разрешения, картировав экспрессию в каждой клетке эмбриона по отдельности. Для этого они воспользовались недавно изобретенной технологией Drop-Seq, основанной на помещении клеток в крошечные капельки воды, мечении РНК в каждой капле особой меткой и последующем тотальном секвенировании РНК (см. E. Z. Macosko et al., 2015. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets). Метод Drop-Seq позволяет одновременно измерить в каждой клетке экспрессию нескольких тысяч генов. Индивидуальные метки дают возможность понять, какие из отсеквенированных молекул РНК происходят из одной и той же, а какие — из разных клеток.
E. Z. Macosko et al., 2015. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets). Метод Drop-Seq позволяет одновременно измерить в каждой клетке экспрессию нескольких тысяч генов. Индивидуальные метки дают возможность понять, какие из отсеквенированных молекул РНК происходят из одной и той же, а какие — из разных клеток.
Авторам удалось с высокой точностью измерить экспрессию генов примерно в 1300 клетках эмбрионов дрозофилы на стадии 6. Для каждой клетки уровень экспрессии был надежно определен в среднем для 3100 генов.
Предварительный анализ полученных данных показал, что профили экспрессии в разных клетках эмбриона различаются очень сильно: свой уникальный профиль имеет чуть ли не каждая клетка. Это значит, что составление карты экспрессии с максимальным, то есть клеточным уровнем разрешения — не блажь, а правильный и необходимый шаг на пути к пониманию механизмов развития.
К сожалению, метод Drop-Seq требует предварительного разделения эмбриона на отдельные клетки. При этом информация о том, из какой части эмбриона происходит та или иная клетка, теряется, и ее нужно потом как-то восстановить. В этом и состояла главная методологическая трудность, которую авторы должны были преодолеть. Для этого они использовали ту информацию по паттернам экспрессии отдельных генов, которая была получена ранее. В частности, в рамках проекта Berkeley Drosophila Transcription Network Project (BDTNP) была с большой точностью картирована экспрессия 84 генов — регуляторов развития (C. C. Fowlkes et al., 2008. A Quantitative Spatiotemporal Atlas of Gene Expression in the Drosophila Blastoderm). Проанализировав эти данные и сопоставив их с результатами Drop-Seq, авторы пришли к выводу, что, зная уровень экспрессии каждого из 84 генов в анализируемой клетке, можно довольно точно (с точностью до нескольких клеточных диаметров) определить, из какого места эмбриона происходит клетка.
При этом информация о том, из какой части эмбриона происходит та или иная клетка, теряется, и ее нужно потом как-то восстановить. В этом и состояла главная методологическая трудность, которую авторы должны были преодолеть. Для этого они использовали ту информацию по паттернам экспрессии отдельных генов, которая была получена ранее. В частности, в рамках проекта Berkeley Drosophila Transcription Network Project (BDTNP) была с большой точностью картирована экспрессия 84 генов — регуляторов развития (C. C. Fowlkes et al., 2008. A Quantitative Spatiotemporal Atlas of Gene Expression in the Drosophila Blastoderm). Проанализировав эти данные и сопоставив их с результатами Drop-Seq, авторы пришли к выводу, что, зная уровень экспрессии каждого из 84 генов в анализируемой клетке, можно довольно точно (с точностью до нескольких клеточных диаметров) определить, из какого места эмбриона происходит клетка.
Таким образом, каждая клетка была надежно «привязана» к определенному, очень небольшому участку эмбриона. Поскольку к каждому такому участку была привязана не одна, а несколько клеток, в каждой из которых был измерен уровень экспрессии в среднем 3100 генов (причем наборы генов с измеренной экспрессией были разными для разных клеток), то для каждого участка удалось в конечном счете оценить экспрессию 6–8 тысяч генов.
Поскольку к каждому такому участку была привязана не одна, а несколько клеток, в каждой из которых был измерен уровень экспрессии в среднем 3100 генов (причем наборы генов с измеренной экспрессией были разными для разных клеток), то для каждого участка удалось в конечном счете оценить экспрессию 6–8 тысяч генов.
В результате получилась самая детальная на сегодняшний день трехмерная карта экспрессии генов в эмбрионе дрозофилы на стадии начала гаструляции. Карта представлена в виде интерактивной системы Drosophila Virtual Expression eXplorer (DVEX), которая для любого выбранного гена может показать паттерн экспрессии.
Авторы сравнивали изображения, нарисованные их программой, с реальными паттернами экспрессии отдельных генов, полученными классическим способом — при помощи гибридизации in situ. Сравнение показало, что карта получилась довольно точная (рис. 2).
Значение этой работы в том, что специалисты по биологии развития получили новый мощный инструмент для решения разнообразных научных задач. В заключительной части статьи авторы показали несколько возможных направлений, где их детище может найти применение.
В заключительной части статьи авторы показали несколько возможных направлений, где их детище может найти применение.
Например, можно искать общие закономерности в разнообразии рисунков экспрессии различных генов. Это прольет свет на базовые принципы пространственной организации эмбриона. Авторы попытались классифицировать паттерны экспрессии изученных генов, построив для них дендрограмму сходства (рис. 3). Оказалось, что разнообразие рисунков экспрессии распадается на 10 кластеров, для каждого из которых можно составить обобщенный «архетипический» рисунок экспрессии. Подобные сведения важны для расшифровки регуляторных генных сетей: например, логично предположить, что гены, относящиеся к одному кластеру, имеют сходную систему регуляции, то есть похожим образом реагируют на те или иные сигналы.
Кроме того, подробная карта генной экспрессии может быть использована для обнаружения новых регуляторов развития. Один из примеров показан на рис. 2 справа внизу. Длинная некодирующая РНК CR43432, экспрессия которой ранее не картировалась и чья функция неизвестна, экспрессируется, как выяснилось, там и только там, где не экспрессируются важнейшие гены, контролирующие развитие нейроэктодермы, такие как SoxN.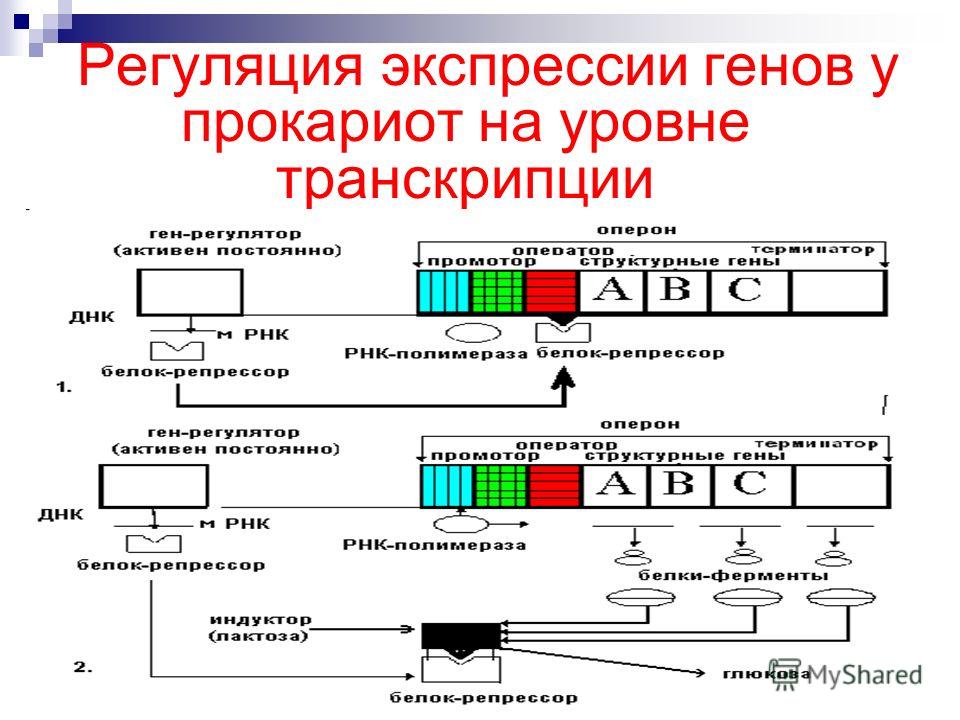 Это значит, что CR43432 с большой вероятностью является регулятором эмбрионального развития: возможно, она ограничивает распространение нейроэктодермы или влияет на развитие клеток, избравших не-нейроэктодермальную судьбу.
Это значит, что CR43432 с большой вероятностью является регулятором эмбрионального развития: возможно, она ограничивает распространение нейроэктодермы или влияет на развитие клеток, избравших не-нейроэктодермальную судьбу.
Имея точную карту экспрессии, можно проследить, в каких участках эмбриона производятся те или иные сигнальные вещества, и догадаться, для каких участков предназначены эти сигналы. Кроме того, карта поможет в изучении эволюции онтогенеза. Авторы проиллюстрировали эту возможность, построив для другого вида дрозофил, D. virilis, менее детальную карту экспрессии генов на той же стадии развития и обнаружив несколько контрастных отличий от D. melanogaster.
Работа представляет собой важный шаг на пути к решению главной задачи биологии развития, которая состоит в том, чтобы понять, каким образом наследственная информация воплощается в фенотипе. Причем понять не в общих чертах (для дрозофилы это уже, можно сказать, сделано), а во всех подробностях. Обладание полной информацией о том, как регулируется и на что влияет работа каждого гена в ходе онтогенеза, откроет перед человечеством небывалые возможности, вплоть до проектирования искусственных организмов с любыми желаемыми свойствами.
Обладание полной информацией о том, как регулируется и на что влияет работа каждого гена в ходе онтогенеза, откроет перед человечеством небывалые возможности, вплоть до проектирования искусственных организмов с любыми желаемыми свойствами.
Источник: Nikos Karaiskos, Philipp Wahle, Jonathan Alles, Anastasiya Boltengagen, Salah Ayoub, Claudia Kipar, Christine Kocks, Nikolaus Rajewsky and Robert P. Zinzen. The Drosophila embryo at single-cell transcriptome resolution // Science. 2017. V. 358. P. 194–199. DOI: 10.1126/science.aan3235.
См. также:
1) Михаил Никитин. Генные сети, управляющие строением тела животных.
2) Шон Кэрролл. Бесконечное число самых прекрасных форм.
3) Как клетки понимают, что одни должны стать волосами, другие костями, третьи мозгами и т. п.?
Александр Марков
Медицинская геномика: организация генома, регуляция экспрессии генов, генетическая вариабельность | Титов
1. Титов, Л. П. Вирусы и эукариотические клетки: стадии взаимодействия, стратегия геномов, репродукция и исходы инфекции / Л. П. Титов // Мед. журн. — 2008. — № 1. — С. 10-16.
Титов, Л. П. Вирусы и эукариотические клетки: стадии взаимодействия, стратегия геномов, репродукция и исходы инфекции / Л. П. Титов // Мед. журн. — 2008. — № 1. — С. 10-16.
2. Braga-Neto, U. M. From Genomics to Functional Immunomics: New challenges, Old problems, Big Rewards / U. M. Braga-Neto, E. T. A. Marques // Plos comput. biol. — 2006. — Vol. 2. — Iss. 7. — eB1.P.0651-0662.
3. Microbiome Composition by Pyrosequencing in Mesenteric Lymph Nodes of Rats with CCL4-induced Cirrhosis / S. Cuenca [et al.] // J. Innate Immunol. — 2014. — Vol. 6. — P. 263-271.
4. An Immunomics Approach to Schistosome antigen discovery: antibody signatures of naturally resistant and chronically infected individuals from endemic areas / S. Gaze [et al.] // PLOS Pathogens. — 2014.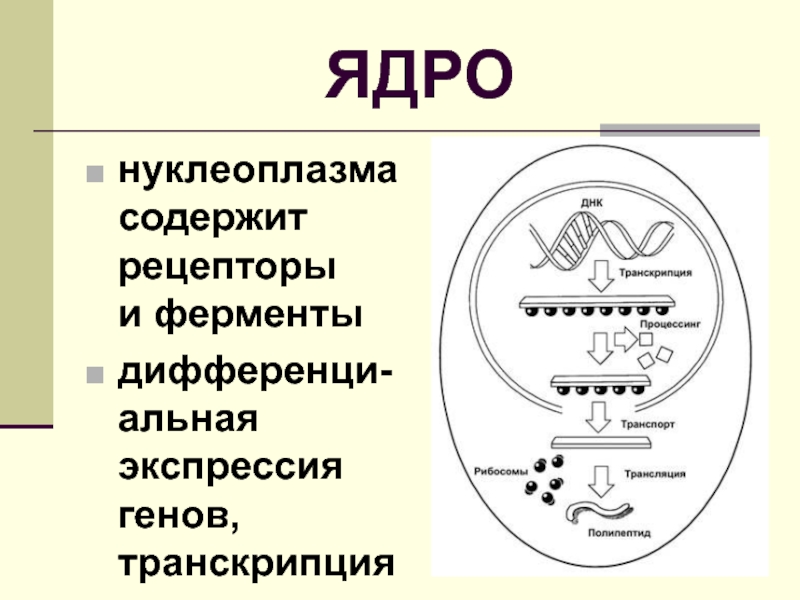 — Vol. 10. — Iss. 3. — P. 1-16. — E1004033.
— Vol. 10. — Iss. 3. — P. 1-16. — E1004033.
5. Титов, Л. П. Иммунология: терминологический словарь / Л. П. Титов. — М.: МИА, 2008. — 521 с.
6. Хромов-Борисов, Н. Н. Эволюционная медицинская геномика / Н. Н. Хромов-Борисов, А. В. Рубанович // Молек. медицина. — 2014. — № 2. — С. 13-17.
7. Структурная геномика и медицина / И. Е. Ясный [и др.] // Молек. медицина. — 2009. — № 6. — С. 15-20.
8. Groot, A. S. D. Immunomics discovering new targets for vaccine and therapeutics / A. S. D. Groot // Drug Discov. Today. — 2006. — Vol. 11. — P. 203-209.
9. Miller, M. B. Basic concept of microarrays and potential application in clinical microbiology / M. B. Miller, Y. W. Tang // Clin. Microbiol. Rev. — 2009. — Vol. 22 (4). — P. 611-633.
B. Miller, Y. W. Tang // Clin. Microbiol. Rev. — 2009. — Vol. 22 (4). — P. 611-633.
10. Пинегин, Б. В. Роль клеток иммунной системы и цитокинов в развитии псориаза / Б. В. Пинегин, О. Л. Иванов, В. Б. Пинегин // Иммунология. — 2012. — Т. 33, № 4. — С. 213-219.
11. Титов, Л. П. Противовирусный иммунитет: молекулярно-клеточные механизмы, закономерности развития и иммунопатология / Л. П.Титов, И. А. Карпов // Мед. журн. — 2007. — № 1. — С. 4-14.
12. Бокуть, С. Б. Молекулярная биология / С. Б. Бокуть, Н. В. Герасимович, А. А. Милютин. — Минск: Вышэйш. школа, 2005. — 463 с.
13. The sequence of human genome / J. C. Venter [et al.] // Science. — 2001. — Vol. 291. — Р. 1304-1309.
14. Read, A. The human Genome: structure and organization / A. Read // Genetics and Medicine / еd. D. Kumar, D. Weatherall. — Oxford press, 2008. — P. 17-29.
15. Antonarakis, S. E. Human Genome Sequence and Variation / S. E. Antonarakis // Vogel and Matulsky’s Human Genetics, Problems and Approaches / eds. M. R. Speicher et al. — 2010. — Berlin; Heidelberg: Springer-Verlag. — Р. 31-53.
16. Global gene expression analysis reveals evidence for decreased lipid biosynthesis and increased innate immunity in uninvolved psoriatic skin / J. E. Gudjonsson [et al.] // J. Invest. Dermatol. — 2009. — Vol. 129. — Р. 2795-2804.
17. Collaborative association study of genome-wide scan reveals association of psoriasis with IL-23 and NF-kappa B pathways / R. P. Nair [et al.] // Nat. genetics. — 2009. — Vol. 41. — Р. 199-204.
P. Nair [et al.] // Nat. genetics. — 2009. — Vol. 41. — Р. 199-204.
18. Garaev, P. P. Another Understanding of the Model of Genetic Code Theoretical Analysis / P. P. Garaev // Open J. of Genetics. — 2015. — Vol. 5, N 1. — Р. 92-109.
19. Mardis, E. R. Cancer genome sequencing / E. R. Mardis, R. K. Wilson // Human mol. genetics. — 2009. — Vol. 18. -Iss. 2. — Doi:10109/ddp396.
20. Consortium biology in immunology: the perspective from the Immunological Genome Project / С. Benoist [et al.] // Nature Rev. Immunol. — 2012. — P. 1-6.
21. Heng, T. S. P. The immunological Genome Project: network of gene expression in immune cells / T. S. P. Heng, M. W. Painter // Immunology. — 2008. — Vol. 4, N 10. — Р. 1091-1094.
— Vol. 4, N 10. — Р. 1091-1094.
22. Grander, D. I. Immunomics: principles and practis / D. I. Grander // IRTI. — 2004. — Vol. 2.- Р. 1-6.
23. Титов, Л. П. Геномико-протеомические основы эволюции и молекулярной эпидемиологии вирусов / Л. П. Титов, В. И. Вотяков // Вес. НАН Беларусi Сер. мед. навук. — 2011. — № 1. — С. 109-124.
24. Epigenetic regulation of inducible gene expression in the immune system / P. S. Lim [et al.] // Immunology. — 2013. -Vol. 139. — Iss. 3. — Р. 285-293.
25. Josefowicz, S. Z. Regulatory of chromatin state and transcription in CD4 T-cells polarization / S. Z. Josefowicz // Immunology. — 2013. — Vol. 139. — Iss. 1. — Р. 299-308.
26. Титов, Л. П. Особенности строения, развития и функционирования иммунной системы детского организма / Л. П. Титов, Е. Ю. Кирильчик, Т. А. Канашкова // Мед. новости. — 2009. — № 5. — С. 7-16.
Титов, Л. П. Особенности строения, развития и функционирования иммунной системы детского организма / Л. П. Титов, Е. Ю. Кирильчик, Т. А. Канашкова // Мед. новости. — 2009. — № 5. — С. 7-16.
27. Transcription factors and CD4 T-cell seeking identity: masters, minions, setters and spikers / G. Vahedi [et al.] // Immunology. — 2013. — Vol. 139. — Iss. 3. — P. 294-298.
28. Chen, W. Development of thymic Foxp3 regulatory T-cells: TGF-b matters / W. Chen, J. E. Konkel // Eur. J. of Immunol. — 2015. — Vol. 45. — P. 958-965.
29. Lee, G. R. Transcriptional regulation T-helper type 2 / G. R. Lee // Immunology. — 2014. — Vol. 141. — Iss. 4. — P. 498-505.
30. Wang, Y. An essential role of the transcriptional factor GATA-3 for the function of regulatory Т-cells / Y.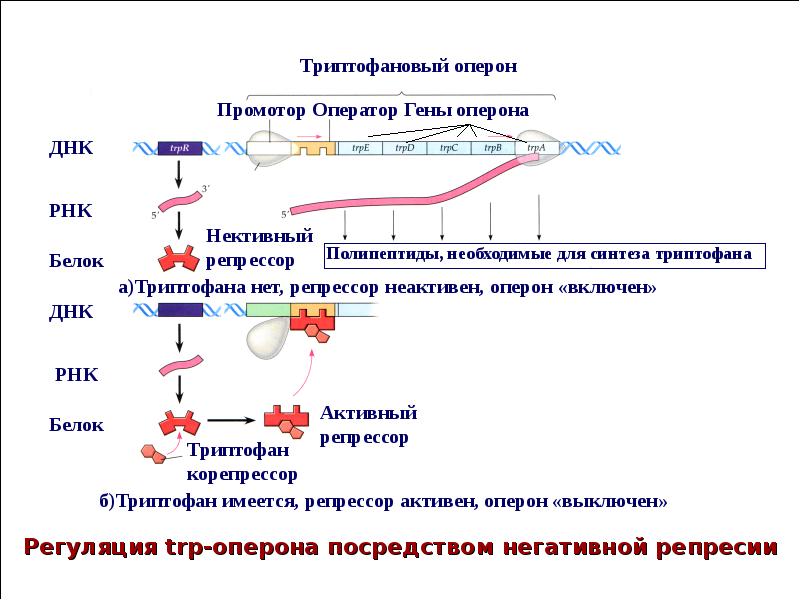 Wang, M. A. Su, Y. Y. Wan // Immunity. — 2011. — Vol. 35. — P. 337-348.
Wang, M. A. Su, Y. Y. Wan // Immunity. — 2011. — Vol. 35. — P. 337-348.
31. Wen, A. Y. The role of the transcriptional factor CREB in immune function / A. Y. Wen, K. M. Sakamoto, L. S. Miller // J. Immunol. — 2010. — Vol. 185. — P. 6413-6419.
32. Rico-Rosillo, G. The involvement of NF-kB transcription factor in asthma / G. Rico-Rosillo, G. B. Vega-Robledo // Rev. Alergia Mex. — 2011. — Vol. 58, N 2. — P. 107-111.
33. Титов, Л. П. Молекулярные механизмы активации Т- и В-лимфоцитов / Л. П. Титов // Современные проблемы инфекционной патологии человека: материалы 2-й науч.-практ. конф. — Минск, 2001. — С. 287-317.
34. From single-cell to cell pool transcriptomes: stochasticity in gene expression and RNA splicing / G. K. Maurinov [et al.] // Genome Res. — 2011. — Vol. 24. — P. 496-510.
K. Maurinov [et al.] // Genome Res. — 2011. — Vol. 24. — P. 496-510.
35. Youngblood, B. T-cell memory differentiational signatures and epigenetics / B. Youngblood, J. S. Hall, R. Ahmed // Immunology. — 2013. — Vol. 139. — Iss. 3. — P. 325-335.
36. Banerji, J. Expression of a beta-globin gene is enchanced by remоte SV40 DNA sequences / J. Banerji, R. Sandro, M. Schaffner // Cell. — 1981. — Vol. 27. — P. 299-308.
37. Ogbourne, S. Transcriptional control and the role of silencers in transcriptional regulation in eukaryotes / S. Ogbourne, T. M. Antalis // Biochemistry. — 1998. — Vol. 231. — P. 1-14.
38. Enchancers and silencers: an integrated and simple model for their function / P. Kolovos [et al.] // Epigenetics & Chromatin. — 2012. — Vol. 5, N 1. — P. 2-8.
Kolovos [et al.] // Epigenetics & Chromatin. — 2012. — Vol. 5, N 1. — P. 2-8.
39. Разин, С. В. Регуляторные элементы эукариотического генома, контролирующие транскрипцию / С. В. Разин, А. А. Говрилов, С. В. Ульянов // Молек. биология. — 2015. — Т. 49, № 2. — С. 212-223.
40. Гонзвгло, М. МикроРНК как биомаркер для диагностики рака мочевого пузыря / М. Гонзвгло, Г. Ишханова // Молек. медицина. — 2014. — № 2. — С. 18-24.
41. Титов, Л. П. Микро-РНК: новый класс регуляторных молекул иммунного ответа и инфекционного процесса / Л. П. Титов // Современные проблемы инфекционной патологии человека: сб. науч. тр. — 2012. — В. 5. — С. 256-261.
42. Perez-Ortin, J. E. Genomics of mRNA turnover / J. E. Perez-Ortin // Briefing in functional genomics and proteomics. — 2007. — Vol. 6, N 4. — P. 282-291.
E. Perez-Ortin // Briefing in functional genomics and proteomics. — 2007. — Vol. 6, N 4. — P. 282-291.
43. Cross-regulation between cytokine and microRNA pathways in T-cells / T. Amado [et al.] // Eur. J. of Immunol. -2015. — Vol. 45. — Iss. 6. — P. 1584-1595.
44. Phisiological and pathological roles for microRNAs in the immune system / R. M. O’Connel [et al.] // Nat. Rev. Immunol. — 2010. — P. 11-122.
45. A role for Dicer in immune regulation / B. S. Cobb [et al.] // J. Exp. Med. — 2006. — Vol. 203. — P. 2519-2527.
46. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal in inflammatory disease / M. M. Chang [et al.] // J. Exp. Med. — 2008. — Vol. 205. — P. 2005-2017.
— P. 2005-2017.
47. Role of mir-155 in the regulatory of lymphocytes immune function and disease / N. Seddiki [et al.] // Immunology. — 2014. — Vol. 142. — Iss. 1. — P. 32-38.
48. Ortutay, C. Immonomic Knowledge base (IKB): an integrated service for immune research / C. Ortutay, M. Vikinen // BMC Immunol. — 2009. — Vol. 10. — doi: 101186/1471-2172-10-3.
49. Kan, Y. W. Polymorphism of DNA sequence adjacent to human beta-globin structural gene: relationship to sickle mutation / Y. W. Kan // Proc. Natl. Sci. — 1878.- Vol. 75, N 11. — P. 5631-5635.
50. Increased expression of Wnt5a in psoriatic plaques / J. Reischl [et al.] // J. Invest. Dermatol. — 2007. — Vol. 127. -P. 163-169.
51. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infection disease / C. Skevaki [et al.] // Clin. аМ Exp. Immunol. — 2015. — Vol. 180. — P. 165-177.
52. Marietta, E. Immunogenetic control of the intestinal microbiota / E. Marietta, A. Rishi, V. Taneja // Immunology. — 2015. — Vol. 145. — P. 313-322.
53. Severe combined immunodeficiency. A national surveillance study / A. Yee [et al.] // Pediatric Allergy and Immunol. — 2008. — Vol. 19 (4). — P. 298-302.
54. Quantitative monitoring of gene expression patterns with a complementary DNA microarray / M. Schena [et al.] // Science. — 1995. — Vol. 270. — P. 467-470.
55. Clinical interpretation and implications of whole genome sequencing / F. E. Dewey [et al.] // JAMA. — 2014. — Vol. 31, N 10. — P. 1035-1041.
Clinical interpretation and implications of whole genome sequencing / F. E. Dewey [et al.] // JAMA. — 2014. — Vol. 31, N 10. — P. 1035-1041.
56. Cordero, P. Whole genome sequencing in personalized therapeutics / P. Cordero, E. A. Ashely // Clin. Pharmacol. and Ther. — 2012. — Vol. 91, N 6. — P. 1001-1009.
57. Use of whole genome sequencing for diagnosis and discovery in the cancer genetics clinic / S. B. Foley [et al.] // Ebiomedicine. — 2015. — Vol. 2. — P. 74-81.
58. Whole genome sequencing in health care / C. G. van El [et al.] // Eur. J. of Human Genetics. — 2013. — Vol. 21. — P. 580-584.
59. Swanson, C. I. Rapid еvolutionary of a structurally constrained еye enchancer / C. I. Swanson, D. B. Schwimmer, S. Barolo // Curr. Biol. — 2011. — Vol. 21, N 14. — P. 1186-1196.
I. Swanson, D. B. Schwimmer, S. Barolo // Curr. Biol. — 2011. — Vol. 21, N 14. — P. 1186-1196.
60. Preparing the next generation of genomicists: a laboratory-style course in medical genomics / M. D. Lindemann [et al.] // BMC med. genomics. — 2015. — Vol. 8, N 47. — P. 1-3.
61. Ngo, D. A. Genomic approaches to identifying targets for treating beta-hemoglobulinopathies / D. A. Ngo, M. H. Steinberg // BMC med. genomics. — 2015. — Vol. 8, N 44. — P. 1-13.
62. Karki, R. Defining «mutation» and «polymorphism» in the era of personal genomics / R. Karki, D. Pandya, R. C. Elston // BMC med. genomics. — 2015. — Vol. 8, N 37. — P. 1-8.
63. Alyass, A. From big data analysis to personalized medicine for all: challenges and apportunities / A. Alyass, M. Turlotbe, D. Meyre // BMC med. genomics. — 2015. — Vol. 8, N 33. — P. 1-12.
Alyass, M. Turlotbe, D. Meyre // BMC med. genomics. — 2015. — Vol. 8, N 33. — P. 1-12.
64. Титов, Л. П. Компьютерная иммунология: сравнительный анализ нуклеотидных замен в CDR и FR фрагментах генов иммуноглобулинов при гепатите С, криоглобулинемии и лейкозах / Л. П. Титов, Т. А. Столярова, Е. А. Столярова // Вес. НАН Беларусi Сер. мед. навук. — 2010. — № 3. — С. 10-18.
65. Medical genomics: The intricate path from genetic variant identification to clinical interpretation / B. Quintas [et al.] // Appl. & Transl. Genomics. — 2014. — Vol. 3. — Iss. 3. — P. 60-67.
Влияние метилирования ДНК на экспрессию гена тиреоглобулина при тиреоидной патологии | Туракулов
Аннотация
Влияние метилирования разных областей ДНК на экспрессию гена может проявляться на всех регуляторных уровнях, связанных с этим процессом: на уровне транскрипции и посттранскрипционном, на уровне трансляции и посттрансляционном. Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
Целью настоящей работы было исследование влияния метилирования ДНК на экспрессию гена ТГ при тиреоидной патологии. Нами была изучена возможность участия метилирования ДНК в регуляции экспрессии гена ТГ. Статус метилирования гена ТГ изучали при узловом эутиреоидном, диффузном токсическом зобах и при раке щитовидной железы. Была проанализирована 5′-фланкирующая область гена, которая содержит последовательности, признаваемые рестрикт азами НраН и MspI. Показано, что при раке щитовидной железы происходит гиперметилирование 5′-фланкирующей области гена ТГ. Эти данные свидетельствуют о том, что между экспрессией гена ТГ и его метилированием существует обратная корреляция.
Изучение закономерностей регуляции активности генов в клетках высших организмов является одной из интенсивно развивающихся областей молекулярной биологии и эндокринологии. В настоящее время накопилось довольно много данных о значении метилирования в регуляции генетической экспрессии. Влияние метилирования разных областей ДНК на экспрессию генов может проявляться на всех регуляторных уровнях, связанных с этим процессом: на уровне транскрипции и посттранскрипционном, на уровне трансляции и посттрансляционном. Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
В настоящее время накопилось довольно много данных о значении метилирования в регуляции генетической экспрессии. Влияние метилирования разных областей ДНК на экспрессию генов может проявляться на всех регуляторных уровнях, связанных с этим процессом: на уровне транскрипции и посттранскрипционном, на уровне трансляции и посттрансляционном. Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
Материалы и методы
Для выделения высокомолекулярной ДНК использовали щитовидные железы людей, удаленные во время операции по поводу зоба в лаборатории тиреоидной патологии Института эндокринологии АН Республики Узбекистан.
Выделение ДНК из клеток щитовидной железы проводили методом фенольной экстракции [2].
Рестрикционный анализ проводили с помощью рестрикционных эндонуклеаз BamHI, Hindlll, НраН, MspI. Фрагменты ДНК (1 мкг на пробу) разделяли методом электрофореза в 0,8% агарозном геле. Перенос ДНК из геля на нейлоновые фильтры «Biodan» осуществляли по методу К. Southern [4] в течение 24 ч.
Введение радиоактивной метки в плазмидную ДНК проводили методом нуклеотидного замещения с помощью ДНК-полимеразы Е. coli. Гибридизацию проводили с меченной 32Р плазмидной ДНК (удельная активность 107—108 имп/мкг) в течение 18 ч при 65°С в смеси, содержащей 4 х ССР, четырехкратный раствор Денхарта, 0,5 мг (У), 0,1% ДСН, 5% раствор декстрансульфата. После гибридизации фильтры тщательно отмывали и подвергали авторадиографии в течение 5—15 дней при —70°С, используя пленку РМ1 и усиливающие экраны.
Результаты и их обсуждение
Ранее при исследовании экспрессии гена ТГ при узловом эутиреоидном, диффузном токсическом и врожденном зобах, а также при раке щитовидной железы было показано снижение количества ТГ мРНК при узловом эутиреоидном и врожденном зобах. При раке щитовидной железы наблюдалось полное отсутствие ТГ мРНК. Выявленное снижение количества ТГ мРНК свидетельствовало о том, что при изученных видах тиреоидной патологии имеет место нарушение синтеза ТГ на уровне транскрипции [1].
Для того чтобы проанализировать, является ли снижение уровня ТГ мРНК результатом блокирования транскрипции гена или изменением стабильности ТГ мРНК, нами были проведены эксперименты по гибридизации ДНК, выделенной из клеток щитовидной железы при узловом эутиреоидном, диффузном токсическом зобах и при раке, с различными зондами.
Блокирование транскрипции гена ТГ при узловом эутиреоидном зобе может быть вызвано значительными перегруппировками в структуре гена ТГ в пределах кодирующей области или в пределах регуляторной фланкирующей 5-области гена.
Высокомолекулярная ДНК, выделенная из клеток щитовидной железы при диффузном токсическом, узловом эутиреоидном зобах и при раке, была обработана рестриктазами BamHI, Hindlll и гибридизована с различными зондами.
Для гибридизации использовали разные кДНК-зонды, которые покрывают 80% кодирующей ТГ области и фрагмент ДНК, близкий к 5 -области гена ТГ.
Мы исследовали возможность перегруппировок в пределах кодирующей области гена ТГ. На рис. 1 показано, что разницы в рестрикционных структурах ДНК из клеток щитовидной железы при узловом эутиреоидном и диффузном токсическом зобах нет. Эти данные ясно показывают, что значительных перегруппировок в ТГ-кодирующей области гена не обнаружено, что можно было бы отнести на счет транскрипционной реактивности этого гена при данной патологии.
Нами была исследована также возможность значительных перегруппировок в 5-фланкирующей области гена ТГ. В качестве зонда использовали фрагмент ДНК, близкий к 5-области гена. На рис. 2 видно, что разницы в рестрикционных структурах ДНК из клеток щитовидной железы при узловом эутиреоидном и диффузном токсическом зобах нет.
Таким образом, полученные данные показывают, что значительных перегруппировок в ТГ-кодирующей области и 5-фланкирующей области гена ТГ не обнаружено.
Мы исследовали возможность участия метилирования в регуляции экспрессии гена ТГ. Статус метилирования изучали в клетках щитовидной железы при раке и диффузном токсическом зобе. Была проанализирована 5-фланкирующая об-
Рис. 1. Авторадиограф образцов ДНК, обработанных рестриктазой BamHI.
Здесь и на рис. 2: / — узловой эутиреоидный зоб; 2 — диффузный токсический зоб.
ласть гена, которая содержит 2 последовательности, признаваемые рестриктазами, чувствительными к метилированию НраН и MspI, которые картируются соответственно на 680 и 1800 п. п. от исходного участка транскрипции [3].
Как показано на рис. 3, при обработке ДНК, выделенной из клеток щитовидной железы при раке, рестриктазой MspI наблюдается гиперметилирование 5-фланкирующей области гена ТГ при полном блокировании синтеза ТГ [1], т. е. между экспрессией гена ТГ и его метилированием существует обратная корреляция.
При изучении взаимосвязи экспрессии гена ТГ и его метилирования показано, что чувствительные к метилированию сайты, расположенные в
Рис. 3. Авторадиограф образцов ДНК, обработанных рестриктазой MspI.
1,4 — диффузный токсический зоб; 2 — рак щитовидной железы; 3 — узловой эутиреоидный зоб.
5-фланкирующей области гена, гиперметилируются при раке щитовидной железы, в то время как при диффузном токсическом зобе наблюдается недометилирование этих сайтов.
Участие метилирования ДНК в регуляции экспрессии гена ТГ подтверждено в работе F. Libert и G. Vassart [3]. Авторы определяли характер метилирования 5-концевой области гена ТГ человека в различных тканях. В щитовидной железе 1 из 4 НраН — MspI-сайтов найден в этой области, 3 сайта были неметилированы, тогда как в печени, слюнных железах и сперме наблюдали метилирование всех 4 сайтов. Следовательно, такое деметилирование коррелирует с экспрессией гена ТГ. Показано, что степень метилирования 5-конца гена ТГ, по-видимому, отражает активность гена во взрослых соматических тканях.
Деметилирование гена является сигналом, детерминирующим возможность его экспрессии. В целом ясно, что это относится главным образом к состоянию 5-области гена. Данные о роли недометилированности остальных частей гена пока отрывочны. Можно допустить, что изменение метилирования 5-области гена ТГ является важным, так как контролирует какие-то факторы транскрипции гена в его активации, являющиеся общими для всех генов.
При изучении взаимосвязи экспрессии гена ТГ и его метилирования показано, что чувствительные к метилированию сайты, расположенные в 5-фланкирующей области гена, гиперметилируются при раке щитовидной железы, в то время как при диффузном токсическом зобе наблюдается недометилирование этих сайтов.
Выводы
- Блокирование синтеза ТГ при раке щитовидной железы происходит при метилировании.
- При раке щитовидной железы наблюдается гиперметилирование 5 -фланкирующей области гена ТГ, т. е. между экспрессией гена и его метилированием существует обратная корреляция.
1. Кадырова Д. А., Атаханова Б. А., Туракулов Я. X., Шипицына Г. И. II Молекул, биол. — 1989. — Т. 23, № 4. — С. 1101-1106.
2. Шипицына Г. И., Лунц М. Г., Шифтер К. А. и др. // Генетика. 1980. Т. 16, № 1. С. 78-85.
3. Libert F., Vassart G. // Biochem. biophys. Res. Commun. — 1986. Vol. 134. P. 1109-1116.
4. Southern К M. // J. Mol. Biol. 1973. Vol. 98. P. 509-517.
Экспрессия — что это и как она проявляется?
Вам приходилось слышать выражения «экспрессивная девушка» или «экспрессивный танец»? Слово «экспрессия» в переводе означает выразительность, интенсивное проявление настроения и эмоций. Экспрессия еще толкуется в качестве предъявления другим людям скрытых психологических личностных особенностей для прямого наблюдения.
Определение экспрессии
Что такое экспрессия? В медицине это генетический процесс, посредством которого содержащаяся в генах информация преобразуется в определенные клеточные структуры. Экспрессивность в биологии – это неразрывно связанное с жизнедеятельностью и здоровьем человека определение, которое получает дальнейшее развитие в психологии и психотерапии. К этой же медицинско-биологической сфере относится понятие «экспрессировать» – это означает транскрибировать и транслировать ген.
Экспрессивность – это степень выраженности определенного состояния, чувства, эмоции, отношения. Понятия «экспрессивность» и «экспрессия» применяются не только в психологии, но и в театроведении, искусствоведении, если требуется подчеркивать уровень выраженности духовности. А также показать средства выражения, к примеру, живопись, музыка, архитектурные элементы. Получается, что в имеющихся определениях данных терминов есть указания на связь этого явления с душевным и духовным миром людей.
Экспрессия – это выразительность чувств и эмоций, показ внутреннего состояния путем проявления его во внешности.
Противоположным по смыслу значением является импрессивность – склонность к внутренним, а не внешним переживаниям, накоплению преимущественно отрицательных чувств. О таких людях говорят, что они держат переживания в себе, не склонны делиться эмоциями и проблемами, обиды и расстройства к ним приходят не сразу, не моментально.
Мнения о связи внутреннего мира людей и экспрессии, которые сформировались по большей части в искусствоведении и философии, дополняются психологией. Сущность этой связи в психологическом выражении видна в том, что экспрессия получает место не только сопровождения действий внешне. Она выступает частью данных явлений, формой их проявления.
Экспрессивная девушка рассказывает что-то своей подругеПо этой причине стоит говорить об экспрессии в виде личностного образования, способа познания духовного мира личности, а также в качестве внешнего «Я».
Экспрессивное поведение
В науке под личностным экспрессивным поведением подразумевается соединение стойких и изменяющихся средств выражения, что организуются в разного рода структуры. Они перестраиваются в процессе создания социальных и психологических личностных качеств.
Подобное соединение средств включает части, которые обладают разным развитием изменений, а также отличаются уровнем требуемых усилий для этой цели. Итак, в составе личностного экспрессивного поведения содержатся части, которые обладают высоким уровнем непостоянства (мимика, интонации), в том числе средним и низким уровнями. Если человек экспрессивен, это включает и физиогномические элементы выразительности, одежда и прическа относятся к среднему уровню непостоянства. Существует также понятие «экспрессивный репертуар человека», означающий набор поз, интонаций, жестов, мимических состояний и их комбинаций для различных ситуаций общения.
Что такое экспрессивный человек? Это значит, что поведение личности представляет собой постоянно изменяющееся самоизваяние. Наше тело является зеркалом, которое отражает действие внешности и души. Внутренние перемены личности тянут за собой внешние изменения. По этой причине внешний вид не является беспорядочным сочетанием элементов, а строгим четким отражением личностных особенностей.
В экспериментальной науке привилегию получают непостоянные элементы экспрессии. Это сочетание движений, которые неустанно меняются согласно с положением и отношением человека. Подобные движения показываются с применением оптической системы. К зрительным методам общения психологами относится кинесика. Она являет собой широту движений, которая воспринимается зрительно и несет разную информацию с разных точек зрения партнеров. В ее состав включены только показательные жесты и позы с четкой семантикой.
Экспрессивных людей отличает эмоциональное, выразительное поведениеЭкспрессивные действия в виде внешнего «Я» связаны с его непостоянными и стойкими подструктурами. Это действительный показатель множества черт личности. Его можно рассматривать в виде:
проявления выразительных элементов всеобщей личностной активности, которая связана с темпераментом;
выразительного состава состояний психики;
показателя модальности знаков связи одной личности с другой;
способы экспрессии качеств;
признака развитости личности как субъекта коммуникации;
показа выразительных элементов социального статуса человека;
скрытия внешних «Я» личности;
способа показа и создания допустимого поведения.
Экспрессивность личности
Экспрессивность личности – это умение ярко и живо показывать собственные чувства, эмоции и отношение. Это понятие противоположно сдержанности. По мнению А. Маслоу, в нормальной личности обе черты существуют в гармонии, балансе. Адекватная личность не просто спонтанна: она спонтанна и экспрессивна тогда, когда ей этого хочется. Она способна расслабляться, отказываться от контроля, когда это к месту. Но такая личность способна и контролировать себя, откладывать удовольствия, проявлять вежливость и т. д.
В сопутствующих экспрессивности качествах нет обдуманности, осторожности, разумности и самообладания. Ее спутниками является возбудимость, внезапность и восторженность.
Наша душа отличается природной красотой. В зависимости от качеств личности, которые обуславливают демонстрацию энергетики души, наружу выходят инстинктивность, темпераментность, восторженность. А если энергетика души обуславливается пороками, то во внешнем мире проявляется необузданность и излишняя эмоциональность.
Экспрессивная личность проявляет все эмоции и чувства ярко, несдержанно. Для нее характерна чрезмерная возбудимость.
Слово «экспрессия» пришло из латыни – expressio, что означает нагнетание и выжимание. Экспрессия является внешним выражением переживаний и эмоций в первую очередь. Сюда стоит отнести слезы, истерику, восклицания, эмоциональные жесты, печаль, крики, апатичное состояние. В лингвистике русского языка присутствует термин «экспрессема» – это стилистическая единица, которая служит для раскрытия выразительных конструкций.
В каждой культуре экспрессивность в виде личностной черты по-разному трактуется. Активно жестикулирующий испанец в странах Прибалтики будет считаться экспрессивным человеком. Но на Родине его примут за меланхоличного человека. Получается, что проявление экспрессии немало определяется особенностью культуры.
Экспрессивная личность проявляет все эмоции и чувства ярко, несдержанноВ психологии эмоциональная экспрессия – это выразительность, сила проявления чувств, переживаний. Она рассматривается в виде обширного набора средств, применяя который личность показывает свои способности другим. Экспрессию в виде показа эмоций сумели «поймать» художники-экспрессионисты. Если зрители способны видеть в работах выражение эмоций, то они считаются экспрессивными.
Заключение
Понятно, что нет такого прибора или датчика, чтобы измерить, сколько экспрессии содержится в картине художника, хореографическом танце или поведении человека. Экспрессивные действия являются зеркалом, которое отражает или показывает состояние личности. Более того, подобное поведение – это часть естественного состояния человека.
И на десерт предлагаем видео – по-настоящему экспрессивное выступление гимнасток на Кубке России по эстетической гимнастике:
Международный научный семинар и практическая школа «Экспрессия генов»
7 декабря 2016 года аспирантка кафедры биохимии, молекулярной биологии и генетики Екатерина Сивопляс выступила с докладом «Регуляция экспрессии высококонсервативного гена Dras1 с помощью микроРНК у дрозофил группы virilis» на международном научном семинаре и практической школе «Экспрессия генов», проходившей 7-9 декабря на факультете биоинженерии и биоинформатики Московского государственного университета имени М.В. Ломоносова. В рамках международного семинара участвовал приглашенный докладчик Дэвид Жетьен, Институт Мари Кюри (Париж, Франция), который представил доклад об использовании результатов анализа экспрессии генов в диагностике опухолей. Третьим днем работы конференции стала практическая школа, на которой были представлены современное оборудование и методики работы по экспрессии генов.
На международном семинаре были обсуждены следующие фундаментальные вопросы:
• Регуляторные элементы генома;
• Факторы транскрипции и хроматин;
• Биология мРНК;
• Экспрессия генов в норме и при патологии.
Культура
Новогодний флеш-моб в Институте биологии и химии30 / 12 / 2020
В преддверии Нового Года каждый спешит поздравить друг друга: покупают подарки, записывают видео-ролики, некоторые пишут письма, участвуют в семейной фотосессии. Всюду царит предпраздничная суета. Улицы украшены, в окнах горят гирлянды, запах мандаринов и корицы слышен в воздухе. 2021 ждут с…
Культура
Поздравления с Новым годом из городов России29 / 12 / 2020
Все меньше дней остаётся в этом году и все ближе становится новый, 2021 год. Несмотря на количество испытаний, выпавших в этом году на преподавателей и студентов Института биологии и химии, мы смогли достойно их вынести и подойти к дверям Нового…
Новости образования
Из Москвы в Усть-Чём29 / 12 / 2020
Выпускница Института биологии и химии 2020 года Любовь Артюхина прошла отбор по программе «Учитель для России» и отправилась в Новосибирскую область учительствовать в сельскую школу! Люба с воодушевлением рассказывала о школе, рассчитанной на 200 человек, об оборудовании в кабинете биологии,…
Новости МПГУ
Студенты Института биологии и химии приняли участие в Эстафете успеха11 / 12 / 2020
10 декабря 2020 года состоялась общественно-педагогическая акция «Эстафета профессионального успеха». В её рамках проходили различные мастер-классы, некоторые из которых посетили студенты Института биологии и химии. Так, студенты 3 курса Института биологии и химии МПГУ посетили мастер-класс «Проекты и исследования школьников по…
Новости МПГУ
Взгляд, устремлённый в будущее10 / 12 / 2020
Для координации студентов Института биологии и химии МПГУ 4 декабря 2020 года на Форсайт-сессии в рамках Всероссийского форума «Новая образовательная среда 20/21», которую запустило Министерство просвещения России, была проведена работа над актуальным проектом, посвящённым школе будущего. В его основу легли…
Новости МПГУ
Экологичный новый год10 / 12 / 2020
Не так давно студенческий экологический клуб Recovery_MSPU провёл социальной опрос среди студентов и преподавателей нашего университета. Его цель — узнать, насколько экологично празднуется Новый год в нашей стране. Респондентам предлагалось ответить на вопросы о том, какие украшения они используют для…
Что такое экспрессия гена? | Факты
Экспрессия гена — это процесс, с помощью которого инструкции в нашей ДНК преобразуются в функциональный продукт, такой как белок.
- Когда информация, хранящаяся в нашей ДНК, преобразуется в инструкции по созданию белков или других молекул, это называется экспрессией генов.
- Экспрессия гена — это строго регулируемый процесс, который позволяет клетке реагировать на изменение окружающей среды.
- Он действует как переключатель включения / выключения для управления производством белков, а также как регулятор объема, который увеличивает или уменьшает количество производимых белков.
- Есть два ключевых этапа создания белка: транскрипция и трансляция.
Транскрипция
- Транскрипция — это когда ДНК в гене копируется для получения транскрипта РНК, называемого информационной РНК (мРНК).
- Это осуществляется ферментом, называемым РНК-полимеразой, который использует доступные основания из ядра клетки для формирования мРНК.
- РНК — это химическое вещество, сходное по структуре и свойствам с ДНК, но оно имеет только одну цепь оснований, а вместо основания тимина (T) РНК имеет основание, называемое урацилом (U).
Иллюстрация, показывающая процесс транскрипции.
Изображение предоставлено: Genome Research Limited
Трансляция
- Трансляция происходит после того, как информационная РНК (мРНК) передала транскрибированное «сообщение» от ДНК к фабрикам по производству белка в клетке, называемым рибосомами.
- Сообщение, переносимое мРНК, считывается молекулой-носителем, называемой транспортной РНК (тРНК).
- МРНК считывается по трем буквам (кодону) за раз.
- Каждый кодон определяет определенную аминокислоту. Например, три основания «GGU» кодируют аминокислоту под названием глицин.
- Поскольку существует только 20 аминокислот, но 64 потенциальных комбинации кодонов, более одного кодона могут кодировать одну и ту же аминокислоту. Например, кодоны «GGU» и «GGC» кодируют глицин.
- Каждая аминокислота специфически прикрепляется к своей собственной молекуле тРНК.
- Когда последовательность мРНК считывается, каждая молекула тРНК доставляет свою аминокислоту на рибосому и временно связывается с соответствующим кодоном на молекуле мРНК.
- Как только тРНК связывается, она высвобождает свою аминокислоту, и все соседние аминокислоты объединяются в длинную цепь, называемую полипептидом.
- Этот процесс продолжается до образования белка.
- Белки выполняют большинство активных функций клетки.
Иллюстрация, показывающая процесс перевода.
Изображение предоставлено: Genome Research Limited
Эта страница последний раз обновлялась 25.01.2016
белков и экспрессия генов | Изучайте науку в Scitable
Через призму клеточной биологии изучение экспрессии генов тесно связано с нашим пониманием белков.Начиная с ранних работ Кристиана Анфинсена в 1950-х годах, мы знаем, что последовательность аминокислот в белке определяет его окончательную трехмерную структуру. Исходя из этого, ученые неоднократно наблюдали, что структура белка определяет, где он будет действовать и что он будет делать. Нигде это не было так очевидно, как с функцией ферментов. Форма и структура белков — это важный аспект биологии экспрессии генов, который связывает наше понимание экспрессии генов с биологией клетки.Хотя в первую очередь речь идет о белковых молекулах, которые действуют на последовательности ДНК и РНК, таких как факторы транскрипции и гистоны, изучение экспрессии генов также сосредоточено на том, где в клетке модулируется экспрессия. Фактически, модуляция экспрессии генов может происходить в ядре, цитоплазме или даже на клеточной мембране из-за воздействия белков на РНК в этих клеточных субрегионах.
Как ученые изучают форму и функцию белка? Метод, называемый масс-спектрометрией, позволяет ученым определять последовательность аминокислот в белке.После того, как последовательность известна, сравнение ее аминокислотной последовательности с базами данных позволяет ученым определить, существуют ли связанные белки, функция которых уже известна. Часто аналогичные аминокислотные последовательности будут выполнять аналогичные функции в клетке. Аминокислотная последовательность также позволяет ученым предсказать заряд молекулы, ее размер и вероятную трехмерную структуру. Позже заряд и размер могут быть подтверждены экспериментально (с помощью SDS-PAGE и двухмерных гелей). Чтобы понять сложности трехмерной структуры, ученые попытаются кристаллизовать белок, чтобы подтвердить его молекулярную структуру с помощью рентгеновской кристаллографии и / или спектроскопии ядерного магнитного резонанса (pNMR).
Как ученые изучают влияние белков на гены или другие белки? Хороший способ изучить функцию белка — посмотреть, что происходит в клетке, когда белок отсутствует. Для этого ученые используют модельные системы, такие как культура клеток или целые организмы, в которых они могут тестировать функцию определенных белков или генов, изменяя или мутируя их. Уровень экспрессии гена может быть рассчитан путем измерения транскрибированной мРНК (нозерн-блот), экспрессированного белка (вестерн-блот) или путем прямого окрашивания белка или мРНК, когда они все еще находятся в клетке.Новые методы изменили способ изучения экспрессии генов — микроматрицы ДНК, последовательный анализ экспрессии генов (SAGE) и высокопроизводительное секвенирование позволяют проводить более широкий анализ нескольких молекул одновременно и открывают возможность для новых и более широких видов вопросов. Чтобы проанализировать большие наборы данных и увидеть, как взаимодействуют сети молекул, новая дисциплина, называемая системной биологией, обеспечивает основу для более широкого и интегрированного понимания регуляторных сетей.
Интересно, что белки — не единственные регуляторы генов.Регуляторные молекулы имеют форму РНК и действуют на другие нуклеиновые кислоты, изменяя или разрушая их. Одним из примеров является семейство рибопереключателей, молекул рибонуклеиновой кислоты, которые образуют трехмерные структуры, которые останавливают или препятствуют транскрипции при наличии надлежащего внешнего сигнала. Другим примером воздействия РНК на другие РНК является механизм РНК-интерференции (РНКи), при котором молекулы двухцепочечной РНК разлагают мРНК перед трансляцией, таким образом эффективно препятствуя экспрессии белка.Рассмотрение этого механизма и его последующее экспериментальное имитация было благом для тех, кто заинтересован в манипулировании функцией генов.
В конечном счете, результаты исследований такого рода имеют фундаментальное значение — от базового понимания нормальных функций клеток, таких как дифференциация, рост и деление клеток, до разработки принципиально новых подходов к лечению заболеваний. Фактически, некоторые заболевания человека могут возникать просто из-за дефекта трехмерной структуры белка.Изучая экспрессию генов и белков, легко увидеть, как мелкие изменения на молекулярном уровне имеют реверберирующий эффект.
Изображение: Библиотека биохимических алгоритмов.
экспрессии генов | Биология для майоров I
Результаты обучения
- Обсудите, почему каждая клетка не экспрессирует все свои гены
Чтобы клетка функционировала должным образом, необходимые белки должны синтезироваться в нужное время.Все клетки контролируют или регулируют синтез белков на основе информации, закодированной в их ДНК. Процесс включения гена для производства РНК и белка называется экспрессией гена . Будь то простой одноклеточный организм или сложный многоклеточный организм, каждая клетка контролирует, когда и как экспрессируются ее гены. Чтобы это произошло, должен существовать механизм, позволяющий контролировать, когда ген экспрессируется для образования РНК и белка, сколько белка производится и когда пора прекратить производство этого белка, потому что он больше не нужен.
Регулирование экспрессии генов сохраняет энергию и пространство. Организму потребуется значительное количество энергии для постоянной экспрессии каждого гена, поэтому более энергоэффективно включать гены только тогда, когда они необходимы. Кроме того, экспрессия только подмножества генов в каждой клетке экономит место, потому что ДНК необходимо раскручивать из ее плотно скрученной структуры, чтобы транскрибировать и транслировать ДНК. Клетки должны были бы быть огромными, если бы каждый белок экспрессировался в каждой клетке все время.
Контроль экспрессии генов чрезвычайно сложен. Сбои в этом процессе губительны для клетки и могут привести к развитию многих заболеваний, в том числе рака.
Генная регуляция делает клетки разными
Регуляция гена — это то, как клетка контролирует, какие гены из множества генов в ее геноме «включаются» (экспрессируются). Благодаря регуляции генов каждый тип клеток в вашем теле имеет разный набор активных генов, несмотря на то, что почти все клетки вашего тела содержат одну и ту же ДНК.Эти разные паттерны экспрессии генов приводят к тому, что разные типы клеток имеют разные наборы белков, что делает каждый тип клеток уникально специализированным для выполнения своей работы.
Например, одна из функций печени — удалять токсичные вещества, такие как алкоголь, из кровотока. Для этого клетки печени экспрессируют гены, кодирующие субъединицы (кусочки) фермента, называемого алкогольдегидрогеназой. Этот фермент расщепляет алкоголь на нетоксичные молекулы. Нейроны в мозгу человека не выводят токсины из организма, поэтому они сохраняют эти гены невыраженными или «выключенными».Точно так же клетки печени не посылают сигналы с помощью нейротрансмиттеров, поэтому они отключают гены нейротрансмиттеров (рис. 1).
Рис. 1. В разных клетках «включены» разные гены.
Есть много других генов, которые по-разному экспрессируются в клетках печени и нейронах (или любых двух типах клеток в многоклеточном организме, таком как вы).
Как клетки «решают», какие гены включить?
Возникает каверзный вопрос! Множество факторов, которые могут повлиять на то, какие гены экспрессирует клетка.Как мы видели выше, разные типы клеток экспрессируют разные наборы генов. Однако две разные клетки одного и того же типа могут также иметь разные паттерны экспрессии генов в зависимости от их среды и внутреннего состояния.
Вообще говоря, мы можем сказать, что паттерн экспрессии гена в клетке определяется информацией как изнутри, так и вне клетки.
- Примеры информации от внутри клетки : белки, которые она унаследовала от материнской клетки, повреждена ли ее ДНК и сколько в ней АТФ.
- Примеры информации от за пределами клетки: химические сигналы от других клеток, механические сигналы от внеклеточного матрикса и уровни питательных веществ.
Как эти сигналы помогают клетке «решить», какие гены экспрессировать? Клетки не принимают решений в том смысле, в каком это сделали бы вы или я. Вместо этого у них есть молекулярные пути, которые преобразуют информацию, такую как связывание химического сигнала с его рецептором, в изменение экспрессии генов.
В качестве примера рассмотрим, как клетки реагируют на факторы роста.Фактор роста — это химический сигнал от соседней клетки, который заставляет клетку-мишень расти и делиться. Можно сказать, что клетка «замечает» фактор роста и «решает» делиться, но как эти процессы на самом деле происходят?
Рисунок 2. Фактор роста, провоцирующий деление клетки
- Клетка обнаруживает фактор роста посредством физического связывания фактора роста с рецепторным белком на поверхности клетки.
- Связывание фактора роста заставляет рецептор изменять форму, вызывая серию химических событий в клетке, которые активируют белки, называемые факторами транскрипции.
- Факторы транскрипции связываются с определенными последовательностями ДНК в ядре и вызывают транскрипцию генов, связанных с делением клетки.
- Продукты этих генов представляют собой различные типы белков, которые заставляют клетку делиться (стимулировать рост клеток и / или продвигать клетку вперед в клеточном цикле).
Это всего лишь один пример того, как клетка может преобразовать источник информации в изменение экспрессии генов. Есть много других, и понимание логики регуляции генов — это область текущих исследований в биологии сегодня.
Передача сигналов фактора роста сложна и включает активацию множества мишеней, включая как факторы транскрипции, так и белки факторов нетранскрипции.
Вкратце: Экспрессия генов
- Регуляция генов — это процесс контроля того, какие гены в ДНК клетки экспрессируются (используются для производства функционального продукта, такого как белок).
- Различные клетки многоклеточного организма могут экспрессировать очень разные наборы генов, даже если они содержат одну и ту же ДНК.
- Набор генов, экспрессируемых в клетке, определяет набор белков и функциональных РНК, которые она содержит, что придает ей уникальные свойства.
- У эукариот, таких как люди, экспрессия генов включает много этапов, и регуляция генов может происходить на любом из этих этапов. Однако многие гены регулируются в первую очередь на уровне транскрипции.
Алкогольдегидрогеназа. (2016, 6 января). Получено 26 апреля 2016 г. из Википедии: https://en.wikipedia.org/wiki/Alcohol_dehydrogenase.
Купер, Г. М. (2000). Регуляция транскрипции у эукариот. In Клетка: молекулярный подход . Сандерленд, Массачусетс: Sinauer Associates. Получено с http://www.ncbi.nlm.nih.gov/books/NBK9904/.
Кимбалл, Джон В. (2014, 19 апреля). Геномы человека и шимпанзе. В страницах биологии Кимбалла . Получено с http://www.biology-pages.info/H/HominoidClade.html.
Колледж OpenStax, Биология. (2016, 23 марта). Регуляция генов транскрипции эукариот.В _OpenStax CNX. Получено с http://cnx.org/contents/[email protected]:7Ry3oRse@5/Eukaryotic-Transcription-Gene-.
Колледж OpenStax, Биология. (2016, 23 марта). Регуляция экспрессии генов. В _OpenStax CNX. Получено с http://cnx.org/contents/[email protected]:dQV50wLv@7/Regulation-of-Gene-Expression
Филлипс, Т. (2008). Регуляция транскрипции и экспрессии генов у эукариот. Nature Education , 1 (1), 199. Получено с http: //www.nature.com / scitable / topicpage / регуляция-транскрипции-и-экспрессии-генов-в-1086.
Первес, В. К., Садава, Д. Э., Орианс, Г. Х., Хеллер, Х. К. (2003). Транскрипционная регуляция экспрессии генов. В Жизнь: Биология (7-е изд., Стр. 290-296). Сандерленд, Массачусетс: Sinauer Associates.
Рис, Дж. Б., Урри, Л. А., Каин, М. Л., Вассерман, С. А., Минорски, П. В., и Джексон, Р. Б. (2011). Экспрессия эукариотических генов регулируется на многих этапах. В Campbell Biology (10-е изд., стр. 365-373). Сан-Франциско, Калифорния: Пирсон.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
4.11: Экспрессия генов — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Экспрессия гена
- Как регулируется экспрессия гена
- Сводка
- Узнать больше
- Review
Может ли ваша экспрессия измениться в любой момент?
Как известно, выражение лица человека может меняться мгновенно.Выражение, которое демонстрируется, обычно подходит для чувств в этот момент. Экспрессия гена — это использование гена, продукт которого необходим в данный момент. Это может быть момент в процессе развития, это может быть момент повышенной тревожности или может быть реакцией на изменение окружающей среды. Когда нужен конкретный белок, его обеспечивает экспрессия генов.
Экспрессия гена
Каждая из ваших клеток имеет не менее 20 000 генов. Фактически, все ваши клетки имеют одни и те же гены.Все ли ваши клетки производят одни и те же белки? Очевидно нет. Если бы они это сделали, то все ваши клетки были бы похожи. Вместо этого у вас есть клетки с разными структурами и функциями. Это потому, что разные клетки производят разные белки. Они делают это, используя или экспрессируя разные гены. Использование гена для создания белка называется экспрессией гена .
Как регулируется экспрессия генов
Экспрессия генов регулируется, чтобы гарантировать, что правильные белки производятся тогда и там, где они необходимы.Регуляция может происходить в любой момент экспрессии гена, от начала транскрипции до процессинга белка после трансляции. Ниже приводится список стадий, на которых регулируется экспрессия гена:
- Химическая и структурная модификация ДНК или хроматина
- Транскрипция
- Трансляция
- Посттранскрипционная модификация
- Транспорт РНК
- Деградация мРНК
- Посттрансляционные модификации
Как показано на Рисунке ниже, транскрипция контролируется регуляторными белками , связывающимися с ДНК.В частности, регуляция генов на уровне транскрипции контролирует, когда транскрипция происходит, а также сколько создается РНК. Регуляторный белок, или фактор транскрипции , представляет собой белок, участвующий в регуляции экспрессии генов. Обычно он связан с цис-регуляторным элементом , который является частью ДНК. Регуляторные белки часто должны быть связаны с цис-регуляторным элементом, чтобы включить ген (активатор , ) или выключить ген (репрессор , ).
Транскрипция гена РНК-полимеразой может регулироваться по крайней мере пятью механизмами:
- Факторы специфичности (белки) изменяют специфичность РНК-полимеразы в отношении промотора или набора промоторов, делая ее более или менее вероятной для связывания с промотор и начать транскрипцию.
- Белки-активаторы усиливают взаимодействие между РНК-полимеразой и конкретным промотором.
- Репрессорные белки связываются с некодирующими последовательностями ДНК, которые находятся рядом с промоторной областью или перекрывают ее, препятствуя продвижению РНК-полимеразы по цепи.
- Базальные факторы — это факторы транскрипции, которые помогают позиционировать РНК-полимеразу в начале гена.
- Энхансеры — это участки на цепи ДНК, которые связываются активаторами, чтобы создать петлю ДНК, привнося в комплекс инициации специфический фактор транскрипции.Инициирующий комплекс состоит из РНК-полимеразы и факторов транскрипции.
По мере того, как организм становится более сложным, регуляция генов становится более сложной, хотя прокариотические организмы обладают некоторыми строго регулируемыми системами. Некоторые гены человека контролируются множеством активаторов и репрессоров, работающих вместе. Очевидно, что мутация в цис-регуляторной области, такой как промотор, может сильно повлиять на правильную экспрессию гена. Он может постоянно держать ген выключенным, так что белок не может быть произведен, или он может держать ген постоянно включенным, так что соответствующий белок вырабатывается постоянно.Оба они могут иметь пагубные последствия для клетки.
Регулирование транскрипции. Регуляторные белки связываются с регуляторными элементами для контроля транскрипции. Регуляторные элементы встроены в ДНК.
Резюме
- Транскрипция гена контролируется регуляторными белками, которые связываются с регуляторными элементами ДНК.
- Белки обычно либо активируют, либо репрессируют транскрипцию.
Узнать больше
Используйте этот ресурс, чтобы ответить на следующие вопросы.
- Что такое экспрессия гена? на сайте www.news-medical.net/health/What-is-Gene-Expression.aspx.
- Что такое экспрессия гена?
- Что нужно для начала транскрипции?
- Что получается при «чтении» ДНК?
- Где находится промотор гена по отношению к сайту начала транскрипции?
Обзор
- Что такое экспрессия гена?
- Почему регулируется экспрессия генов?
- Перечислите три стадии, на которых регулируется экспрессия генов.
- Опишите, как регуляторные белки регулируют экспрессию генов.
- Сравните активаторы с репрессорами.
Экспрессия и регуляция генов — Лестерский университет
Экспрессия гена
Экспрессия гена — это процесс, с помощью которого генетический код — нуклеотидная последовательность — гена используется для управления синтезом белка и создания структур клетки. Гены, кодирующие аминокислотные последовательности, известны как «структурные гены».
Процесс экспрессии гена включает два основных этапа:
Транскрипция: производство информационной РНК (мРНК) ферментом РНК-полимеразой и обработка полученной молекулы мРНК.
Трансляция : использование мРНК для управления синтезом белка и последующий посттрансляционный процессинг белковой молекулы.
Некоторые гены ответственны за производство других форм РНК, которые играют роль в трансляции, включая РНК переноса (тРНК) и рибосомную РНК (рРНК).
Структурный ген включает ряд различных компонентов:
- экзонов. Экзоны кодируют аминокислоты и вместе определяют аминокислотную последовательность белкового продукта. Именно эти части гена представлены в конечной зрелой молекуле мРНК.
- Интронов. Интроны — это части гена, которые не кодируют аминокислоты и удаляются (сплайсируются) из молекулы мРНК перед трансляцией.
Области контроля генов
- Стартовая площадка .Стартовый сайт для транскрипции.
- Промоутер . Область на несколько сотен нуклеотидов «выше» гена (ближе к 5′-концу). Он не транскрибируется в мРНК, но играет роль в контроле транскрипции гена. Факторы транскрипции связываются со специфическими нуклеотидными последовательностями в промоторной области и способствуют связыванию РНК-полимераз.
- Усилители . Некоторые факторы транскрипции (называемые активаторами) связываются с участками, называемыми «энхансерами», которые увеличивают скорость транскрипции.Эти сайты могут состоять из тысяч нуклеотидов кодирующих последовательностей или внутри интрона. Некоторые энхансеры являются условными и работают только в присутствии других факторов, а также факторов транскрипции.
- Глушители . Некоторые факторы транскрипции (называемые репрессорами) связываются с участками, называемыми «сайленсерами», которые снижают скорость транскрипции.
Примечание. Термин «экспрессия гена» иногда используется для обозначения только фазы транскрипции.
Транскрипция
Транскрипция — это процесс синтеза РНК, контролируемый взаимодействием промоторов и энхансеров.Производится несколько различных типов РНК, в том числе матричная РНК ( мРНК ), которая определяет последовательность аминокислот в белковом продукте, плюс РНК-переносчик ( тРНК ) и рибосомная РНК ( рРНК ). ), которые играют роль в процессе перевода.
Транскрипция включает четыре этапа:
- Инициирование . Молекула ДНК раскручивается и разделяется с образованием небольшого открытого комплекса .РНК-полимераза связывается с промотором матричной цепи .
- Удлинение . РНК-полимераза перемещается по матричной цепи, синтезируя молекулу мРНК. В прокариотах РНК-полимераза представляет собой холофермент, состоящий из ряда субъединиц, включая сигма-фактор (фактор транскрипции), который распознает промотор. У эукариот есть три РНК-полимеразы: I, II и III. Процесс включает в себя механизм корректуры.
- Прекращение действия .У прокариот есть два пути обрыва транскрипции. В Rho-зависимом терминации белковый фактор, называемый «Rho», ответственен за разрушение комплекса, включающего матричную цепь, РНК-полимеразу и молекулу РНК. В Rho-независимом окончании на конце молекулы РНК образуется петля, заставляющая ее отщепляться. Терминирование у эукариот более сложное, включая добавление дополнительных нуклеотидов аденина в 3 ‘транскрипта РНК (процесс, называемый полиаденилированием ).
- Обработка . После транскрипции молекула РНК подвергается процессингу несколькими способами: интроны удаляются, а экзоны соединяются вместе, образуя зрелую молекулу мРНК, состоящую из единственной последовательности, кодирующей белок. Синтез РНК включает нормальные правила спаривания оснований, но основание тимина заменяется основанием урацилом .
Перевод
При трансляции зрелая молекула мРНК используется в качестве матрицы для сборки ряда аминокислот для получения полипептида с определенной аминокислотной последовательностью.Комплекс в цитоплазме, в котором это происходит, называется рибосомой . Рибосомы представляют собой смесь рибосомных белков и рибосомальной РНК (рРНК) и состоят из большой субъединицы и небольшой субъединицы.
Перевод состоит из четырех этапов:
- Инициирование . Маленькая субъединица рибосомы связывается на 5′-конце молекулы мРНК и движется в 3′-направлении, пока не встретит стартовый кодон (AUG). Затем он образует комплекс с большой единицей рибосомного комплекса и инициирующей молекулой тРНК.
- Удлинение . Последующие кодоны на молекуле мРНК определяют, какая молекула тРНК, связанная с аминокислотой, связывается с мРНК. Фермент пептидилтрансфераза связывает аминокислоты вместе с помощью пептидных связей. Процесс продолжается, образуя цепочку аминокислот по мере того, как рибосома движется вдоль молекулы мРНК.
- Прекращение действия . Трансляция прекращается, когда рибосомный комплекс достигает одного или нескольких стоп-кодонов (UAA, UAG, UGA). Рибосомный комплекс у эукариот крупнее и сложнее, чем у прокариот.Кроме того, процессы транскрипции и трансляции у эукариот разделены между ядром (транскрипция) и цитоплазмой (трансляция), что предоставляет больше возможностей для регуляции экспрессии генов.
- Посттрансляционная обработка белка
Генная регуляция
Регуляция генов — это метка для клеточных процессов, которые контролируют скорость и характер экспрессии генов. Сложный набор взаимодействий между генами, молекулами РНК, белками (включая факторы транскрипции) и другими компонентами системы экспрессии определяет, когда и где активируются определенные гены, а также количество продуцируемого белка или продукта РНК.
Некоторые гены экспрессируются непрерывно, поскольку они продуцируют белки, участвующие в основных метаболических функциях; некоторые гены экспрессируются как часть процесса дифференцировки клеток; и некоторые гены экспрессируются в результате дифференцировки клеток.
Механизмы регуляции генов включают:
- Регулировка скорости транскрипции. Это наиболее экономичный способ регулирования.
- Регулирование процессинга молекул РНК, включая альтернативный сплайсинг для получения более чем одного белкового продукта из одного гена.
- Регулирование стабильности молекул мРНК.
- Регулирование скорости перевода.
Факторы транскрипции — это белки, которые играют роль в регуляции транскрипции генов путем связывания со специфическими регуляторными нуклеотидными последовательностями.
Вернуться к началу
Это произведение находится под лицензией Creative Commons License.
Экспрессия гена— обзор
3.3 Базы данных по геномной экспрессии
Базы данных по экспрессии генов на геномном уровне включают Атлас экспрессии генов мышей (таблица 1.3; Siddiqui et al ., 2005). Этот атлас обеспечивает доступ к библиотекам последовательного анализа экспрессии генов (SAGE), полученным из эмбрионов мыши на всех стадиях развития, включая оплодотворенные яйца и эмбриональные стволовые (ES) клетки. Подход был разработан для идентификации дифференциально экспрессируемых генов на протяжении эмбриогенеза. Библиотеки SAGE и программное обеспечение DiscoverySpace для анализа общедоступны и содержат ссылки на другие общедоступные базы данных.Гены, представляющие интерес в Атласе экспрессии генов мышей, должны быть локализованы путем ссылки на базы данных экспрессии, которые включают анатомические аннотации.
Таблица 1.3. Геномные библиотеки экспрессии генов
| Мышиный Атлас экспрессии генов |
| http://www.mouseatlas.org/data/mouse/devstages |
| GermSAGE: Транскриптом мужской зародышевой клетки |
| http: //germsage.nichd.nih.gov |
| GonadSAGE: транскриптом мужских эмбриональных гонад |
| http: // gonadsage.nichd.nih.gov |
| Атлас экспрессии генов ArrayExpress |
| http://www.ebi.ac.uk/microarray-as/atlas |
| Омнибус экспрессии генов |
| http: // www .ncbi.nlm.nih.gov / geo |
| База данных экспрессии генов в 4D |
| http://4dx.embl.de/4DXpress |
GermSAGE и GonadSAGE предназначены для транскриптома мужского зародыша клетки и развивающиеся гонады самцов мыши соответственно (таблица 1.3; Ли и др. , 2009, 2010). Для GermSAGE библиотеки получали из сперматогоний типа А, пахитеновых сперматоцитов или круглых сперматид. Для GonadSage библиотеки были сконструированы из гонад самцов мышей, собранных на e10.5, e11.5, e12.5, e13.5, e15.5 и e17.5. База данных с возможностью поиска по названию гена доступна для каждой стадии развития. Локализация генов в зародышевых клетках доступна в GermSAGE, но специфическая для клеток экспрессия в гонадах не аннотирована.
Данные об экспрессии генов, основанные на экспериментах на микроматрицах, быстро распространились, и к ним можно получить доступ через различные веб-интерфейсы.К ним относятся Атлас экспрессии генов ArrayExpress, поддерживаемый Европейским институтом биоинформатики, Омнибус экспрессии генов (GEO), поддерживаемый Национальным центром биотехнологической информации (NIH), и база данных экспрессии генов в 4D, поддерживаемая Европейской лабораторией молекулярной биологии (таблица 1.3. ; Barrett et al ., 2009; Haudry et al ., 2008; Капушески et al ., 2010). Конкретные подмножества данных с микрочипов, которые могут представлять интерес, включают данные из ряда линий ES-клеток мыши, депонированных в GEO.Исследователи могут загружать наборы данных генов, экспрессируемых в линиях ES-клеток мыши, включая R1, J1, V6.5, гомозиготные мутантные ES-клетки, дифференцированные ES-клетки и т. Д. Открытый доступ к данным об экспрессии генов имеет жизненно важное значение для исследований и может привести к важным открытиям. Например, цифровой дифференциальный дисплей был использован для анализа библиотек экспрессируемых последовательностей тегов в GEO для идентификации генов, специфически экспрессируемых в ES-клетках мыши (Tokuzawa et al. , 2003, 2006). Это исследование привело к созданию мыши с нокаутом Fbx15 , которая сыграла важную роль в идентификации четырех факторов транскрипции ( Pou5f1 , Sox2 , c-myc и Klf4 ), необходимых для создания индуцированных плюрипотентные стволовые клетки из фибробластов мыши (Takahashi and Yamanaka, 2006).
9.5 Как регулируются гены — Концепции биологии — 1-е канадское издание
Цели обученияК концу этого раздела вы сможете:
- Обсудите, почему каждая клетка не экспрессирует все свои гены
- Опишите, как экспрессия прокариотических генов происходит на уровне транскрипции
- Понимать, что экспрессия эукариотических генов происходит на эпигенетическом, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном уровнях
Чтобы клетка функционировала должным образом, необходимые белки должны синтезироваться в нужное время.Все организмы и клетки контролируют или регулируют транскрипцию и трансляцию своей ДНК в белок. Процесс включения гена для производства РНК и белка называется экспрессией гена. Будь то простой одноклеточный организм или сложный многоклеточный организм, каждая клетка контролирует, когда и как экспрессируются ее гены. Чтобы это произошло, должен существовать механизм, позволяющий контролировать, когда ген экспрессируется для образования РНК и белка, сколько белка производится и когда пора прекратить производство этого белка, потому что он больше не нужен.
Клетки в многоклеточных организмах специализированы; клетки в разных тканях выглядят очень по-разному и выполняют разные функции. Например, мышечная клетка сильно отличается от клетки печени, которая сильно отличается от клетки кожи. Эти различия являются следствием экспрессии разных наборов генов в каждой из этих клеток. У всех клеток есть определенные основные функции, которые они должны выполнять сами, например, преобразование энергии молекул сахара в энергию АТФ. Каждая клетка также имеет много генов, которые не экспрессируются, и экспрессирует многие из них, которые не экспрессируются другими клетками, так что она может выполнять свои специализированные функции.Кроме того, клетки будут включать или выключать определенные гены в разное время в ответ на изменения в окружающей среде или в разное время в ходе развития организма. Одноклеточные организмы, как эукариотические, так и прокариотические, также включают и выключают гены в ответ на требования окружающей среды, чтобы они могли реагировать на особые условия.
Контроль экспрессии генов чрезвычайно сложен. Сбои в этом процессе губительны для клетки и могут привести к развитию многих заболеваний, в том числе рака.
Чтобы понять, как регулируется экспрессия генов, мы должны сначала понять, как ген становится функциональным белком в клетке. Этот процесс происходит как в прокариотических, так и в эукариотических клетках, но несколько по-разному.
Поскольку у прокариотических организмов отсутствует клеточное ядро, процессы транскрипции и трансляции происходят почти одновременно. Когда белок больше не нужен, транскрипция прекращается. В результате основным методом контроля того, какой тип и сколько белка экспрессируется в прокариотической клетке, является регуляция транскрипции ДНК в РНК.Все последующие шаги происходят автоматически. Когда требуется больше белка, происходит больше транскрипции. Следовательно, в прокариотических клетках контроль экспрессии генов почти полностью осуществляется на уровне транскрипции.
Первый пример такого контроля был обнаружен с использованием E . coli в 1950-х и 1960-х французскими исследователями и называется опероном lac . Оперон lac представляет собой участок ДНК с тремя соседними генами, которые кодируют белки, которые участвуют в абсорбции и метаболизме лактозы, источника пищи для E . coli . Когда лактоза отсутствует в среде бактерии, гены lac транскрибируются в небольших количествах. Когда присутствует лактоза, гены транскрибируются, и бактерия может использовать лактозу в качестве источника пищи. Оперон также содержит промоторную последовательность, с которой связывается РНК-полимераза, чтобы начать транскрипцию; между промотором и тремя генами находится область, называемая оператором. При отсутствии лактозы белок, известный как репрессор, связывается с оператором и предотвращает связывание РНК-полимеразы с промотором, за исключением редких случаев.Таким образом, белковых продуктов трех генов вырабатывается очень мало. Когда присутствует лактоза, конечный продукт метаболизма лактозы связывается с репрессорным белком и предотвращает его связывание с оператором. Это позволяет РНК-полимеразе связываться с промотором и свободно транскрибировать три гена, позволяя организму метаболизировать лактозу.
Эукариотические клетки, напротив, имеют внутриклеточные органеллы и намного сложнее. Напомним, что в эукариотических клетках ДНК содержится внутри ядра клетки и там транскрибируется в мРНК.Вновь синтезированная мРНК затем транспортируется из ядра в цитоплазму, где рибосомы переводят мРНК в белок. Процессы транскрипции и трансляции физически разделены ядерной мембраной; транскрипция происходит только внутри ядра, а трансляция происходит только вне ядра в цитоплазме. Регуляция экспрессии генов может происходить на всех этапах процесса (рис. 9.22). Регуляция может происходить, когда ДНК разматывается и отделяется от нуклеосом для связывания факторов транскрипции (эпигенетический уровень), когда РНК транскрибируется (уровень транскрипции), когда РНК обрабатывается и экспортируется в цитоплазму после ее транскрипции (посттранскрипционный уровень) , когда РНК транслируется в белок (уровень трансляции) или после того, как белок был произведен (посттрансляционный уровень).
Рисунок 9.22. Экспрессия эукариотических генов регулируется во время транскрипции и процессинга РНК, которые происходят в ядре, а также во время трансляции белка, которая происходит в цитоплазме. Дальнейшая регуляция может происходить посредством посттрансляционных модификаций белков.Различия в регуляции экспрессии генов между прокариотами и эукариотами суммированы в таблице ниже.
| Прокариотические организмы | Эукариотические организмы |
|---|---|
| Отсутствие ядра | Содержит ядро |
| Транскрипция РНК и трансляция белка происходят почти одновременно |
|
| Экспрессия гена регулируется в первую очередь на уровне транскрипции | Экспрессия гена регулируется на многих уровнях (эпигенетическом, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном) |
Альтернативный сплайсинг РНК
В 1970-х годах были впервые обнаружены гены, которые демонстрируют альтернативный сплайсинг РНК.Альтернативный сплайсинг РНК — это механизм, который позволяет производить различные белковые продукты из одного гена, когда из транскрипта удаляются разные комбинации интронов (а иногда и экзонов) (рис. 9.23). Этот альтернативный сплайсинг может быть случайным, но чаще он контролируется и действует как механизм генной регуляции, при этом частота различных альтернатив сплайсинга контролируется клеткой как способ контроля производства различных белковых продуктов в разных клетках или разные стадии развития.Альтернативный сплайсинг теперь считается обычным механизмом регуляции генов у эукариот; согласно одной оценке, 70% генов у человека экспрессируются как множественные белки посредством альтернативного сплайсинга.
Рисунок 9.23 Существует пять основных режимов альтернативного сращивания. Сегменты пре-мРНК с экзонами, показанными синим, красным, оранжевым и розовым цветом, могут быть сплайсированы для получения множества новых зрелых сегментов мРНК.Как могло развиваться альтернативное сращивание? Интроны имеют начальную и конечную последовательность распознавания, и легко представить себе неспособность механизма сплайсинга идентифицировать конец интрона и найти конец следующего интрона, таким образом удаляя два интрона и промежуточный экзон.Фактически, существуют механизмы, предотвращающие такой пропуск экзонов, но мутации, скорее всего, приведут к их отказу. Такие «ошибки» более чем вероятно приведут к нефункциональному белку. Действительно, причиной многих генетических заболеваний является альтернативный сплайсинг, а не мутации в последовательности. Однако альтернативный сплайсинг мог бы создать вариант белка без потери исходного белка, открывая возможности для адаптации нового варианта к новым функциям. Дублирование генов сыграло важную роль в развитии новых функций аналогичным образом — предоставив гены, которые могут развиваться, не устраняя исходный функциональный белок.
Хотя все соматические клетки в организме содержат одну и ту же ДНК, не все клетки в этом организме экспрессируют одни и те же белки. Прокариотические организмы экспрессируют всю ДНК, которую они кодируют в каждой клетке, но не обязательно все одновременно. Белки экспрессируются только тогда, когда они необходимы. Эукариотические организмы экспрессируют часть ДНК, которая кодируется в любой данной клетке. В каждом типе клеток тип и количество белка регулируются путем контроля экспрессии генов. Для экспрессии белка ДНК сначала транскрибируется в РНК, а затем транслируется в белки.В прокариотических клетках эти процессы происходят практически одновременно. В эукариотических клетках транскрипция происходит в ядре и отделена от трансляции, происходящей в цитоплазме. Экспрессия генов у прокариот регулируется только на уровне транскрипции, тогда как в эукариотических клетках экспрессия генов регулируется на эпигенетическом, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном уровнях.
Глоссарийальтернативный сплайсинг РНК: посттранскрипционный механизм регуляции гена у эукариот, в котором несколько белковых продуктов продуцируются одним геном посредством альтернативных комбинаций сплайсинга транскрипта РНК
эпигенетический: , описывающий негенетические регуляторные факторы, такие как изменения в модификациях гистоновых белков и ДНК, которые контролируют доступность генов в хромосомах
экспрессия гена: процессов, которые контролируют, экспрессируется ли ген
посттранскрипционный: контроль экспрессии гена после создания молекулы РНК, но до ее трансляции в белок
посттрансляционный: контроль экспрессии гена после создания белка
.