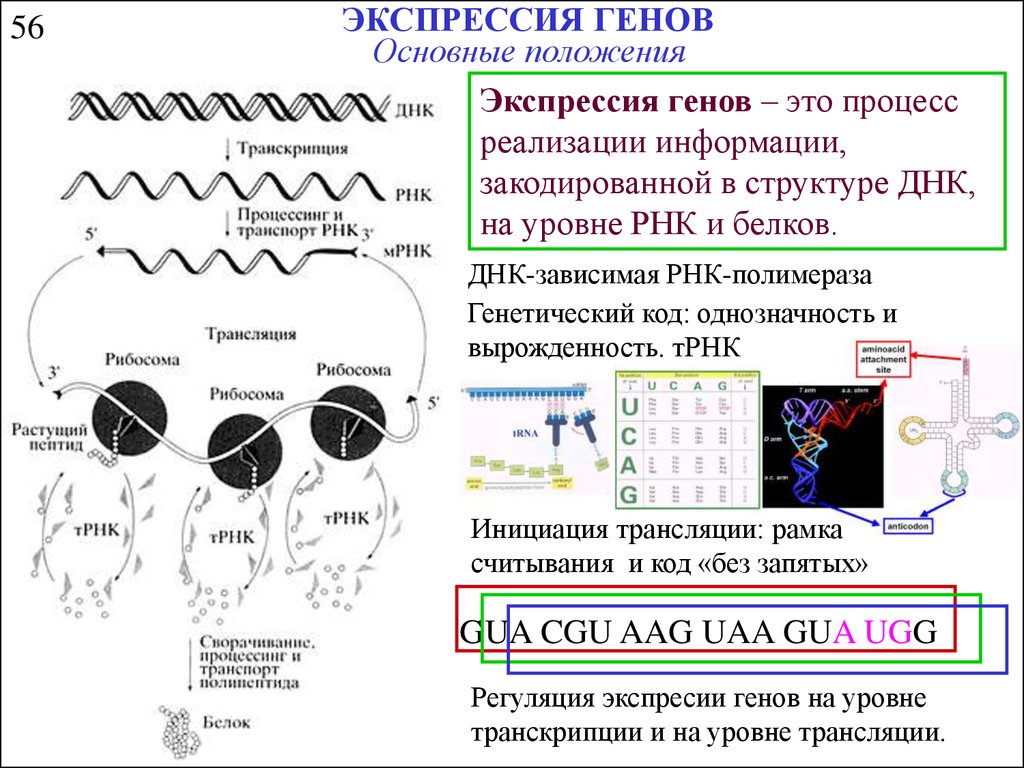
Особенности экспрессии молекул-маркеров инсулинорезистентности при экспериментальной болезни Альцгеймера
По мере старения населения число страдающих деменцией людей, по прогнозам ученых, к 2050 г. возрастет до 115 млн, что, несомненно, создаст значимую проблему для здравоохранения [1]. Клинически заболевание проявляется прогрессирующей потерей памяти и постепенным снижением когнитивных функций [2]. Болезнь Альцгеймера (БА) характеризуется значительной потере нейронов и синапсов, особенно в гиппокампе и коре больших полушарий, внеклеточным накоплением β-амилоида и формированием нейрофибриллярных сплетений [3]. Однако диагноз устанавливается, как правило, на стадии значительного повреждения головного мозга, что существенно снижает эффективность лечения [4]. Большое значение может иметь идентификация молекул-маркеров, позволяющая выявить заболевание на ранних стадиях у людей с высоким риском развития слабоумия.
Результаты недавних исследований свидетельствуют о ключевой роли инсулинорезистентности в развитии когнитивных нарушений и нейродегенерации, в частности при БА [5, 6].
Нарушение передачи сигналов инсулина в головном мозге инициирует сигнальные каскады реакций, включающих ингибирование фосфатидилинозитид-3 киназы (PI3K) и протеинкиназы В (Akt-киназы) и активацию 3β-киназы гликогенсинтазы (GSK-3β), которая индуцирует гиперфосфорилирование тау-белка, накопление Аβ-олигомеров и окислительный стресс, приводящий к митохондриальной дисфункции, апоптозу клеток, секреции провоспалительных цитокинов и нейродегенерации [7].
Кроме того, нарушение эффектов инсулина может вызвать или усилить процессы нейровоспаления, способствующие развитию нейродегенерации [8]. Нейровоспаление характеризуется активацией микроглии и астроцитов, резко возрастающей продукцией провоспалительных цитокинов (IL-1, IL-6, TNF), формированием внутриклеточных мультибелковых комплексов (инфламмасом), способствующих формированию синаптической и когнитивной дисфункции [9]. Инфламмасомы активируют каспазы 1 и 5, которые запускают секрецию провоспалительных цитокинов (IL-1, IL-18, IL-33), инициируя нейровоспаление c последующим возникновением когнитивных расстройств и слабоумия [10].
Имеются данные о существенном вкладе инфламмасом в развитие инсулинорезистентности, что предполагает существование связи между формированием инфламмасом в клетках головного мозга и локальной инсулинорезистентностью при нейровоспалении и нейродегенерации [11]. Согласно предложенной гипотезе, нарушение церебрального метаболизма глюкозы, связанное с инсулинорезистентностью, запускает каскад патологических реакций, а именно митохондриальную дисфункцию, окислительный стресс, эксайтотоксичность, апоптоз, активацию провоспалительных цитокинов, и, следовательно, способствует накоплению β-амилоида и гиперфосфорилированию тау-белка, тем самым вызывая когнитивную дисфункцию и нейродегенерацию [12].
Одним из потенциальных молекул-маркеров инсулинорезистентности является инсулинрегулируемая аминопептидаза (IRAP). Эта цинк-содержащая металлопептидаза обеспечивает протеолиз нейропептидов (в частности, окситоцина и вазопрессина) [13]. Ее ингибирование улучшает память у экспериментальных животных [14].
Таким образом, БА представляет собой, по-видимому, нейроэндокринное расстройство, связанное с мозгоспецифическим нарушением инсулин/IGF-сигнальных механизмов, т. е. «диабет 3-го типа». Однако молекулярный механизм нарушения передачи сигналов инсулина в нейронах остается в значительной степени неизвестным.
Цель настоящей работы — изучение экспрессии молекул-маркеров, а именно, IRAP, GLUT4 и IL-18 в различных областях головного мозга (гиппокамп, обонятельная луковица) у крыс с экспериментальной БА.
Материал и методы
Моделирование нейродегенерацииКрысам опытной группы (10 самцов в возрасте 7 мес) с помощью стереотаксической установки (Narishige, Япония) в СА1 зону гиппокампа с каждой стороны вводили по 5 мкл бета-амилоида 1−42 (Sigma-Aldrich, США). Использовали стереотаксические координаты ML±2,2 мм, АР — 3,0 мм, DV — 2,8 мм. Бета-амилоид 1−42 растворяли в фосфатно-солевом буфере (PBS, Sigma-Aldrich, США) до концентрации 2 мкг/мкл с последующей агрегацией в термостате при 37 °C в течение 7 дней [17]. Контрольную группу составили 10 крыс, которым в те же участки мозга вводили PBS. Животных содержали в клетках со свободным доступом к воде и корму при постоянной температуре 21±1 °С и регулярном световом цикле 12 ч день/12 ч ночь. Эксперименты проводились в соответствии с принципами гуманности, изложенными в Директиве Европейского сообщества (2010/63/EC).
Использовали стереотаксические координаты ML±2,2 мм, АР — 3,0 мм, DV — 2,8 мм. Бета-амилоид 1−42 растворяли в фосфатно-солевом буфере (PBS, Sigma-Aldrich, США) до концентрации 2 мкг/мкл с последующей агрегацией в термостате при 37 °C в течение 7 дней [17]. Контрольную группу составили 10 крыс, которым в те же участки мозга вводили PBS. Животных содержали в клетках со свободным доступом к воде и корму при постоянной температуре 21±1 °С и регулярном световом цикле 12 ч день/12 ч ночь. Эксперименты проводились в соответствии с принципами гуманности, изложенными в Директиве Европейского сообщества (2010/63/EC).
Оценку признаков БА начинали с 10-х суток после оперативного вмешательства [18].
Иммуногистохимическое исследованиеНа 14-й день после операции осуществляли транскардиальную перфузию 4% параформальдегидом с последующим забором головного мозга. Мозг фиксировали в 4% нейтральном забуференном формалине, после чего погружали в 20% раствор сахарозы и хранили при +4 °С. С помощью микротома Thermo Scientific Microm HM 650 готовили срезы толщиной 50 мкм. Экспрессию IRAP, GLUT4 и IL-18 изучали методом непрямой иммуногистохимии для свободно плавающих срезов [19]. После промывки в PBS срезы блокировали 3% бычьим сывороточным альбумином (BSA) в PBS и 1% Triton X-100 в течение 1 ч при комнатной температуре с последующим инкубированием в течение ночи с первичными антителами к IRAP (Santa Cruz Biotechnology, sc-365300, rabbit monoclonal) 1:1000, GLUT4 (Abcam, ab654, rabbit monoclonal) 1:10000, IL-18 (Santa Cruz, sc-7954, rabbit polyclonal), NeuN (Millipore, ABN78, rabbit polyclonal) 1:1000 с 3% BSA в PBS и 0,2% Triton X-100 при 4 °C. После инкубации с первичными антителами срезы промывали и инкубировали со вторичными антителами Alexa Conjugated antibody в разведении 1:1000 в течение 2 ч при комнатной температуре.
С помощью микротома Thermo Scientific Microm HM 650 готовили срезы толщиной 50 мкм. Экспрессию IRAP, GLUT4 и IL-18 изучали методом непрямой иммуногистохимии для свободно плавающих срезов [19]. После промывки в PBS срезы блокировали 3% бычьим сывороточным альбумином (BSA) в PBS и 1% Triton X-100 в течение 1 ч при комнатной температуре с последующим инкубированием в течение ночи с первичными антителами к IRAP (Santa Cruz Biotechnology, sc-365300, rabbit monoclonal) 1:1000, GLUT4 (Abcam, ab654, rabbit monoclonal) 1:10000, IL-18 (Santa Cruz, sc-7954, rabbit polyclonal), NeuN (Millipore, ABN78, rabbit polyclonal) 1:1000 с 3% BSA в PBS и 0,2% Triton X-100 при 4 °C. После инкубации с первичными антителами срезы промывали и инкубировали со вторичными антителами Alexa Conjugated antibody в разведении 1:1000 в течение 2 ч при комнатной температуре.
Изображения были получены с помощью конфокального микроскопа Olympus FV 10i. В срезах головного мозга подсчитывали количество клеток нейрональной природы, экспрессирующих маркеры инсулинорезистентности на различных уровнях в гиппокампе (DG) и ольфакторной луковице (OB).
Статистический анализ результатов проводили с использованием пакета анализа программы MS Excel 2010. В пределах каждой выборки определяли среднее арифметическое и ошибку среднего. Сравнение средних осуществляли с помощью Т-теста при уровне значимости р<0,05. Все результаты представлены в виде M±m, где М — среднее значение, m — ошибка среднего.
Результаты
Срезы головного мозга окрашивали по стандартному протоколу двойного непрямого метода иммуногистохимии для оценки экспрессии IRAP, GLUT4 и IL-18 в клетках нейрональной природы (маркер постмитотических нейронов — NeuN). Все измерения проводились в гранулярном слое клеток зубчатой извилины и ольфакторной луковице. При экспериментальной БА отмечалось значимое увеличение экспрессии IL-18 (
p=0,001) в гиппокампе по сравнению с контролем (рис. 1, табл. 1). В ольфакторной луковице наблюдалась тенденция к повышению экспрессии IL-18 у крыс с моделированной нейродегенерацией. Это может свидетельствовать об активации воспалительного процесса за счет сборки внутриклеточных инфламмасом [21].
1, табл. 1). В ольфакторной луковице наблюдалась тенденция к повышению экспрессии IL-18 у крыс с моделированной нейродегенерацией. Это может свидетельствовать об активации воспалительного процесса за счет сборки внутриклеточных инфламмасом [21].Таблица 1. Количество клеток (в %), экспрессирующих IL-18 у крыс опытной и контрольной групп
Рис. 1. Экспрессия IL-18 (красный) на нейронах (зеленый) в гиппокампе крыс при экспериментальной болезни Альцгеймера. Колокализация IL-18 с NeuN (желтый).
Несколько иная ситуация наблюдалась в отношении инсулинзависимого глюкозного транспортера GLUT4 (рис. 2, a, б). При Б.А. его экспрессия в гиппокампе (p=0,037) и в ольфакторной луковице (р<0,001) оказалась значимо ниже, чем в контроле (табл. 2). Возможно, это связано со снижением уровня инсулина в клетках головного мозга, наблюдаемое при БА [22], что сопровождается снижением экспрессии GLUT4 [12]. Наши данные подтверждают возникновение инсулинорезистентности при экспериментальной БА [23].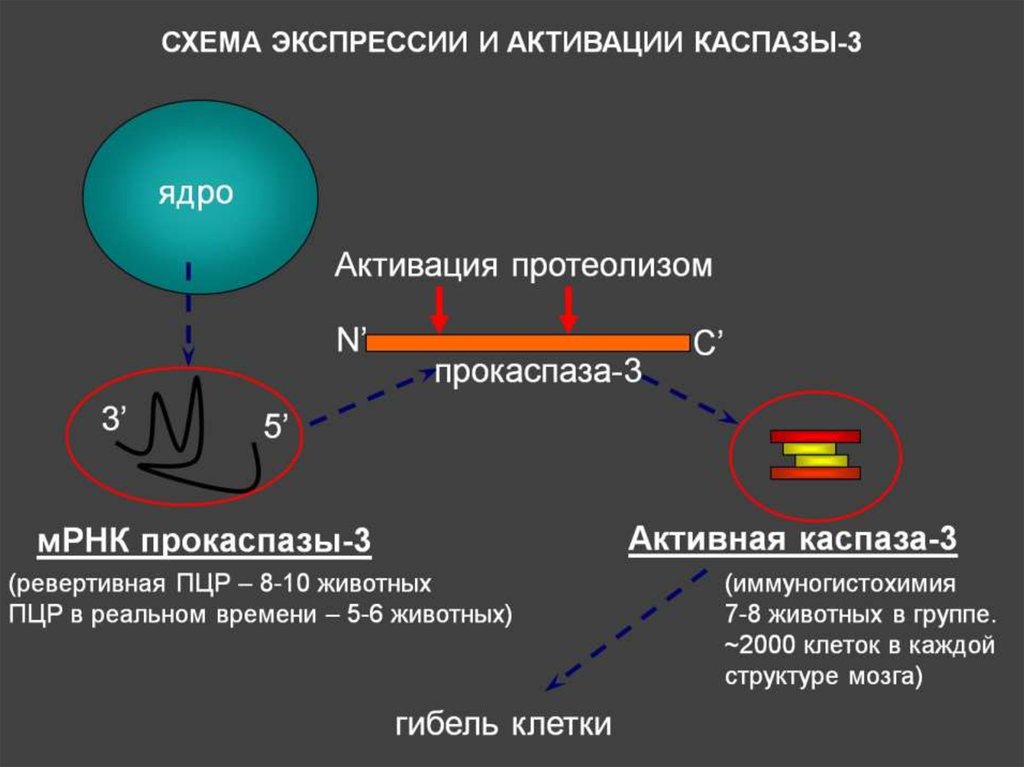
Таблица 2. Количество клеток (в %), экспрессирующих GLUT4 у крыс опытной и контрольной групп
Рис. 2. (а, б). Экспрессия GLUT4 (красный) на нейронах (зеленый) в гиппокампе крыс при экспериментальной болезни Альцгеймера. Колокализация GLUT4 с NeuN (желтый).
В зубчатой извилине гиппокампа крыс с моделью БА имела место тенденция к увеличению экспрессии IRAP (рис. 3, a, б) в клетках нейрональной природы по сравнению с контролем (p=0,203). Увеличение экспрессии IRAP у подопытных крыс было выявлено также в ольфакторной луковице (табл. 3). Это соответствует нарушению экспрессии GLUT4 при БА [24].
Таблица 3. Количество клеток (в %), экспрессирующих IRAP у крыс опытной и контрольной групп
Рис. 3. (а, б). Экспрессия IRAP (красный) на нейронах (зеленый) в гиппокампе крыс при экспериментальной болезни Альцгеймера. Колокализация IRAP с NeuN (желтый).
Таким образом, в гиппокампе и ольфакторной луковице животных с экспериментальной БА интенсивность экспрессии инсулинрегулируемой аминопептидазы IRAP и провоспалительного цитокина IL-18 возрастает, тогда как экспрессия инсулинзависимого глюкозного транспортера GLUT4 в данных областях головного мозга снижается.
Обсуждение
В мозге больных БА выявлены нейрофибриллярные изменения, потеря нейронов, синаптическая дисфункция как свидетельство эксайтотоксичности, а также выраженный воспалительный процесс. Воспаление играет важную роль в этиопатогенезе БА [25], хотя пока не ясно, является ли оно причиной или вторичным проявлением данного заболевания [26]. Кроме того, остается открытым вопрос о связи воспаления и инсулинорезистентности при нейродегенерации.
Установлено, что резистентность мозга к инсулину возрастает за счет накопления β-амилоида: у пациентов с БА обнаруживается высокая концентрация провоспалительных цитокинов в спинномозговой жидкости [27]. In vivo показано, что воспаление сопровождается образованием и накоплением β-амилоида [21]. β-Амилоид активирует микроглию и астроциты, которые в свою очередь запускают процесс высвобождения провоспалительных цитокинов, ингибирующих рецепторы инсулина за счет увеличения форфорилирования серина IRS-1 (insulin substrate-1) и протеинкиназы В (Akt-киназы), что способствует развитию нейродегенерации [28].
Наши данные [29] о повышении экспрессии провоспалительного цитокина IL-18 на клетках нейрональной природы в гиппокампе и ольфакторной луковице животных с экспериментальной БА могут свидетельствовать о запуске воспалительного процесса и согласуются с результатами исследования экспрессии IL-18 в мозге больных БА.
IL-18 увеличивает экспрессию GSK-3 и циклинзависимой киназы 5 (Cdk5), которые участвуют в гиперфосфорилировании тау-белка [30]. Кроме того, IL-18 может активировать JNK и МАРК р38 сигнальных путей, способствуя запуску апоптоза клеток [31].
Таким образом, IL-18 — один из ключевых медиаторов воспаления и иммунной реакции может играть важную роль в развитии патофизиологических процессов в мозге и способствовать прогрессированию БА.
Доставка глюкозы к клеткам головного мозга осуществляется с помощью глюкозных транспортеров (GLUT). Один из них, инсулинозависимый GLUT4, совместно с рецепторами инсулина в большом количестве экспрессируется в гиппокампе. Инсулин стимулирует экспрессию гена GLUT4 и его транспорт из цитоплазмы к плазматической мембране, тем самым модулируя поглощение и утилизацию глюкозы. Таким образом, инсулин/IGF — сигнальный путь играет ключевую роль в регуляции трансмембранного транспорта глюкозы [12]. Снижение экспрессии GLUT4 в гиппокампе и ольфакторной луковице при БА [32] может быть следствием снижения уровня инсулина в клетках головного мозга [22] и участвовать в нарушении церебрального метаболизма глюкозы.
Инсулин стимулирует экспрессию гена GLUT4 и его транспорт из цитоплазмы к плазматической мембране, тем самым модулируя поглощение и утилизацию глюкозы. Таким образом, инсулин/IGF — сигнальный путь играет ключевую роль в регуляции трансмембранного транспорта глюкозы [12]. Снижение экспрессии GLUT4 в гиппокампе и ольфакторной луковице при БА [32] может быть следствием снижения уровня инсулина в клетках головного мозга [22] и участвовать в нарушении церебрального метаболизма глюкозы.
Выявленная нами тенденция к увеличению экспрессии инсулинрегулируемой аминопептидазы IRAP в клетках нейрональной природы при экспериментальной БА может быть связана с нарушением стимулируемого инсулином транспорта GLUT4 к клеточной мембране, что необходимо для захвата глюкозы клетками мозга [33].
Клинически БА характеризуется прогрессивными нарушениями когнитивных функций и памяти. Показано, что пептиды ангиотензин IV и LVV-геморфин 7, играющие важную роль в процессе обучения и памяти, обладают высоким сродством к IRAP и являются его конкурентными ингибиторами [34]. Высокие концентрации IRAP присутствуют в областях мозга, ответственных за память, а именно в гиппокампе, миндалине и коре [35]. Кроме того, IRAP колоколизован с GLUT4 и регулирует его внутриклеточный транспорт [36].
Высокие концентрации IRAP присутствуют в областях мозга, ответственных за память, а именно в гиппокампе, миндалине и коре [35]. Кроме того, IRAP колоколизован с GLUT4 и регулирует его внутриклеточный транспорт [36].
Известно, что транслокация GLUT4 в мембрану клетки обеспечивается активностью IRAP [37]; отсутствие экспрессии IRAP сопровождается снижением экспрессии и GLUT4 [38]. Поэтому обнаруженное нами несоответствие между экспрессией этих молекул может объясняться отсутствием влияния других инсулинопосредованных [39] или цитоскелет-зависимых [40] механизмов регуляции транспорта GLUT4 в очаге нейровоспаления. В последние годы IRAP считают одним из маркеров инсулинорезистентности при БА. В исследованиях in vivo установлено, что ингибиторы IRAP улучшают память у грызунов [15]. Увеличение экспрессии IRAP и IL-18 в клетках нейрональной природы при нейротоксическом действии β-амилоида соответствует нарушению внутриклеточного транспорта GLUT4 и определяет снижение чувствительности к действию инсулина, что может иметь своим результатом развитие когнитивного дефицита.
Заключение
Уменьшение экспрессии GLUT4 на фоне увеличения экспрессии IRAP и IL-18 в нейронах головного мозга при экспериментальной болезни Альцгеймера свидетельствует о сопряженности механизмов нейровоспаления и инсулинорезистентности, что открывает возможность новых подходов к направленной фармакологической коррекции нейродегенерации.
Информация о финансировании и конфликте интересовУчастие авторов:
Концепция и дизайн исследования —Комлева Ю.К..
Сбор и обработка материала — Горина Я.В., Комлева Ю.К., Лопатина О.Л., Волкова В.В.
Статистическая обработка данных — Герцог Г.Е., Попова Н.Н.
Написание текста — Горина Я.В..
Редактирование — Салмина А.Б..
Работа выполнена при поддержке гранта Президента Р.Ф. для ведущих научных школ РФ (НШ-1172.2014.7).
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов.
Ki-67 (MIB-1) экспрессия, иммуногистохимическое исследование (оценка пролиферативной активности по экспрессии Ki-67 (MIB-1); Ki-67 (MIB-1) by Immunohistochemistry, IHC)
Метод определения Гистологическое исследование биоптатов опухоли согласно гистологической классификации ВОЗ с окрашиванием гематоксилином-эозином. Иммуногистохимическое исследование индекса пролиферативной активности с применением моноклональных антител к Ki-67 (MIB-1) (пероксидазный и авидин-биотиновый методы).
Доступен выезд на дом
Онлайн-регистрация
Комплексное исследование биоптатов, включающее морфологическое описание и оценку пролиферативной активности клеток, которое используют в целях диагностики − определения биологического потенциала новообразований человека.
В современной онкоморфологии ведется поиск критериев, позволяющих верифицировать степень гистологической и биологической злокачественности с максимальной объективностью. Учитывая, что пролиферативная активность клеток опухолей человека коррелирует со степенью их гистологической и биологической злокачественности, в последние годы ИГХ-определение индекса пролиферации при исследовании экспрессии Ki-67 (MIB-1) является необходимым рутинным исследованием при онкологических заболеваниях.
Учитывая, что пролиферативная активность клеток опухолей человека коррелирует со степенью их гистологической и биологической злокачественности, в последние годы ИГХ-определение индекса пролиферации при исследовании экспрессии Ki-67 (MIB-1) является необходимым рутинным исследованием при онкологических заболеваниях.
Специфичным и оптимальным для широкого использования в патологоанатомической практике маркером пролиферации является антиген Ki-67. Ядерный антиген Кi-67 впервые описан Gerdes и соавторами в 1983 году, он состоит из двух полипептидных цепей с молекулярной массой 345 и 395 кДа. Это основная часть нуклеарного матрикса, в течение интерфазы ассоциированная с хромосомами фазы митоза. Ki-67−димерная молекула, имеющая тесную связь с 10-й хромосомой, конкретная роль этого протеина в процессе клеточного деления до сих пор точно не выяснена. Экспрессия Кi-67 позволяет выделить опухолевые клетки, находящиеся в активной фазе клеточного цикла, на всём его протяжении (G1-, S-, G2- и M-фазы). Кi-67 отсутствует только в G0-периоде. Активно пролиферирующие опухолевые клетки представляют собой «фракцию роста» новообразования. Пролиферативная активность является ведущим фактором как в механизме злокачественной трансформации клеток, так и в биологическом поведении уже возникших опухолей. Это одна из наиболее важных характеристик фенотипа опухоли, в значительной степени определяющая скорость роста новообразования, риск метастазирования, потенциальный ответ на лечебные мероприятия и исход онкологического заболевания. Многие факторы, влияющие на течение и исход онкологических заболеваний, свое патогенетическое действие на опухоль опосредуют через изменение пролиферативной активности.
Кi-67 отсутствует только в G0-периоде. Активно пролиферирующие опухолевые клетки представляют собой «фракцию роста» новообразования. Пролиферативная активность является ведущим фактором как в механизме злокачественной трансформации клеток, так и в биологическом поведении уже возникших опухолей. Это одна из наиболее важных характеристик фенотипа опухоли, в значительной степени определяющая скорость роста новообразования, риск метастазирования, потенциальный ответ на лечебные мероприятия и исход онкологического заболевания. Многие факторы, влияющие на течение и исход онкологических заболеваний, свое патогенетическое действие на опухоль опосредуют через изменение пролиферативной активности.
Оценивать пролиферативную активность опухолевых клеток необходимо не только для определения биологических характеристик опухолей, но и для селективного подхода к выбору терапии.
Индекс пролиферативной активности в различных опухолях имеет разные значения, являясь при этом независимым прогностическим признаком, определяющим клиническое течение и прогноз заболевания. При Ki-67 менее 15% опухоль считается менее агрессивной, при показателе более 30% опухоль считается высоко агрессивной. При высоком уровне (выраженном в %) Ki-67 опухоль с более высокой вероятностью ответит на химиотерапевтическое лечение. При низком его уровне опухоль, например, молочной железы, при определённых условиях лучше отреагирует на гормонотерапию.
При Ki-67 менее 15% опухоль считается менее агрессивной, при показателе более 30% опухоль считается высоко агрессивной. При высоком уровне (выраженном в %) Ki-67 опухоль с более высокой вероятностью ответит на химиотерапевтическое лечение. При низком его уровне опухоль, например, молочной железы, при определённых условиях лучше отреагирует на гормонотерапию.
определение выражения в Медицинском словаре.
выражение
[eks-presh´un]1. внешний вид лица, определяемый физическим или эмоциональным состоянием.
2. акт выдавливания или вакуумирования под давлением.
3. Экспрессия гена .
экспрессия генов
1. поток генетической информации от гена к белку.
2. процесс или регуляция процесса, посредством которого проявляются эффекты гена.
3. проявление наследуемого признака у особи, несущей ген или гены, его определяющие.
Энциклопедия и словарь Миллера-Кина по медицине, сестринскому делу и смежным вопросам здравоохранения, седьмое издание. © 2003, Saunders, издательство Elsevier, Inc. Все права защищены.
© 2003, Saunders, издательство Elsevier, Inc. Все права защищены.
выдавл.
(экс-прешн),1. Выдавливание; выдавливание давлением.
2. Подвижность черт, придающих лицу особое эмоциональное значение. Синоним(ы): facies (4) [TA]
3. Любое действие человека.
4. Что-то, что проявляет что-то другое.
5. Действие, позволяющее информации проявиться.
6. Математическая функция, состоящая из комбинации констант, переменных, других функций и математических операций.
Медицинский словарь Farlex Partner © Farlex 2012
выражение
(ĭk-sprĕsh′ən)n.
1. Действие выдавливания или выдавливания.
2. Генетика Акт или процесс экспрессии гена.
Медицинский словарь American Heritage® Copyright © 2007, 2004, компания Houghton Mifflin. Опубликовано компанией Houghton Mifflin. Все права защищены.
выражение
(экс-прешн)1. Выдавливание; выдавливание давлением.
2. Подвижность черт, придающих лицу особое эмоциональное значение.
Синоним(ы): facies (3) [TA] .
3. Что-то, что проявляет что-то другое.
[Л. стр. экспрессус , фр. exprimere , выдавить]
Медицинский словарь медицинских профессий и сестринского дела © Farlex 2012
выражение
см. ГЕННАЯ ЭКСПРЕССИЯ.Биологический словарь Коллинза, 3-е изд. © W. G. Hale, V. A. Saunders, J. P. Margham 2005
выражение
(экс-прешн)1. Выдавливание; выдавливание давлением.
2. Подвижность черт, придающих лицу особое эмоциональное значение.
Синоним(ы): facies (4) [TA] .
Медицинский словарь для стоматологов © Farlex 2012
Дискуссия пациента о выражении
В. Откуда произошло выражение «возвращение в повозку»?
A. http://www.phrases. org.uk/meanings/on-the-wagon.html
org.uk/meanings/on-the-wagon.html
В. Какую роль играют эмоции в жизни человека с аутизмом? Мне трудно понять все расстройство аутизма, потому что я очень эмоциональный человек. Меня особенно интересует, как люди с легким аутизмом или синдромом Аспергера могут нормально функционировать, но когда дело доходит до чувства эмпатии, у них возникают такие проблемы. Думаю, мой вопрос в том, как такие люди испытывают эмоции — действительно ли эти люди не способны заботиться о других? Мое намерение не в том, чтобы показаться невежественным, мне действительно любопытно.
A. У меня синдром Аспергера, и почти все для меня логически анализируется, и мне трудно понять, какие эмоции сопровождают определенные ситуации и как эти эмоции проявляются во мне.
Я забочусь о других, я просто не могу всегда ставить себя на их место и чувствовать то, что они чувствуют.
Этот контент предоставлен iMedix и регулируется Условиями iMedix. Вопросы и ответы не одобрены и не рекомендованы и предоставляются пациентами, а не врачами.
Вопросы и ответы не одобрены и не рекомендованы и предоставляются пациентами, а не врачами.
Определение выражений в Медицинском словаре
(перенаправлено с Выражения )
Также найдено в: Словарь, Тезаурус, Юридический, Идиомы, Энциклопедия.
выражение
[eks-presh´un]1. внешний вид лица, определяемый физическим или эмоциональным состоянием.
2. акт выдавливания или вакуумирования под давлением.
3. Экспрессия гена .
экспрессия генов
1. поток генетической информации от гена к белку.
2. процесс или регуляция процесса, посредством которого проявляются эффекты гена.
3. проявление наследуемого признака у особи, несущей ген или гены, его определяющие.
Энциклопедия и словарь Миллера-Кина по медицине, сестринскому делу и смежным вопросам здравоохранения, седьмое издание. © 2003, Saunders, издательство Elsevier, Inc. Все права защищены.
© 2003, Saunders, издательство Elsevier, Inc. Все права защищены.
выдавл.
(экс-прешн),1. Выдавливание; выдавливание давлением.
2. Подвижность черт, придающих лицу особое эмоциональное значение. Синоним(ы): facies (4) [TA]
3. Любое действие человека.
4. Что-то, что проявляет что-то другое.
5. Действие, позволяющее информации проявиться.
6. Математическая функция, состоящая из комбинации констант, переменных, других функций и математических операций.
Медицинский словарь Farlex Partner © Farlex 2012
выражение
(ĭk-sprĕsh′ən)n.
1. Действие выдавливания или выдавливания.
2. Генетика Акт или процесс экспрессии гена.
Медицинский словарь American Heritage® Copyright © 2007, 2004, компания Houghton Mifflin. Опубликовано компанией Houghton Mifflin. Все права защищены.
выражение
(экс-прешн)1. Выдавливание; выдавливание давлением.
2. Подвижность черт, придающих лицу особое эмоциональное значение.
Синоним(ы): facies (3) [TA] .
3. Что-то, что проявляет что-то другое.
[Л. стр. экспрессус , фр. exprimere , выдавить]
Медицинский словарь медицинских профессий и сестринского дела © Farlex 2012
выражение
см. ГЕННАЯ ЭКСПРЕССИЯ.Биологический словарь Коллинза, 3-е изд. © W. G. Hale, V. A. Saunders, J. P. Margham 2005
выражение
(экс-прешн)1. Выдавливание; выдавливание давлением.
2. Подвижность черт, придающих лицу особое эмоциональное значение.
Синоним(ы): facies (4) [TA] .
Медицинский словарь для стоматологов © Farlex 2012
Дискуссия пациента о выражении
В. Откуда произошло выражение «возвращение в повозку»?
A. http://www.phrases. org.uk/meanings/on-the-wagon.html
org.uk/meanings/on-the-wagon.html
В. Какую роль играют эмоции в жизни человека с аутизмом? Мне трудно понять все расстройство аутизма, потому что я очень эмоциональный человек. Меня особенно интересует, как люди с легким аутизмом или синдромом Аспергера могут нормально функционировать, но когда дело доходит до чувства эмпатии, у них возникают такие проблемы. Думаю, мой вопрос в том, как такие люди испытывают эмоции — действительно ли эти люди не способны заботиться о других? Мое намерение не в том, чтобы показаться невежественным, мне действительно любопытно.
A. У меня синдром Аспергера, и почти все для меня логически анализируется, и мне трудно понять, какие эмоции сопровождают определенные ситуации и как эти эмоции проявляются во мне.
Я забочусь о других, я просто не могу всегда ставить себя на их место и чувствовать то, что они чувствуют.
Этот контент предоставлен iMedix и регулируется Условиями iMedix.