Краткий словарь генетических терминов
24 августа 2016 г
Для понимания того, с чем работает наша компания и зачем эта работа нужна, какие результаты мы получаем и что они вам расскажут, можно прийти на консультацию к специалистам ЦГРМ «ГЕНЕТИКО». А для того, чтобы Вы не забыли, о чем был разговор, и не утонули в море новой информации, мы составили для Вас небольшой словарик основных понятий и терминов, использующихся в генетике.
Основным положением биологической науки является то, что клетка – это самое маленькое из возможных проявление жизни и что новая клетка может появиться только от уже существующей и никак не может возникнуть сама по себе. Конечно, это приводит к большому количеству вопросов о том, как зародилась жизнь и каким образом могла сформироваться самая первая клетка. Но для удобства будем считать обозначенные положения верными в современной реальности планеты Земля, где мы живем. Несмотря на невообразимо огромное разнообразие живых существ, все они состоят из клеток. И у всех клеток есть схожие черты, которые обусловлены самыми простыми жизненными необходимостями. Во-первых, клетка должна как-то отделяться от внешнего пространства – для этого есть специальная оболочка.
И у всех клеток есть схожие черты, которые обусловлены самыми простыми жизненными необходимостями. Во-первых, клетка должна как-то отделяться от внешнего пространства – для этого есть специальная оболочка.
Во-вторых, клетка должна питаться – для этого есть разные системы, способные преобразовать энергию света или химических связей в необходимые для жизни вещества и удобную для использования энергию. И еще клетка умеет размножаться. Для выполнения всех этих функций необходимы механизмы, основу которых составляют белки и РНК. А вот инструкция, как эти молекулы должны выглядеть и работать, хранится в специальном отсеке клетки – ядре – в виде ДНК. Ошибки в этой инструкции, которая разрабатывалась миллионы лет, приводят к смерти клетки. А в многоклеточном организме, таком, как у человека, например, клетки взаимодействуют друг с другом, поэтому нарушение в работе одной или нескольких клеток может привести не к смерти всего организма, а к нарушениям его работы – заболеваниям. Также необходимо помнить, что человеческий организм огромная система, ансамбль миллионов разнообразных маленьких организмов, которые выросли из одной единственной клетки – зиготы – результата слияния яйцеклетки и сперматозоида.
ДНК – ДезоксиРибонуклиновая Кислота – полимер, то есть молекула с большим количеством последовательно повторяющихся структурных элементов, который несет всю информацию о генах и белках, необходимых для жизни всего организма. ДНК является картотекой, библиотекой и матрицей, с которой считывается информация в определенной последовательности и определенных условиях, разъяснения о которых записаны как в самой ДНК, так и с помощью различных дополнительных модификаций этой молекулы. Каждой хромосоме соответствует 1 молекула ДНК. Структурными блоками этого полимера являются дезоксирибонуклеотиды (=нуклеотиды), которые бывают 4х видов (А, Т, Г, Ц).
Последовательность ДНК – это то, в каком порядке в молекуле ДНК идут ее структурные элементы – нуклеотиды. Таким образом, генетической информацией является именно последовательность ДНК, а молекула ДНК является ее физическим носителем.
Хромосома – это молекула ДНК, специальным образом обернутая различными белками, которые помогают управляться с такой длинной молекулой, чтобы она не порвалась, не перепуталась с другими ДНК-молекулами и была физически доступна для белков, осуществляющих работу всего генетического аппарата.
РНК –РибоНуклиновая Кислота – полимер, который выполняет функциональную роль переносчика информации, то есть копии, которая делается с ДНК и используется для создания функциональных молекул: специальных РНК или белков. Специальные молекулы РНК могут не являться матрицами, на базе которых синтезируется белок, а сами выполняют структурные, ферментативные или транспортные функции. Главное, что последовательность структурных блоков в молекуле РНК всегда определена последовательностью ДНК соответствующего участка.
Белок – основная функциональная единица живой клетки с самым широчайшим спектром функций и возможностей. Как ДНК и РНК, является полимером, однако имеет химически иные структурные блоки – аминокислоты. Их последовательность, с одной стороны, напрямую зависит от соответствующей последовательности ДНК и может изменяться только в ограниченных и предусмотренных в ДНК инструкций, с другой стороны является основой структуры, в том числе пространственной, возможностей и функции белков разных типов.
Ген – определение гена включает два аспекта: теоретический и физический. Теоретически, то есть умозрительно, геном называют последовательность ДНК (слово, записанное на языке генетики), обладающее определенными свойствами. Как и слово в языке, ген является основой наследственной информации, в то время как различные другие структуры можно отнести к знакам препинания или вспомогательным элементам. Ген является подробной инструкцией для синтеза белка или специфической РНК, которую он кодирует. Причем эта инструкция описывает не только последовательность молекул, но и то в каких условиях и как они должны работать и выполнять свои функции. С физической, то есть материальной, точки зрения, ген – это часть молекулы ДНК с определенными структурными элементами. Как внутри слова есть приставка, корень, суффикс и окончание, позволяющие слову адаптироваться для каждой конкретной фразы, так и у гена есть промотор, экзоны и интроны. Первый обозначает начало гена, экзоны – это ключевая информация о последовательности РНК или белка, а интроны необходимы для регуляции и тонкой настройки работы гена в условиях разных тканей, органов и изменяющейся окружающей среды.
Экспрессия гена – это эффективность работы гена, так как для его функционирования недостаточно его наличия в геноме – с него должна считываться информация. Именно то, как часто и в каком объеме считывается информация с гена, выражают термином экспрессия.
Локус – участок молекулы ДНК, содержащий различный структурные элементы, в том числе один или несколько генов.
Геном– это последовательность всех молекул ДНК организма. Важно помнить, что в каждой клетке одного организма в норме содержатся одинаковые по количеству и последовательностям молекулы ДНК, а различается экспрессия конкретных генов.
Экзом – это последовательности ДНК экзомных участков генов, то есть так называемая основная кодирующая составляющая. Это то, с чем работает организм, в то время как остальная часть генома объясняет, как работать и в каких условиях как применять и настраивать кодирующую часть генома.
Мутация – изменение последовательности ДНК по сравнению другими клетками организма или другими представителями вида.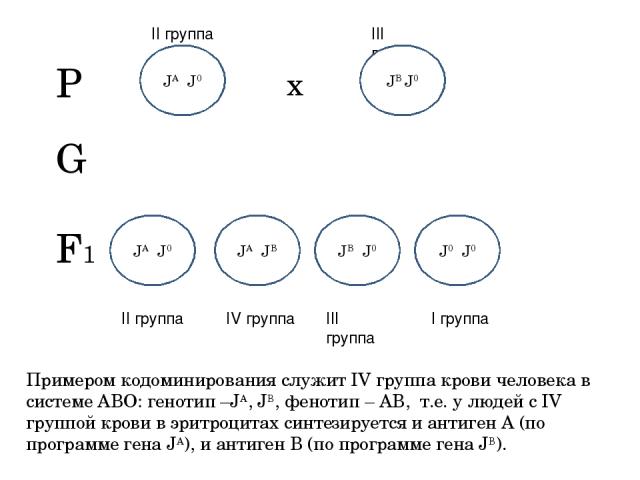 Мутации могут возникать как из-за воздействия внешних неблагоприятных условий, так и из-за того, что наши ферменты работают пусть с редкими, но ошибками. Так как происходит физическое изменение в носителе информации – ДНК, такое изменение может передаваться из поколения в поколение.
Мутации могут возникать как из-за воздействия внешних неблагоприятных условий, так и из-за того, что наши ферменты работают пусть с редкими, но ошибками. Так как происходит физическое изменение в носителе информации – ДНК, такое изменение может передаваться из поколения в поколение.
Частота мутаций — относительное значение, показывающее у какой доли людей в геноме есть конкретная мутация. Частоту мутации можно рассчитать, как среднюю для всех людей, так и отдельно по расовым или национальным, или любы другим группам. В медицинской генетике под мутацией подразумевают изменение ДНК, которое может быть связано с каким-то заболеванием, и противопоставляют ее полиморфизму. Хотя по общей логике полиморфизм – это частный случай мутации.
Полиморфизм – нейтральная, а точнее безвредная, мутация, которая сравнительно часто встречается у какой-то группы организмов одного вида. Некоторые мутации встречаются часто у всех людей, некоторые – только среди представителей определенных рас или народностей.
Аллель – вариант последовательности гена в разном виде: от различия в одной букве последовательности до отсутствия целого куска последовательности или вставке лишнего. Эти различия возникают из-за мутации, которая могла произойти у далекого предка и передаться потомству через поколения. Таким образом, каждый ген у отдельного человека может быть представлен конкретным вариантом – аллелем. Для понимания аллелизма необходимо объяснить, что, например, различия в цвете глаз, волос, росте, чувствительности к алкоголю объясняются именно разными аллельными состояниями соответствующих генов.
Генотип – это все гены конкретной особи с указанием аллельного состояния каждого гена и наличия/отсутствия мутаций в межгенных участках ДНК.
Доминантный аллель. В геноме человека содержится по 2 копии каждой хромосомы. Это означает, что в каждом геноме есть две очень похожие по длине и последовательности генов молекулы ДНК, которые отличаются аллельными состояниями генов и мутациями/полиморфизмами в межгенных участках этих молекул ДНК. Из этого следует, что и каждый ген представлен в геноме 2 копиями, каждая из которых может быть определенным вариантом (аллелем) этого гена. Доминантным аллелем называется тот, одной копии которого достаточно для проявления его особенностей. То есть если хотя бы на одной из хромосом ген находится в состоянии доминантного аллеля, то ген будет работать по тому варианту, который описывается именно этим аллелем. Важно, что так как у одного гена может быть более двух вариантов (аллелей), то и доминантность аллеля определяется по отношению к каждому из вариантов, хотя есть и те, которые доминантны по сравнению со всеми другими. Встречаются варианты с одинаковой предпочтительностью для работы, тогда проявляется совместное влияние этих вариантов.
Из этого следует, что и каждый ген представлен в геноме 2 копиями, каждая из которых может быть определенным вариантом (аллелем) этого гена. Доминантным аллелем называется тот, одной копии которого достаточно для проявления его особенностей. То есть если хотя бы на одной из хромосом ген находится в состоянии доминантного аллеля, то ген будет работать по тому варианту, который описывается именно этим аллелем. Важно, что так как у одного гена может быть более двух вариантов (аллелей), то и доминантность аллеля определяется по отношению к каждому из вариантов, хотя есть и те, которые доминантны по сравнению со всеми другими. Встречаются варианты с одинаковой предпочтительностью для работы, тогда проявляется совместное влияние этих вариантов.
Рецессивный аллель – по аналогии с доминантным аллелем, это такое состояние гена, которое наименее предпочтительно для проявления. Поэтому если в геноме есть другая копия гена, доминантная, то задавать темп работы гена будет именно она, но если и вторая копия гена представлена рецессивным аллелем, то будет работать этот, хотя менее предпочтительный, но в такой ситуации единственно имеющийся вариант.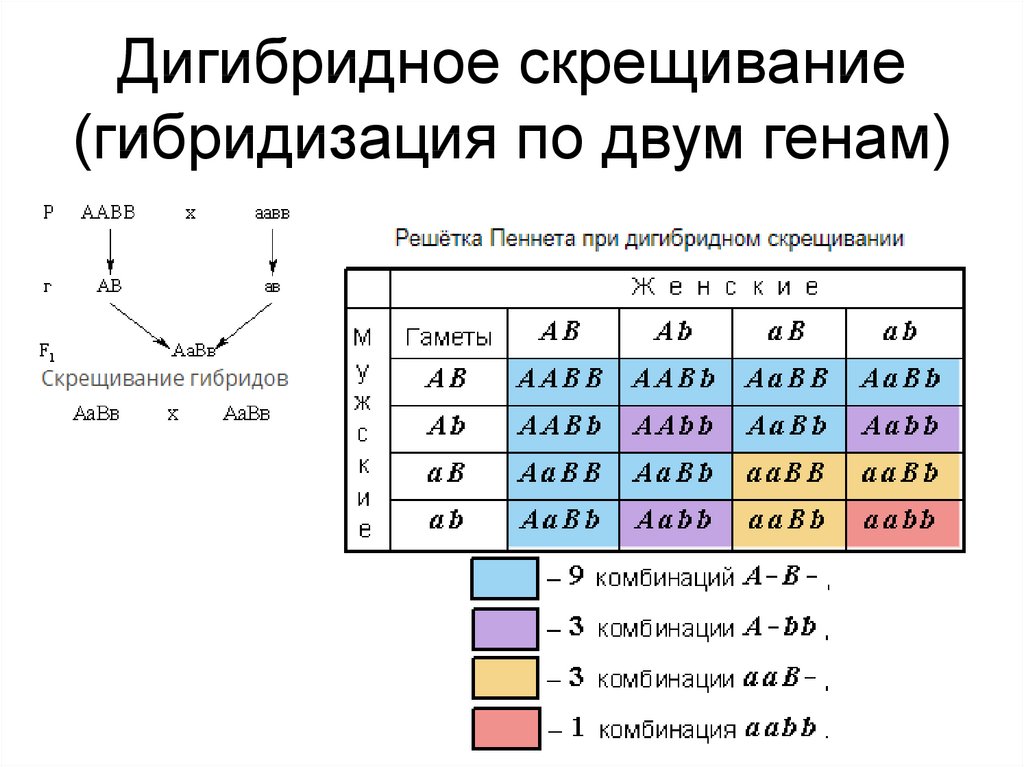 Хотя в большинстве случаев связанные с возникновением заболевания аллели рецессивны, это вредность/полезность не является единственным определяющим фактором рецессивности/доминантности аллеля.
Хотя в большинстве случаев связанные с возникновением заболевания аллели рецессивны, это вредность/полезность не является единственным определяющим фактором рецессивности/доминантности аллеля.
Гомозигота. Гомозиготой по определенной мутации/полиморфизму/аллелю называют такую клетку или организм, в генотипе которой/которого обе копии гена на двух хромосомах представлены одним вариантом, то есть не отличаются по этой мутации/полиморфизму/аллелю.
Гетерозигота. Гетерозиготой по определенной мутации/полиморфизму/аллелю называют такую клетку или организм, в генотипе которой/которого две копии гена на двух хромосомах представлены разными вариантами, то есть отличаются по этой мутации/полиморфизму/аллелю.
Секвенирование – это группа методов, позволяющая узнать последовательность нуклеотидов в молекуле ДНК. Этот метод обладает некоторыми особенностями. Во-первых, пока что ни один способ секвенирования не позволяет прочитать всю последовательность одной хромосомы, чтение идет сравнительно небольшими отрезка от 50 до несколько тысяч нуклеотидов. Во-вторых, почти все методы устроены так, что из кусочка ДНК делается много одинаковых и читаются они все. Эта особенность проявляется в таком параметре секвенирования, как глубина секвенирования, обозначаемая 10Х, 20Х, 50Х. Чем больше это значение, тем больше раз прочитан один и тот же кусок молекулы, тем точнее можно выявить ошибки секвенирования и особенности участка, например, его гетерозиготность по какой-либо мутации/полиморфизму.
Во-вторых, почти все методы устроены так, что из кусочка ДНК делается много одинаковых и читаются они все. Эта особенность проявляется в таком параметре секвенирования, как глубина секвенирования, обозначаемая 10Х, 20Х, 50Х. Чем больше это значение, тем больше раз прочитан один и тот же кусок молекулы, тем точнее можно выявить ошибки секвенирования и особенности участка, например, его гетерозиготность по какой-либо мутации/полиморфизму.
Гаплотип — совокупность состояний/вариантов определенных локусов, которые расположены на одной хромосоме, и вследствие структурных особенностей эти состояния всегда наследуются вместе. То есть, например, если в одном локусе (1) гаплотипа имеется мутация (1А), а в другом (2) имеется уже другая мутация (2M), то именно в таком составе они будут наследоваться (1А2М), а смешанных вариантов (1B2M или 1A2N) не бывает или они относятся к другому гаплотипу.
Гаплогруппа — совокупность особей, имеющих сходный гаплотип по определенным локусам, которые задаются в соответствии с тем, какую задачу нужно решить, определяя гаплогруппу
Митохондриальная ДНК. Если разбираться подробнее и глубже, то генетическая информация одного человека находится не только в 46 хромосомах, располагающихся в специальном отсеке клетки – ядре, но и в клеточных органах митохондриях. У митохондрий в клетке своя задача – преобразовывать энергию, заключенную в химической связи определенных атомов, в более удобную для клетки, то есть они готовят эффективные питательные запасы из разного сырья. Митохондрии довольно сложны, их оболочка хитро устроена, чтобы опасные побочные продукты готовки не могли попасть в остальную часть клетки, поэтому все время таскать туда нужные для их работы белки не слишком продуктивно. Таким образом, у них есть своя ДНК, которая несет информацию о разных особенных белках и РНК, которые нужны именно для работы митохондрии. Такую ДНК называют митохондриальной и она является неотъемлемой и обязательной частью нашего генотипа. Передается она только от мамы, так как сперматозоид для возможности быстро перемещаться и долго оставаться живым несет самый минимум необходимой генетической информации – 23 хромосомы.
Если разбираться подробнее и глубже, то генетическая информация одного человека находится не только в 46 хромосомах, располагающихся в специальном отсеке клетки – ядре, но и в клеточных органах митохондриях. У митохондрий в клетке своя задача – преобразовывать энергию, заключенную в химической связи определенных атомов, в более удобную для клетки, то есть они готовят эффективные питательные запасы из разного сырья. Митохондрии довольно сложны, их оболочка хитро устроена, чтобы опасные побочные продукты готовки не могли попасть в остальную часть клетки, поэтому все время таскать туда нужные для их работы белки не слишком продуктивно. Таким образом, у них есть своя ДНК, которая несет информацию о разных особенных белках и РНК, которые нужны именно для работы митохондрии. Такую ДНК называют митохондриальной и она является неотъемлемой и обязательной частью нашего генотипа. Передается она только от мамы, так как сперматозоид для возможности быстро перемещаться и долго оставаться живым несет самый минимум необходимой генетической информации – 23 хромосомы. А вот яйцеклетка, которой для выполнения основной функции не нужно находится в агрессивной окружающей среде, может позволить себе бОльшую массу и дополнительные запасы в виде готовых к работе станций приготовления питания – митохондрий и заранее синтезированных белков и РНК.
А вот яйцеклетка, которой для выполнения основной функции не нужно находится в агрессивной окружающей среде, может позволить себе бОльшую массу и дополнительные запасы в виде готовых к работе станций приготовления питания – митохондрий и заранее синтезированных белков и РНК.
Гены половой дифференцировки – группа генов, играющая ведущую роль в определении будет эмбрион развиваться как девочка или как мальчик. В геноме человека основой проявления мужских или женских половых признаков является наличие/отсутствие половой хромосомы Y, а именно особо локуса этой хромосомы – SRY (Sex-determining Region on the Y chromosome). Важно отметить, что нарушения в этом локусе могут приводить не к внешним проявлениям, а к сниженной репродуктивной способности мужчины или ее полному отсутствию. Процесс дифференцировки пола у человека можно представить тремя стадиями: 1) какой набор хромосом получается при слиянии яйцеклетки (всегда несет хромосому X) и сперматозоида (с хромосомой X или Y), 2) формирование женских или мужских половых органов в зависимости от работы генов локуса SRY, 3) развитие вторичных половых органов в соответствии с типом половых органов. Нарушения на разных этапах приводят к разным проявлениям и разным заболеваниям.
Нарушения на разных этапах приводят к разным проявлениям и разным заболеваниям.
Локус AZF – это участок Y-хромосомы, на котором располагаются так называемые факторы азооспермии (AZF — AZoospermia Factors). Это особые участки, которые названы так, потому что если какой-то из них отсутствует из-за мутации, то развивается азооспермия (отсутствие сперматозоидов) или олигозооспермия (малое количество сперматозоидов). Всего обнаружено три таких фактора AZFa, AZFb и AZFc. В норме наличие всех трех является минимальным необходимым условием нормального формирования сперматозоидов. Если в геноме отсутствует один из AZFa и AZFb или оба, то нарушается созревание сперматозоидов и, как следствие, полностью отсутствует репродуктивная функция. При отсутствии локуса AZFc нарушения могут быть не столь сильными, поэтому деторождение остается возможным в некоторых случаях.
Хромосомные аномалии – это крупные мутации, которые связаны с изменением последовательности ДНК не в рамках отдельного гена или нескольких, а в масштабе хромосомы или генома. Например, отсутствие (делеция) большой части или всей хромосомы, лишняя хромосома, или часть одной хромосомы соединена с частью другой хромосомы и т.д.
Например, отсутствие (делеция) большой части или всей хромосомы, лишняя хромосома, или часть одной хромосомы соединена с частью другой хромосомы и т.д.
Наследственное заболевание – это заболевание, вызванное нарушениями в геноме, то есть мутациями, которые либо мешают формированию нормального белка (так как ген – инструкция по его построению – поврежден), либо изменяют регуляцию, то есть условия, когда, в каком месте или с кем такой белок или ген должен работать.
Моногенное заболевание – это наследственное заболевание, вызванное мутацией в одном только в одном гене. Несмотря на то, что все остальные почти 30000 генов могут быть в порядке, изменение последовательности ДНК в этом гене вызывает нарушения функционирования всего организма.
Хромосомное заболевание – наследственное заболевание, вызванное хромосомными аномалиями.
Носительство мутации – это состояние гетерозиготы по аллелю, обладающему какими-то негативными клиническими проявлениями, если он находится в геноме в виде гомозиготы.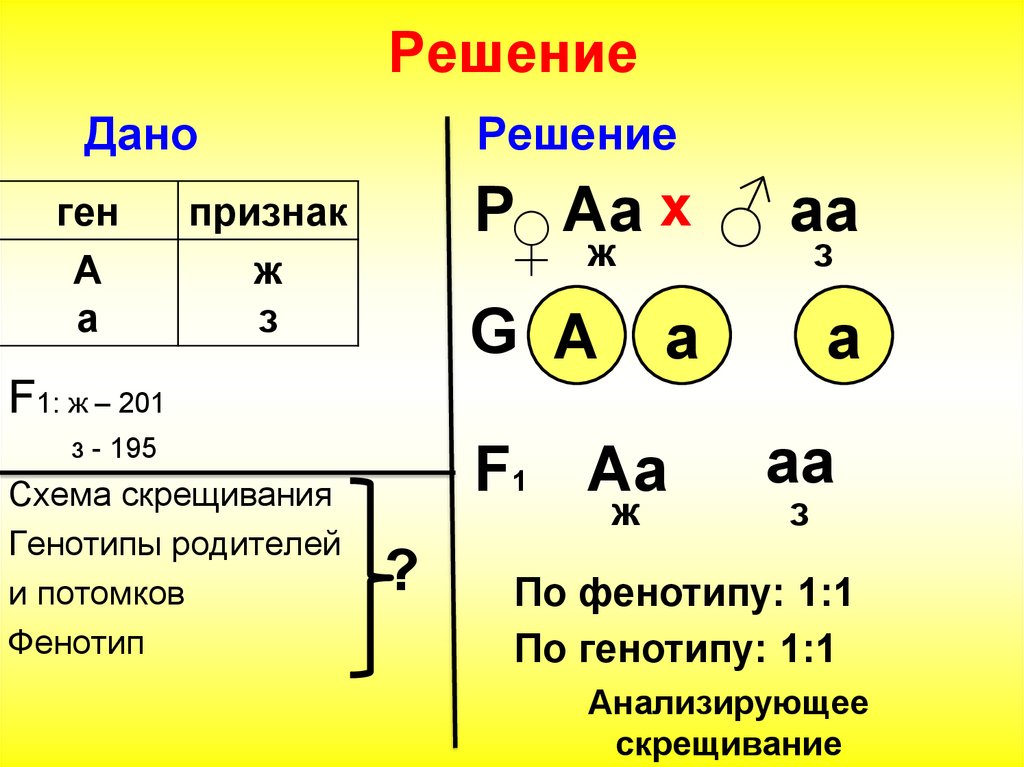
Пробанд – человек, с которого начинается составление генеалогического дерева (родословной). Обычно пробанд – это носитель или пациент с наследственным заболеванием, проявление которого и вызвало необходимость генеалогического анализа.
Сиблинг – в генетике таким термином обозначают потомков одних родителей, то есть братьев и сестер, но не близнецов.
Автор: Жикривецкая Светлана
Биолог-исследователь
|
⇐ ПредыдущаяСтр 4 из 7Следующая ⇒ Геноти́п — совокупность генов данного организма, которая, в отличие от понятий генома и генофонда, характеризует особь, а не вид (ещё отличием генотипа от генома является включение в понятие «геном» некодирующих последовательностей, не входящих в понятие «генотип»). Вместе с факторами внешней среды определяет фенотип организма. Обычно о генотипе говорят в контексте определенного гена, у полиплоидных особей он обозначает комбинацию аллелей данного гена (см. 1. По источнику информации (генотип определяется при изучении ДНК особи, фенотип регистрируется при наблюдении внешнего вида организма). 2. Генотип не всегда соответствует одному и тому же фенотипу. Некоторые гены проявляются в фенотипе только в определённых условиях. С другой стороны, некоторые фенотипы, например, окраска шерсти животных, являются результатом взаимодействия нескольких генов по типу комплементарности. Феноти́п (от греческого слова phainotip — являю, обнаруживаю) — совокупность характеристик, присущих индивиду на определённой стадии развития. Фенотип формируется на основе генотипа, опосредованного рядом внешне средовых факторов. У диплоидных организмов в фенотипе проявляются доминантные гены. Фенотип — совокупность внешних и внутренних признаков организма, приобретённых в результате онтогенеза (индивидуального развития). Несмотря на кажущееся строгое определение, концепция фенотипа имеет некоторые неопределенности. Во-первых, большинство молекул и структур кодируемых генетическим материалом, не заметны во внешнем виде организма, хотя являются частью фенотипа. Например, именно так обстоит дело с группами крови человека. Поэтому расширенное определение фенотипа должно включать характеристики, которые могут быть обнаружены техническими, медицинскими или диагностическими процедурами. Дальнейшее, более радикальное расширение может включать приобретенное поведение или даже влияние организма на окружающую среду и другие организмы. Например, согласно Ричарду Докинзу, плотину бобров также как и их резцы можно считать фенотипом генов бобра. [1] Фенотип можно определить как «вынос» генетической информации навстречу факторам среды. В первом приближении можно говорить о двух характеристиках фенотипа: а) число направлений выноса характеризует число факторов среды, к которым чувствителен фенотип, — мерность фенотипа; б) «дальность» выноса характеризует степень чувствительности фенотипа к данному фактору среды.
Гено́м — совокупность наследственного материала, заключенного в гаплоидном наборе хромосом клеток данного вида организмов. Термин «геном» был предложен Гансом Винклером в 1920 г. для описания совокупности генов, заключённых в гаплоидном наборе хромосом организмов одного биологического вида. Первоначальный смысл этого термина указывал на то, что понятие генома в отличие от генотипа является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось. Известно, что ДНК, которая является носителем генетической информации у большинства организмов и, следовательно, составляет основу генома, включает в себя не только гены в современном смысле этого слова. Генетическая информация в клетках содержится не только в хромосомах ядра, но и во внехромосомных молекулах ДНК. У бактерий к таким ДНК относятся плазмиды и некоторые умеренные вирусы, в клетках эукариот — это ДНК митохондрий, хлоропластов и других органоидов клеток (См. плазмон). Объёмы генетической информации, заключённой в клетках зародышевой линии (предшественники половых клеток и сами гаметы) и соматических клетках, в ряде случаев существенно различаются. В онтогенезе соматические клетки могут утрачивать часть генетической информации клеток зародышевой линии, амплифицировать группы последовательностей и (или) значительно перестраивать исходные гены. Следовательно, под геномом организма понимают суммарную ДНК гаплоидного набора хромосом и каждого из внехромосомных генетических элементов, содержащуюся в отдельной клетке зародышевой линии многоклеточного организма.
Генофонд — понятие из популяционной генетики, описывающее совокупность всех генных вариаций (аллелей) определённой популяции. Популяция располагает всеми своими аллелями для оптимального приспособления к окружающей среде. Можно также говорить о едином генофонде вида, так как между разными популяциями вида происходит обмен генами. Если во всей популяции существует лишь один аллель определённого гена, то популяция по отношению к вариантам этого гена называется мономорфной. При наличии нескольких разных вариантов гена в популяции она считается полиморфной. Если у рассматриваемого вида имеется более чем один набор хромосом, то совокупное количество разных аллелей может превышать количество организмов. Однако в большинстве случаев количество аллелей всё же меньше. При сильном инбридинге часто возникают мономорфные популяции лишь с одним аллелем многих генов. Одним из показателей объёма генофонда является эффективная величина популяции, сокращённо . У популяции людей с диплоидным набором хромосом может иметься максимально в два раза больше аллелей одного гена, чем индивидов, то есть <= 2 * (величины популяции). Исключены при этом половые хромосомы. Аллели всей популяци в идеальном случае распределены по закону Харди-Вайнберга. Более крупный генофонд с множеством разных вариантов отдельных генов ведёт к лучшему приспособлению потомства к меняющейся окружающей среде. ⇐ Предыдущая1234567Следующая ⇒ Читайте также: |
Карта сайта
Главная Обучение Библиотека Карта сайта
|
Vzaimodejstvie Genov : Основы генетики : Все про гены!
Взаимодействие аллельных генов
В состав генотипа входит большое количество генов, функционирующих и взаимодействуют как целостная система.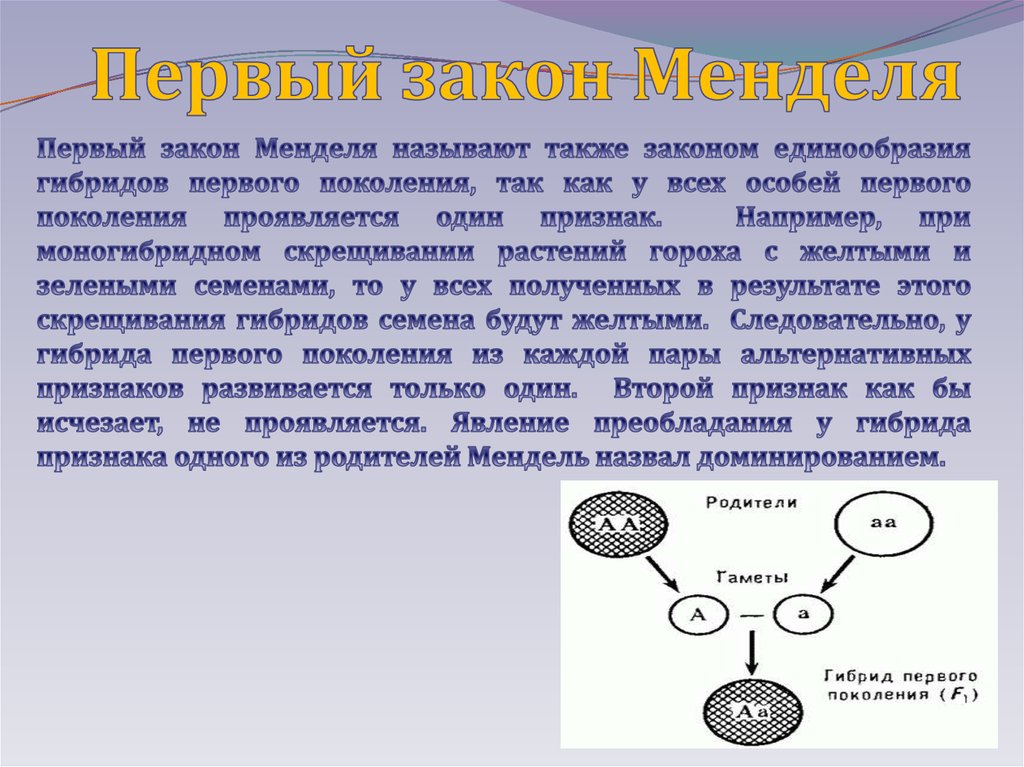 Г. Мендель в своих опытах обнаружил только одну форму взаимодействия между аллельными генами — полное доминирование одной аллели и полную рецесивнисть другой. Генотип организма нельзя рассматривать как простую сумму независимых генов, каждый из которых функционирует вне связи с другими. Фенотипное проявления того или иного признака являются результатом взаимодействия многих генов.
Г. Мендель в своих опытах обнаружил только одну форму взаимодействия между аллельными генами — полное доминирование одной аллели и полную рецесивнисть другой. Генотип организма нельзя рассматривать как простую сумму независимых генов, каждый из которых функционирует вне связи с другими. Фенотипное проявления того или иного признака являются результатом взаимодействия многих генов.
Различают две основных группы взаимодействия генов: взаимодействие между аллельными генами и взаимодействие между неаллельнимы генами. Однако следует понимать, что это не физическое взаимодействие самих генов, а взаимодействие первичных и вторичных продуктов, которые обусловят тот или иной признак. В цитоплазме происходит взаимодействие между белками — ферментами, синтез которых опрелятся генами, или между веществами, которые образовываются под влиянием этих ферментов.
Возможны следующие типы взаимодействия:
1) для образования определенного признака необходимо взаимодействие двух ферментов, синтез которых опрелятся двумя неаллельнимы генами;
2) фермент, что был синтезирован с участием одного гена, полностью подавляет или инактивирует действие фермента, что был образован другим неаллельным геном;
3) два ферменты, образование которых контролируется двумя неаллельми генами, влияющими на один признак или на один процесс так, что их совместное действие приводит к возникновению и усилению проявления признака.
Взаимодействие аллельных генов. Гены, которые занимают идентичные (гомологические) локусы в гомологичных хромосомах, называются аллельными. У каждого организма есть по два аллельных гена.
Известны такие формы взаимодействия между аллельными генами: полное доминирование, неполное доминирование, кодоминированием и сверхдоминирование.
Основная форма взаимодействия — полное доминирование, которое впервые описано Г. Менделем. Суть его заключается в том, что в гетерозиготном организме проявление одной из аллелей доминирует над проявлением другой. При полном доминировании расщепления по генотипу 1:2:1 не совпадает с расщеплением по фенотипу — 3:1. В медицинской практике с двух тысяч моногенных наследственных болезней почти в половины имеет место доминированое проявления патологических генов над нормальными. В гетерозигот патологический аллель проявляется в большинстве случаев признаками заболевания (доминантный фенотип).
Неполное доминирование — форма взаимодействия, при которой у гетерозиготного организма (Аа) доминантный ген (А) не полностью подавляет рецессивный ген (а), вследствие чего проявляется промежуточный между родительскими признак. Здесь расщепление по генотипу и фенотипу совпадает и составляет 1:2:1
При кодоминировании в гетерозиготных организмах каждый из аллельных генов вызывает формирование зависимого от него продукта, то есть оказываются продукты обеих аллелей. Классическим примером такого проявления является система групп крови, в частности система АBО, когда эритроциты человека несут на поверхности антигены, контролируемые обеими аллелями. Такая форма проявления носит название кодоминированием.
Сверхдоминирование — когда доминантный ген в гетерозиготном состоянии проявляется сильнее, чем в гомозиготном. Так, у дрозофилы при генотипе АА-нормальная продолжительность жизни; Аа — удлиненная триватисть жизни; аа — летальный исход.
Множественный алелизм
У каждого организма есть только по два аллельных гена. Вместе с тем нередко в природе количество аллелей может быть более двух, если какой то локус может находится в разных состояниях. В таких случаях говорят о множественные аллели или множественный аллеломорфизм.
Множественные аллели обозначаются одной буквой с разными индексами, например: А, А1, А3 … Аллельные гена локализуются в одинаковых участках гомологичных хромосом. Поскольку в кариотипе всегда присутствуют по две гомологичных хромосомы, то и при множественных аллелях каждый организм может иметь одновременно лишь по два одинаковых или различных аллели. В половую клетку (вместе с различием гомологичних хромосом) попадает только по одному из них. Для множественных аллелей характерное влияние всех аллелей на один и тот же признак. Отличие между ними заключается лишь в степени развития признака.
Второй особенностью является то, что в соматических клетках или в клетках диплоидных организмов содержится максимум по две аллели из нескольких, поскольку они расположены в одном и том же локусе хромосомы.
Еще одна особенность присуща множественным аллелям. По характеру доминирования аллеломорфные признаки размещаются в последовательном ряду: чаще нормальный, неизмененный признак доминирует над другими, второй ген ряда рецессивный относительно первого, однако доминирует над следующими и т.д. Одним из примеров проявления множественных аллелей у человека есть группы крови системы АВО.
Множественный алелизм имеет важное биологическое и практическое значение, поскольку усиливает комбинативну изменчивость, особенно генотипического.
Взаимодействие неалельних генов
Известно много случаев, когда признак или свойства детерминируются двумя или более неалельнимы генами, которые взаимодействуют между собой. Хотя и здесь взаимодействие условно, потому что взаимодействуют не гены, а контролируемые ими продукты. При этом имеет место отклонение от менделивских закономерностей расщепления.
Различают четыре основных типа взаимодействия генов: комплементарность, эпистаз, полимерию и модифицирующее действие (плейотропия).
Комплементарность это такой тип взаимодействия неаллельних генов, когда один доминантный ген дополняет действие другого неаллельного доминантного гена, и они вместе определяют новый признак, который отсутствует у родителей. Причем соответственный признак развивается только в присутствии обоих неаллельних генов. Например, сера окраска шерсти у мышей контролируется двумя генами (А и В). Ген А детерминирует синтез пигмента, однако как гомозиготы (АА), так и гетерозиготы (Аа) — альбиносы. Другой ген В обеспечивает скопления пигмента преимущественно у основания и на кончиках волос. Скрещивания дигетерозигот (АаВЬ х АаВЬ) приводит к расщеплению гибридов в соотношении 9:3:4. Числовые соотношения при комплементарном взаимодействии могут быть как 9:7; 9:6:1 (видоизменение менделивского расщепления).
Примером комплементарного взаимодействия генов у человека может быть синтез защитного белка — интерферона. Его образование в организме связано с комплементарным взаимодействием двух неаллельних генов, расположенных в разных хромосомах.
Эпистаз -это такое взаимодействие неаллельных генов, при котором один ген подавляет действие другого неаллельного гена. Угнетение могут вызывать как доминантные, так и рецессивные гены (А> В, а> В, В> А, В> А), и в зависимости от этого розличают эпистаз доминантный и рецессивный. Подавляющий ген получил название ингибитора или супрессора. Гены-ингибиторы в основном не детерминируют развитие определенного признака, а лишь подавляют действие другого гена.
Ген, эффект которого подавляется, получил название гипостатичного. При епистатичном взаимодействияи генов расщепление по фенотипу в F2 составляет 13:3; 12:3:1 или 9:3:4 и др. Окрас плодов тыквы, масть лошадей определяются этим типом взаимодействия.
Если ген-супрессор рецессивный, то возникает криптомерия (греч. хриштад — тайный, скрытый). У человека таким примером может быть «Бомбейский феномен». В этом случае редкий рецессивный аллель «х» в гомозиготном состоянии (мм) подавляет активность гена jB (определяющий В (III) группу крови системы АВО). Поэтому женщина с генотипом jв_хх, фенотипно имеет I группу крови — 0 (I).
Поэтому женщина с генотипом jв_хх, фенотипно имеет I группу крови — 0 (I).
Полигенное наследования количественных признаков
— плейотропия
— экспрессивность и пенетрантность генов
Большинство количественных признаков организмов определяется несколькими неаллельнимы генами (полигенами). Взаимодействие таких генов в процессе формирования признака называется полимерным. В этом случае две или более доминантных аллели в равной степени влияют на развитие одной и того же признаки. Поэтому полимерные гены принято обозначать одной буквой латинского алфавита с цифровым индексом, например: А1А1 и а1а1. Впервые однозначные факторы были выявлены шведским генетиком Нильсон-Эле (1908 г.) при изучении наследования цвета в пшеницы. Было установлено, что этот признак зависит от двух полимерных генов, поэтому при скрещивании доминантних и рецессивных дигомозигот — окрашенной (А1А1, А2 А2) с бесцветной (а1а1, а2а2) — в F, все растения дают окрашенные семена, хотя они светлее, чем родительские экземпляры, которые имеют красное семя. В F, при скрещивании особей первого поколения проявляется расщепление по фенотипу в соотношении 15:1, потому бесцветным является лишь рецессивные дигомозиготы (а1а1 а2а2). В пигментированных экземплярах интенсивность цвета очень отличается в зависимости от количества полученных ими доминантних аллелей: максимальная в доминантных дигомозигот (А1А1, А2 А2) и минимальная у носителей одного из доминантных аллелей.
В F, при скрещивании особей первого поколения проявляется расщепление по фенотипу в соотношении 15:1, потому бесцветным является лишь рецессивные дигомозиготы (а1а1 а2а2). В пигментированных экземплярах интенсивность цвета очень отличается в зависимости от количества полученных ими доминантних аллелей: максимальная в доминантных дигомозигот (А1А1, А2 А2) и минимальная у носителей одного из доминантных аллелей.
Важная особенность полимерии — суммация действия неаллельних генов на развитие количественных признаков. Если при моногенном наследовании признака возможны три варианта «доз» гена в генотипе: АА, Аа, аа, то при полигенных количество их возрастает до четырех и более. Суммация «доз» полимерных генов обесчивает существования непрерывных рядов количественных изменений.
Биологическое значение полимерии заключается еще и в том, что признаки, кодируемые этими генами, более стабильны, чем те, которые кодируются одним геном. Организм без полимерных генов был бы очень неустойчивым: любая мутация или рекомбинация приводила бы к резкой изменчивости, а это в большинстве случаев имеет неблагоприятный характер.
У животных и растений есть много полигенных признаков, среди них и ценные для хозяйства: интенсивность роста, скороспелость, яйценоскость, количество молока, содержание сахаристых веществ и витаминов и т.п.
Пигментация кожи у человека определяется пятью или шестью полимерными генами. В коренных жителей Африки (негроидной расы) преобладают доминантные аллели, у представителей европеоидной расы — рецессивные. Поэтому мулаты имеют промежуточную пигментацию, но при браках мулатов у них возможно появление как более, так и менее интенсивно пигментированных детей.
Многие морфологические, физиологические и патологические особенности человека определяются полимерными генами: рост, масса тела, величина артериального давления и др. Развитие таких признаков у человека подчиняется общим законам полигенного наследования и зависит от условий среды. В этих в случаях наблюдается, например, склонность к гипертонической болезни, ожирению и др. Данные признаки при благоприятных условиях среды могут не проявиться или проявиться незначительно. Эти полигенные признаки отличаются от моногенных. Изменяя условия среды можно обеспечить профилактику ряда полигенных заболеваний.
Эти полигенные признаки отличаются от моногенных. Изменяя условия среды можно обеспечить профилактику ряда полигенных заболеваний.
Плейотропия
Плейотропное действие генов — это зависимость нескольких признаков от одного гена, то есть множественное действие одного гена. В дрозофилы ген белого цвета глаз одновременно влияет на цвет тела, длины, крыльев, строение полового аппарата, снижает плодовитость, уменьшает продолжительность жизни. У человека известна наследственная болезнь — арахнодактилия («паучьи пальцы»-очень тонкие и длинные пальцы), или болезнь Марфана. Ген, отвечающий за эту болезнь, вызывает нарушение развития соединительной ткани и одновременно влияет на развитие нескольких признаков: нарушение строения хрусталика глаза, аномалии в сердечно-сосудистой системе.
Плейотропное действие гена может быть первичным и вторичным. При первичной плейотропии ген проявляет свой множественный эффект. Например, при болезни Хартнупа мутация гена приводит к нарушению всасывания аминокислоты триптофана в кишечнике и его реабсорбции в почечных канальцах. При этом поражаются одновременно мембраны эпителиальных клеток кишечника и почечных канальцев с расстройствами пищеварительной и выделительной систем.
При этом поражаются одновременно мембраны эпителиальных клеток кишечника и почечных канальцев с расстройствами пищеварительной и выделительной систем.
При вторичной плейотропии есть один первичный фенотипний проявление гена, вслед за которым развивается ступенчатый процесс вторичных изменений, приводящих к множественным эффектам. Так, при серповидно клеточной анемии у гомозигот наблюдается несколько патологических признаков: анемия, увеличенная селезенка, поражение кожи, сердца, почек и мозга. Поэтому гомозиготы с геном серповидно клеточной анемии гибнут, как правило, в детском возрасте. Все эти фенотипные проявления гена составляют иерархию вторичных проявлений. Первопричиной, непосредственным фенотипним проявлением дефектного гена является аномальный гемоглобин и эритроциты серповидной формы. Вследствие этого происходят последовательно другие патологические процессы: слипание и разрушение эритроцитов, анемия, дефекты в почках, сердце, мозге — эти патологические признаки вторичны.
При плейотропии, ген, воздействуя на какой то один основнй признак, может также менять, модифицировать проявление других генов, в связи с чем введено понятие о генах-модификаторах. Последние усиливают или ослабляют развитие признаков, кодируемых «основным» геном.
Показателями зависимости функционирования наследственных задатков от характеристик генотипа является пенетрантность и экспрессивность.
Рассматривая действие генов, их аллелей необходимо учитывать и модифицирующее влияние среды, в которой розвивается организм. Если растения примулы скрещивать при температуре 15-20 ° С, то в F1 согласно менделивской схеме, все поколения будут иметь розовые цветы. Но когда такое скрещивание проводить при температуре 35 °С, то все гибриды будут иметь цветы белого цвета. Если же осуществлять скрещивания при температуре около 30 ° С, то возникает разное соотношение (от 3:1 до 100%) растений с белыми цветами.
Такое колебание классов при расщеплении в зависимости от условий среды получило название пенетрантность — сила фенотипного проявления. Итак, пенетрантность — это частота проявления гена, явление появления или отсутствия признака у организмов, одинаковых по генотипу.
Итак, пенетрантность — это частота проявления гена, явление появления или отсутствия признака у организмов, одинаковых по генотипу.
Пенетрантность значительно колеблется как среди доминантных, так и среди рецессивных генов. Наряду с генами, фенотип которых появляется только при сочетании определенных условий и достаточно редких внешних условий (высокая пенетрантность), у человека есть гены, фенотипное проявление которых происходит при любых соединениях внешних условий (низкая пенетрантность). Пенетрантностью измеряется процентом организмов с фенотипным признаком от общего количества обследованных носителей соответствующих аллелей.
Если ген полностью, независимо от окружающей среды, определяет фенотипное проявление, то он имеет пенетрантность 100 процентов. Однако некоторые доминантные гены проявляются менее регулярно. Так, полидактилия имеет четкое вертикальное наследования, но бывают пропуски поколений. Доминантная аномалия — преждевременное половое созревание — присуще только мужчинам, однако иногда может передаться заболевания от человека, который не страдал этой патологией. Пенетрантностью указывает, в каком проценте носителей гена оказывается соответствующий фенотип. Итак, пенетрантность зависит от генов, от среды, от того и другого. Таким образом, это не константное свойство гена, а функция генов в конкретных условиях среды.
Пенетрантностью указывает, в каком проценте носителей гена оказывается соответствующий фенотип. Итак, пенетрантность зависит от генов, от среды, от того и другого. Таким образом, это не константное свойство гена, а функция генов в конкретных условиях среды.
Экспрессивность (лат. ехргеssio — выражение) — это изменение количественного проявления признака в разных особей-носителей соответствующего аллелей.
При доминантных наследственных заболеваниях экспрессивность может колебаться. В одной и той же рсемье могут проявляться наследственные болезни от легких, едва заметных до тяжелых: различные формы гипертонии, шизофрении, сахарного диабета и т.д. Рецессивные наследственные заболевания в пределах семьи проявляются однотипно и имеют незначительные колебанийния экспрессивности.
Основные закономерности наследования. Законы Г.Менделя
Здравствуй, дорогой друг. Сегодня мы с тобой изучим тему «Основные закономерности наследования и законы Менделя». В данной теме раскроем следующие понятия: гибридологический метод, чистые линии, моногибридное и дигибридное скрещивание, аллельные гены, гомозиготные и гетерозиготные организмы, доминантные и рецессивные признаки, расщепление, закон чистоты гамет.
В данной теме раскроем следующие понятия: гибридологический метод, чистые линии, моногибридное и дигибридное скрещивание, аллельные гены, гомозиготные и гетерозиготные организмы, доминантные и рецессивные признаки, расщепление, закон чистоты гамет.
Каковы цели нашего урока?
- изучить основные закономерности наследования;
- научиться применять законы Менделя при решении генетических задач;
- что такое наследственность?
Первую последовательную и непротиворечивую теорию эволюции в начале XIX века разработал Жан Батист Ламарк. В ее основе лежали два допущения: о наследовании приобретенных признаков и о внутренне присущем всему живому «стремлении к совершенству». Первая гипотеза объясняла, почему организмы так хорошо приспособлены к условиям обитания. В течение жизни они используют свои органы по-разному: одни чаще, другие реже. Органы, которые все время «тренируются», крепнут и растут, а «остающиеся без работы» — уменьшаются и слабеют. Небольшие изменения, возникающие вследствие такой избирательной тренировки, передаются по наследству. Например, если животное питается листьями, растущими высоко на деревьях, ему приходится часто вытягивать шею. Шея тренируется, крепнет и постепенно удлиняется. Потомство такого животного уже от рождения получит чуть более длинную шею. Так, по мнению Ламарка, жирафы приобрели свою знаменитую шею. А если какая-то птица перестает летать и переходит к наземному образу жизни, то, согласно его представлениям, ее крылья, долгое время остающиеся неиспользованными, рано или поздно атрофируются. Так возникли нелетающие птицы с рудиментарными крыльями. Второе предположение Ламарка — внутренняя «тяга к совершенству» — объясняло постепенное усложнение организмов, появление новых органов и тканей.
Небольшие изменения, возникающие вследствие такой избирательной тренировки, передаются по наследству. Например, если животное питается листьями, растущими высоко на деревьях, ему приходится часто вытягивать шею. Шея тренируется, крепнет и постепенно удлиняется. Потомство такого животного уже от рождения получит чуть более длинную шею. Так, по мнению Ламарка, жирафы приобрели свою знаменитую шею. А если какая-то птица перестает летать и переходит к наземному образу жизни, то, согласно его представлениям, ее крылья, долгое время остающиеся неиспользованными, рано или поздно атрофируются. Так возникли нелетающие птицы с рудиментарными крыльями. Второе предположение Ламарка — внутренняя «тяга к совершенству» — объясняло постепенное усложнение организмов, появление новых органов и тканей.
Что же изменил Дарвин в теории Ламарка? Он отказался от второй посылки своего предшественника — «тяги к совершенству» — и придумал такой механизм эволюционных изменений, которого теория Ламарка не предусматривала, — естественный отбор. Механизм естественного отбора основан на борьбе за существование (которая происходит оттого, что живые существа производят больше потомков, чем может выжить), изменчивости (ее причины Дарвин, не зная генетики, не мог сформулировать и принимал просто как данность) и наследственности, благодаря которой свойства, помогающие данной особи выжить, передаются ее потомству.
Механизм естественного отбора основан на борьбе за существование (которая происходит оттого, что живые существа производят больше потомков, чем может выжить), изменчивости (ее причины Дарвин, не зная генетики, не мог сформулировать и принимал просто как данность) и наследственности, благодаря которой свойства, помогающие данной особи выжить, передаются ее потомству.
Таким образом, наследственность — это способность организмов передавать свои признаки и свойства из поколения в поколение.
Материальной основой наследственности служат структуры ядра — хромосомы. Для каждого организма характерно постоянное число хромосом. Например: у человека 23 пары, у обезьян 24 пары, у дрозофилы 4 пары хромосом). Каждая хромосома в соматических клетках человека и других двуполых организмов представлена дважды.
Две одинаковые по размерам и форме хромосомы, образующие пару называют гомологичными. В одинаковых участках гомологичных хромосом расположены парные или аллельные гены (аллели). При этом различают доминантную аллель (ген А) и рецессивную (ген а). Пример: ген А — красная окраска лепестков, ген а — белая окраска лепестков. Если гомологичные хромосомы несут одинаковые аллельные гены, то такой организм называют гомозиготным (АА, аа), а если разные — гетерозиготным (Аа). Например, АА — гомозиготный организм с желтой окраской семени, аа — с зеленой окраской семени, Аа — гетерозиготный организм, несущий ген А — желтой окраски, ген а — зеленой окраски.
В одинаковых участках гомологичных хромосом расположены парные или аллельные гены (аллели). При этом различают доминантную аллель (ген А) и рецессивную (ген а). Пример: ген А — красная окраска лепестков, ген а — белая окраска лепестков. Если гомологичные хромосомы несут одинаковые аллельные гены, то такой организм называют гомозиготным (АА, аа), а если разные — гетерозиготным (Аа). Например, АА — гомозиготный организм с желтой окраской семени, аа — с зеленой окраской семени, Аа — гетерозиготный организм, несущий ген А — желтой окраски, ген а — зеленой окраски.
Основоположником генетики является Грегор Мендель. А, почему же именно Менделя считают основоположником генетики? С 1856 года он в монастырском саду начал проводить обширные и тщательно продуманные опыты, связанные со скрещиванием растений. На примере гороха он выявлял закономерности наследования различных признаков в потомстве гибридных растений. Почему именно горох? Каким способом происходит опыление у гороха? Правильно, данное растение способно к самоопылению, т. е. пыльца из пыльников переносится на рыльце пестика одного и того же цветка или между цветками одного растения.
е. пыльца из пыльников переносится на рыльце пестика одного и того же цветка или между цветками одного растения.
Для проведения опытов над горохом Г.Мендель использовал гибридологический метод. Он заключается в скрещивании организмов, отличающихся по каким-либо признакам и в последующем анализе характера наследования этих признаков у потомства.
Г.Мендель проводил скрещивание растений гороха, при котором родительские формы анализировались по одной паре альтернативных признаков (семена желтые и зеленые, гладкие и морщинистые и т.д.) Такое скрещивание называют моногибридным. Пример: АА — семена желтые, аа — семена зеленые. Если у родительских форм учитывались две пары альтернативных признаков — дигибридное скрещивание. Пример: ААВВ — растения с желтой окраской и гладкими семенами, аавв — с зеленой окраской и морщинистыми семенами.
Прежде чем проводить опыты, Мендель получил чистые линии гороха с альтернативными (противоположными) признаками, т. е. гомозиготные доминантные (АА — желтая окраска семян) и гомозиготные рецессивные (аа — зеленая окраска), которые в дальнейшем скрещивались друг с другом. Спустя семь лет эксперименты были закончены. А еще через пару лет, в 1865 году, на заседаниях общества естествоиспытателей Брюнна Мендель выступил с докладом о проделанной работе. Через год вышла его статья об опытах над растительными гибридами. Именно благодаря ей были заложены основы генетики как самостоятельной научной дисциплины. Благодаря этому, Мендель — основоположник генетики.
е. гомозиготные доминантные (АА — желтая окраска семян) и гомозиготные рецессивные (аа — зеленая окраска), которые в дальнейшем скрещивались друг с другом. Спустя семь лет эксперименты были закончены. А еще через пару лет, в 1865 году, на заседаниях общества естествоиспытателей Брюнна Мендель выступил с докладом о проделанной работе. Через год вышла его статья об опытах над растительными гибридами. Именно благодаря ей были заложены основы генетики как самостоятельной научной дисциплины. Благодаря этому, Мендель — основоположник генетики.
Введем несколько терминов необходимых для решения задач:
1. фенотип — совокупность всех признаков организма.
2. генотип — совокупность генов организма.
Изобразим моногибридное скрещивание в виде схемы. Обозначим родительские особи латинской буквой «Р», её можно запомнить по английскому слову «parents»(родители), напротив записываем генотипы родителей АА и аа, подписываем под ними фенотипы АА-желтые семена, аа-зеленые, между ними ставим знак скрещивания в виде крестика — Х, ниже под буквой «Р» пишем гаметы, которые обозначают буквой «G», из каждой аллели получают по одной гамете А и а, их обводят в кружок. Соединяем полученные гаметы и получаем первое поколение потомков (гибридов) — F1 подписываем под буквой «G» и выписываем генотип Аа — гетерозигота, т.к. присутствует доминантный ген А (жёлтая окраска семян), то организм получается с желтыми семенами.
Соединяем полученные гаметы и получаем первое поколение потомков (гибридов) — F1 подписываем под буквой «G» и выписываем генотип Аа — гетерозигота, т.к. присутствует доминантный ген А (жёлтая окраска семян), то организм получается с желтыми семенами.
В результате скрещивания мы видим, что все потомки в первом поколении одинаковы (единообразны) по фенотипу (проявился доминантный признак — желтая окраска семян) и генотипу (гетерозиготны). Давайте попробуем сформулировать первый закон Менделя — закон единообразия гибридов первого поколения (F1). Проверим, правильно ли вы его сформулировали:
При скрещивании гомозиготных особей, анализируемых по одной паре альтернативных признаков, наблюдается единообразие гибридов первого поколения как по фенотипу, так и по генотипу.
Попробуйте применить первый закон Менделя, решив генетическую задачу:
- Ген черной масти у крупнорогатого скота доминирует над геном красной масти.
 Какое потомство F1 получится от скрещивания чистопородного черного быка с красными коровами?
Какое потомство F1 получится от скрещивания чистопородного черного быка с красными коровами?
Для решения данной задачи необходимо записать
Дано: А-ген черной масти, а — ген красной масти; отчерчиваем и записываем то, что нужно
Найти: F1.
Записываем Решение.
1. Красные коровы несут рецессивный признак, следовательно, они гомозиготны по рецессивному гену и их генотип — аа.
2. Бык несет доминантный признак черной масти и является чистопородным, т.е. гомозиготным. Следовательно, его генотип — АА.
3. Гомозиготные особи образуют один тип гамет, у черного быка доминантный ген А, а у красной коровы только рецессивный ген а.
4. В результате слияния гамет образуется единообразное поколение F1 с генотипом Аа и фенотипом черной масти.
Теперь разберемся со вторым законом Менделя, законом расщепления. Для этого вернёмся к гороху. Скрещиваем гибридов (потомков) первого поколения (Аа — желтые семена) между собой. Из каждой аллельной пары образовалось два типа гамет: у первой особи — А и а, у второй — А и а. В результате их слияния образуются следующие аллели: АА (жёлтая окраска), 2Аа (желтая окраска), аа (зеленая окраска семян). По фенотипу произошло расщепление в соотношении 3:1 (3 особи с желтыми семенами и 1 особь с зелеными) и по генотипу 1:2:1 (1АА, 2Аа, 1аа). Попробуй сформулировать второй закон Менделя.
Скрещиваем гибридов (потомков) первого поколения (Аа — желтые семена) между собой. Из каждой аллельной пары образовалось два типа гамет: у первой особи — А и а, у второй — А и а. В результате их слияния образуются следующие аллели: АА (жёлтая окраска), 2Аа (желтая окраска), аа (зеленая окраска семян). По фенотипу произошло расщепление в соотношении 3:1 (3 особи с желтыми семенами и 1 особь с зелеными) и по генотипу 1:2:1 (1АА, 2Аа, 1аа). Попробуй сформулировать второй закон Менделя.
Проверим:
При скрещивании гибридов первого поколения наблюдается расщепление в соотношении 3:1 по фенотипу и 1:2:1 по генотипу.
Решим задачу, применив данный закон:
- У пшеницы ген карликового роста доминантен над геном нормального роста. Определите, какое будет потомство при скрещивании гомозиготной карликовой пшеницы с нормальной пшеницей и какое будет потомство при скрещивании двух гетерозиготных карликовых растений пшеницы.
Запишем дано, найти и решение. Что нам дано? Что необходимо найти?
Что нам дано? Что необходимо найти?
Проверяем, дано: А-ген карликового роста, а — ген нормального роста. Нам необходимо найти потомков первого (F1) и второго поколения (F2). Итак, решение. При скрещивании карликовой АА и нормальной пшеницы аа карликовая пшеница дает гаметы с геном А, нормальная пшеница дает гаметы с геном а. Потомство F1 получится карликовым Аа, так как потомки гетерозиготные. При скрещивании двух гетерозиготных организмов карликовой пшеницы Аа образуются от родительских форм два типа гамет, А и а. Сочетание этих гамет дает три генотипа: ¼ с генотипом АА, 2/4 с генотипом Аа, ¼ с генотипом аа. Снова получаем соотношение по росту 3:1.
Анализирующее скрещивание. Что это такое и для чего оно нужно?
В некоторых случаях необходимо установить генотип особи с доминантным признаком, т.к. при полном доминировании гомозигота (АА) и гетерозигота (Аа) фенотипически неотличимы.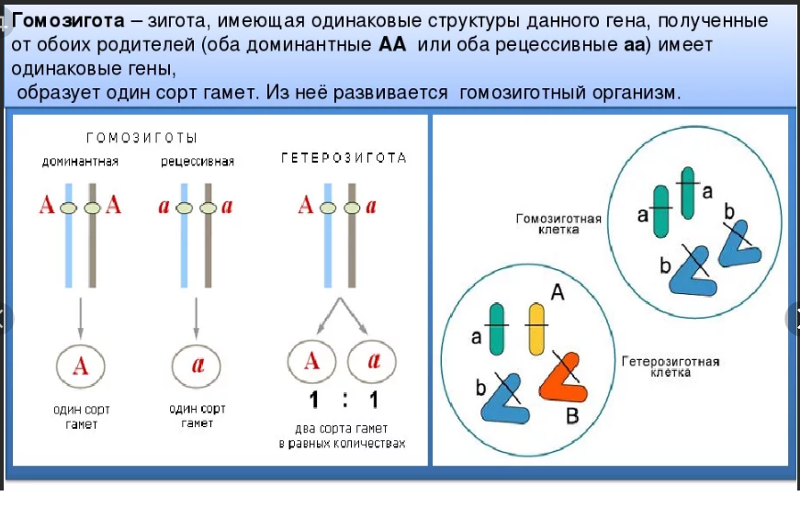 Для этого применяется анализирующее скрещивание, при котором данный организм с неизвестным генотипом скрещивается с гомозиготным рецессивным (аа) по данной аллели.
Для этого применяется анализирующее скрещивание, при котором данный организм с неизвестным генотипом скрещивается с гомозиготным рецессивным (аа) по данной аллели.
Если в результате такого скрещивания получено единообразие гибридов первого поколения, то анализируемый организм является гомозиготным, а если в F1 произошло расщепление 1:1, то организм является гетерозиготным.
Неполное доминирование
В приведенных примерах доминантный ген полностью подавляет рецессивный, однако он не всегда может полностью подавлять действие рецессивного гена, такое доминирование называют неполным. Гибриды первого поколения не производят признаки родителей — промежуточный характер наследования.
Например, при скрещивании гомозиготных растений ночной красавицы с красными (АА) и белыми (аа) цветками первое поколение получается с розовыми цветками (Аа).
При скрещивании гетерозигот первого поколения получили расщепление 1:2:1, т. е. 1АА — красные цветки, 2Аа — розовые, аа — белые.
е. 1АА — красные цветки, 2Аа — розовые, аа — белые.
Третий закон Менделя
Изучив наследование одной пары аллелей, Мендель решил проследить наследование двух признаков у гороха. Он использовал гомозиготные растения, отличающиеся по двум парам альтернативных признаков: семена желтые гладкие и зеленые морщинистые.
При таком скрещивании он получил растения, у которых были желтые и гладкие семена, что подтверждает первый закон Менделя, который проявляется не только при моногибридном скрещивании, но и при дигибридном.
Полученные гибриды первого поколения будут давать четыре типа гамет в равном соотношении (АВ, Аb, aB, ab), т.к. в процессе мейоза из каждой пары генов в гамету попадает только один, который свободно комбинируется с генами другой пары.
При скрещивании гибридов первого поколения возможно 16 вариантов их сочетаний. Для удобства записи лучше пользоваться решеткой Пеннета, в которой по горизонтали записывают женские гаметы, а по вертикали — мужские.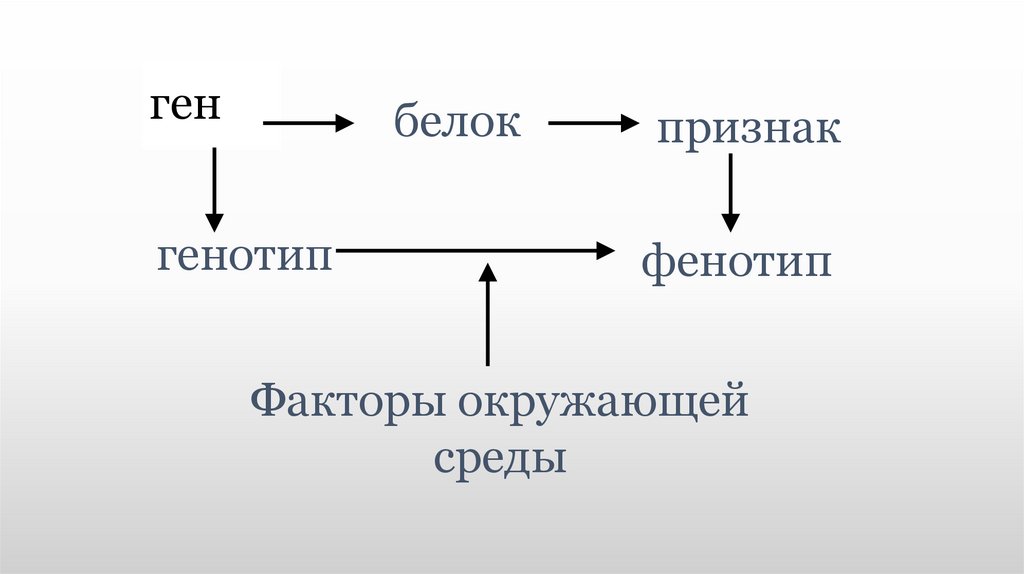
В результате скрещивания в зиготах получаются разные комбинации генов. По фенотипу потомство делится на 4 группы:
- 9 частей желтые гладкие (А_B_)
- 3 части желтые морщинистые (A_bb)
- 3 части зеленых гладких (aaB_)
- 1 часть зеленые морщинистые (aabb).
Если учесть расщепление по одной паре признаков, то получится (9+3) особи с желтыми (гладкими) и (3+1) особь с зелеными (морщинистыми) семенами. Их соотношение равно 12:4, или 3:1. Следовательно, при дигибридном скрещивании каждая пара признаков в потомстве дает расщепление независимо от другой пары, как и при моногибридном скрещивании. При этом происходит случайное комбинирование генов, приводящее к новым их сочетаниям, которых не было у родительских форм.
Отсюда следует третий закон Менделя (закон независимого комбинирования признаков):
При скрещивании гомозиготных особей, анализируемых по двум или нескольким парам альтернативных признаков, во втором поколении наблюдается независимое комбинирование генов разных аллельных пар и соответствующих им признаков.
Множественный аллелизм
Рассмотрим взаимодействие генов в соматических клетках. Как известно в соматических клетках одного организма содержится только два аллеля одного гена. Однако ген может находиться более, чем в двух состояниях. Разнообразие аллелей одного гена получило название множественный аллелизм. Разные аллели одного гена обуславливают развитие одного признака. Например, группу крови человека определяют три аллельных гена (А, В, 0).
- 00 — I группа крови,
- АА и А0 — II группа крови,
- ВВ и В0 — III группа крови
- АВ — IV группа крови
Если у матери IV группа крови (АВ), а у отца — I группа (00), то с какой группой крови могут родиться дети в этом браке? В результате скрещивания образуется три типа гамет: у матери — А и В, у отца — 0. Следовательно, дети могут иметь либо II, либо III группу крови.
Ген может проявлять множественное действие — контролировать развитие нескольких признаков.
Таким образом, законы Менделя являются практически универсальными, т.к. согласно им происходит наследование признаков у всех организмов, размножающихся половым путем.
Генетика и выбор партнера — Нож
Нередко для ответа на поставленные вопросы использовались объяснения с точки зрения наиболее успешного в эволюционном плане поведения или выведения универсальных критериев привлекательности. Увы, при этом игнорировался базовый уровень формирования склонности к тому или иному поведению — генетический. Перед переходом на этот уровень ознакомимся с базовыми понятиями из области генетики, которые будут фигурировать в дальнейшем изложении.
Любовь с первого вздохаНа молекулярном уровне влияние на выбор партнера оказывает главный комплекс гистосовместимости (ГКГ, англ. major histocompatibility complex) — область генома, играющая роль в адаптивных функциях иммунитета позвоночных: в частности, ГКГ кодирует белки для осуществляемого лимфоцитами распознания патогенов или чужеродных элементов.
Исследования на грызунах и рыбах показали, что животные предпочитают выбирать партнеров, ГКГ которых отличается от их собственного. Это может способствовать избеганию близкородственного скрещивания, а также повышению сопротивляемости потомства инфекционным заболеваниям, поскольку ГКГ-гетерозиготы, благодаря сочетанию отличающихся друг от друга ГКГ-генотипов, предоставляют больше антигенов для иммунной системы. С другой стороны, как было показано в исследованиях рыб, чрезмерный полиморфизм ГКГ может быть сопряжен с повышенной паразитарной нагрузкой, поскольку гиперактивация иммунной системы может наносить вред не только чужеродным, но и собственным клеткам организма. Поэтому с точки зрения успешной репродукции оптимальный уровень различий в ГКГ-генотипах партнеров не обязательно должен соответствовать максимуму.
Читайте также
Генетический эссенциализм: почему мы верим в генетику как в Бога и чего не расскажут о нас ДНК-тесты
Поскольку ГКГ-гены влияют на характеристики запахов, исходящих от особи, распознание ГКГ-генотипа может осуществляться через обоняние. Обнаружение опосредованных ГКГ запахов может происходить через вомероназальный орган, располагающийся у ряда позвоночных за носовой перегородкой над твердым небом. Вомероназальный орган содержит рецепторы, которые детектируют нелетучие органические соединения, к которым, в частности, относятся феромоны, служащие катализатором для активации репродуктивного поведения. Содержание в вомероназальном органе молекул ГКГ служит основанием для рассмотрения их потенциальной роли в различении аромата родственных и неродственных особей, что подтверждается такими примерами, как способность мышей различать феромоны других особей в зависимости от их ГКГ-генотипа.
Обнаружение опосредованных ГКГ запахов может происходить через вомероназальный орган, располагающийся у ряда позвоночных за носовой перегородкой над твердым небом. Вомероназальный орган содержит рецепторы, которые детектируют нелетучие органические соединения, к которым, в частности, относятся феромоны, служащие катализатором для активации репродуктивного поведения. Содержание в вомероназальном органе молекул ГКГ служит основанием для рассмотрения их потенциальной роли в различении аромата родственных и неродственных особей, что подтверждается такими примерами, как способность мышей различать феромоны других особей в зависимости от их ГКГ-генотипа.
Соблюдается ли такой принцип идентификации ГКГ-генотипа среди людей?
Во-первых, по сей день ни в одном из исследований не удалось изолировать человеческие феромоны. Роль феромонов, приписываемая двум стероидам — андростадиенону и эстратетраенолу, с проведением всё новых исследований ставится под сомнение.
Впрочем, это не исключает существования феромонов у людей, поскольку есть вероятность преодоления методологических ограничений, присущих нынешним исследованиям. Во-вторых, упомянутый вомероназальный орган сформирован у человека в недостаточной мере, что заставило некоторых исследователей сомневаться в его способности обеспечивать полноценную обонятельную коммуникацию. Однако существуют и заявления о том, что представления о чрезмерной бедности обонятельных функций человека не более чем миф. Этот миф основан на ошибочных допущениях анатомистов XIX века, предполагавших, что небольшой размер обонятельной луковицы в мозгу человека, в которой происходит обработка запахов, свидетельствует о том, что обонятельные функции у человека развиты хуже, чем у других животных. Последующие же исследования показали, что человек способен ощущать запах всех летучих веществ величиной больше 1–2 атомов, различать более триллиона обонятельных стимулов и даже, подобно собакам, отслеживать запах на десятиметровой траектории в открытом поле. Таким образом, обонятельные способности человека не должны препятствовать возможности идентифицировать ГКГ-генотип по запаху, что подтверждается описываемыми далее исследованиями.
Таким образом, обонятельные способности человека не должны препятствовать возможности идентифицировать ГКГ-генотип по запаху, что подтверждается описываемыми далее исследованиями.
Версия ГКГ, представленная среди людей, носит название человеческих лейкоцитарных антигенов (англ. HLA, human leukocyte antigens). В первом исследовании взаимосвязи HLA-генотипа и сексуальных предпочтений группе женщин предлагали оценить запах, исходящий от футболок, которые в течение двух ночей находились на мужчинах. Информация о внешности и других характеристиках мужчин не предоставлялась. В соответствии с ожиданиями женщины оценивали выше ароматы, принадлежащие мужчинам, HLA-генотип которых отличался от их собственного.
Также был получен любопытный результат: если женщина использовала оральные контрацептивы, она предпочитала аромат мужчин со схожим HLA-генотипом. Авторы предположили, что гормональная контрацепция способствует выработке стероидов, которые «симулируют» беременность на физиологическом уровне. В этом случае предпочтение может отдаваться запахам родственных особей, поскольку среди различных видов именно они оказывают поддержку в заботе о потомстве.
Авторы предположили, что гормональная контрацепция способствует выработке стероидов, которые «симулируют» беременность на физиологическом уровне. В этом случае предпочтение может отдаваться запахам родственных особей, поскольку среди различных видов именно они оказывают поддержку в заботе о потомстве.
Последнее может объясняться повышением чувствительности к потенциальным отношениям вне сформировавшейся пары в целях повышения гетерозиготности потомства, что наблюдалось, в частности, среди птиц.
Может быть интересно
Секс и старение: феромоны работают, но не так, как вы думаете
Последующее исследование с привлечением участников уже обоих полов подтвердило взаимосвязь обонятельных предпочтений и выраженности различий в HLA-генотипах.
Исследование, в котором участникам обоих полов предлагалось оценить запах футболок представителей противоположного пола, показало, что мужчины предпочитали запах женщин с отличным HLA-генотипом. Корреляции между запахами, предпочтительными для женщин, и степенью отличия HLA-генотипов мужчин обнаружено не было, но при этом женщины предпочитали аромат HLA-гетерозиготных мужчин, что может соответствовать обеспечению разнообразия HLA-генотипа потомства в целях повышения устойчивости к патогенам. В частности, было установлено, что именно HLA-гетерозиготные люди проявляли большую устойчивость к ВИЧ-инфекции, выражаемую в задержке наступления СПИДа, а также к гепатитам B и C.
Более реалистичные условия восприятия запахов других людей предполагают нередкое использование парфюма. Доступность духов, созданных на основе бесчисленных комбинаций ароматов, повышает потребительскую избирательность и предполагает «зашумление» естественной обонятельной коммуникации. Тем не менее одно из исследований показало, что индивидуальные предпочтения в выборе парфюма коррелируют с HLA-генотипом человека. При этом подобные эффекты не наблюдались в отношении выбора парфюма для партнера. Таким образом, в соответствии с логикой полученных результатов выбранный парфюм не столько подавляет естественный запах, сколько дополняет его таким образом, что за счет обнаруженной корреляции происходит усиление запахов тела, сигнализирующих о HLA-генотипе потенциальному партнеру.
При этом подобные эффекты не наблюдались в отношении выбора парфюма для партнера. Таким образом, в соответствии с логикой полученных результатов выбранный парфюм не столько подавляет естественный запах, сколько дополняет его таким образом, что за счет обнаруженной корреляции происходит усиление запахов тела, сигнализирующих о HLA-генотипе потенциальному партнеру.
Электрофизиологическое исследование взаимосвязи предпочтений ароматов и HLA показало, что активация в ответ на аромат HLA-схожих людей возникала быстрее и была более выраженной. Этот эффект наблюдался независимо от того, воспринимал ли участник запах представителя своего или противоположного пола. При этом активация мозга у мужчин в ответ на аромат HLA-схожих мужчин затрагивала лобные области, а у женщин в ответ на аромат HLA-схожих женщин — теменные, что может указывать на реализацию дополнительных функций, связанных с конкуренцией между мужчинами и общинным поведением среди женщин. Повышенная реакция в ответ на схожесть HLA-генотипов может указывать на то, что схожесть генотипов выступает более важным сигналом в целях избегания близкородственного скрещивания, нежели сигнал о генотипических различиях, способствующих формирования влечения.
Задавая вопрос о том, что именно привлекает людей в их избраннике или избраннице, гораздо чаще в ответ можно услышать описание красивых глаз или нежной улыбки, нежели упоминание приятного запаха, поскольку именно зрительная информация служит для людей одним из ключевых критериев выбора партнера (по крайней мере, на начальном этапе взаимодействия). Поэтому в контексте обсуждения HLA-генотипа может возникнуть впечатление, что, поскольку его обнаружение базируется в такой модальности, как обоняние, влияние его на выбор партнера может быть не столь принципиальным для человека. Но удивительным образом HLA-генотип влияет и на предпочтения, касающиеся внешности потенциального партнера.
Так, например, было проведено исследование, в котором женщины оценивали привлекательность фотографий незнакомых мужчин. Вопреки результатам, полученным ранее при оценке запахов, женщины оценивали выше внешнюю привлекательность тех мужчин, HLA-генотип которых был схож с их собственным. Подобное предпочтение может объясняться тем, что участницы оценивали привлекательность мужчин в контекстах краткосрочных и долгосрочных отношений и именно в контексте долгосрочных отношений предпочтение схожих по HLA-генотипу мужчин было более выраженным. Второе объяснение может быть более интригующим: предпочтение отличных по HLA-генотипу партнеров в обонятельной модальности и близких по HLA-генотипу — в зрительной может обеспечивать уже обсуждаемый выше оптимальный уровень генетической совместимости, предполагающий среднюю степень гетерозиготности.
Подобное предпочтение может объясняться тем, что участницы оценивали привлекательность мужчин в контекстах краткосрочных и долгосрочных отношений и именно в контексте долгосрочных отношений предпочтение схожих по HLA-генотипу мужчин было более выраженным. Второе объяснение может быть более интригующим: предпочтение отличных по HLA-генотипу партнеров в обонятельной модальности и близких по HLA-генотипу — в зрительной может обеспечивать уже обсуждаемый выше оптимальный уровень генетической совместимости, предполагающий среднюю степень гетерозиготности.
В иных исследованиях уже непосредственно HLA-гетерозиготность изучалась в качестве фактора, оказывающего влияние на предпочтение внешности при выборе партнера. Так, было показано, что женщины предпочитают фотографии лиц HLA-гетерозиготных мужчин, причем это предпочтение не зависело от схожести оценивающей женщины и оцениваемого мужчины по HLA-генотипу. Два других исследования, напротив, не обнаружили взаимосвязи HLA-гетерозиготности и привлекательности лиц ни в случае, когда мужчины оценивали женщин, ни в случае, когда представители обоих полов оценивали представителей противоположного пола. При этом в более позднем исследовании уровень HLA-гетерозиготности положительно коррелировал с привлекательностью мужских лиц, оцениваемых женщинами, но не был связан с привлекательностью женских лиц, оцениваемых мужчинами.
При этом в более позднем исследовании уровень HLA-гетерозиготности положительно коррелировал с привлекательностью мужских лиц, оцениваемых женщинами, но не был связан с привлекательностью женских лиц, оцениваемых мужчинами.
Несмотря на это кажущееся противоречие, тенденции, наблюдаемые в зрительной модальности без привязки к генотипу, соответствуют результатам исследования, в котором было установлено внешнее сходство между женами и мужьями. Это позволяет судить о том, что при выборе партнера для долгосрочных отношений человек может руководствоваться критерием самоподобия, подразумевающего схожесть генотипов.
В исследовании, в котором участникам предлагалось оценивать привлекательность нескольких вариантов лица партнера, предпочтение отдавалось варианту, совмещавшему черты собственного лица участника и его партнера (см. рис. 3). И для заданного участника именно этот вариант казался более предпочтительным даже в сравнении с комбинацией фотографии партнера и универсального прототипа (см. рис. 2), несмотря на то что другие участники оценивали это лицо как более привлекательное. Оптимальное смешение фотографий предполагало лишь 22% включения черт второго лица в фотографию партнера, и участники не обнаруживали присутствия собственных черт в изображениях. Поэтому процессы предпочтения, предположительно, активизировались на бессознательном уровне.
рис. 3). И для заданного участника именно этот вариант казался более предпочтительным даже в сравнении с комбинацией фотографии партнера и универсального прототипа (см. рис. 2), несмотря на то что другие участники оценивали это лицо как более привлекательное. Оптимальное смешение фотографий предполагало лишь 22% включения черт второго лица в фотографию партнера, и участники не обнаруживали присутствия собственных черт в изображениях. Поэтому процессы предпочтения, предположительно, активизировались на бессознательном уровне.
В другом исследовании изолированно оценивались чувство доверия, вызываемого изображениями лиц, и степень привлекательности этих лиц. Участники выбирали лица, вызывающие у них доверие, лица, привлекательные для долгосрочных отношений, а также лица, привлекательные для краткосрочных отношений. Фактор схожести лиц участника и человека на фотографии повышал чувство доверия, не влиял на привлекательность в контексте долговременных отношений и понижал привлекательность в контексте краткосрочных отношений. Поэтому схожесть лиц супругов в ранее упомянутом исследовании может объясняться тем, что при построении долгосрочных отношений, помимо привлекательности, учитывается и просоциальный аспект, предполагающий доверие между партнерами.
Фактор схожести лиц участника и человека на фотографии повышал чувство доверия, не влиял на привлекательность в контексте долговременных отношений и понижал привлекательность в контексте краткосрочных отношений. Поэтому схожесть лиц супругов в ранее упомянутом исследовании может объясняться тем, что при построении долгосрочных отношений, помимо привлекательности, учитывается и просоциальный аспект, предполагающий доверие между партнерами.
В упоминаемом ранее исследовании было обнаружено внешнее сходство не только между супругами, но и между женами и их свекровями. Возможно предположить, что это сходство является следствием выбора партнера по принципу самоподобия и перекрытия генотипов (а соответственно, и фенотипов) родителей и потомства. Но ряд фактов требует дополнительного объяснения. К ним относятся выявленная в том же исследовании обратная зависимость между степенью отвержения мужчины собственной матерью в детстве и выраженностью сходства жены и свекрови; обнаруженное позже сходство между мужьями и приемными отцами женщин, а также прямая зависимость между эмоциональной поддержкой со стороны отца и степенью его внешнего сходства с мужем женщины.
Эти тенденции объясняются в рамках парадигмы сексуального импринтинга (англ. sexual imprinting). В соответствии с ней выбор партнера может зависеть не только от генотипа (HLA) и фенотипа (внешних признаков), но и от особенностей формирования привязанности к родителю противоположного пола в раннем детстве. Если семейное окружение в раннем детстве оказывается благоприятным и положительные контакты с родителем поощряются, ребенок создает ментальный шаблон качеств этого родителя и при половом созревании предпочитает тех, кто соответствует этому шаблону. Эмоциональная и физическая дистанция между ребенком и родителем нарушает формирование такого шаблона и препятствует распознанию специфичных для родителя черт в потенциальных партнерах.
Тем не менее логика парадигмы сексуального импринтинга нарушилась при переходе от исследований сходства внешних черт партнеров и родителей участников к сопоставлению их личностных качеств. В частности, жены и свекрови совпадали по шкале добросовестности (сознательности) «пятифакторной модели личности» (англ. Big five), но при этом чем меньше эмоциональной теплоты и больше отвержения мужчины получали от матери в детстве, тем с большей вероятностью они выбирали в качестве супруги женщин, чьи качества по параметрам эмоциональной стабильности были схожи с качествами свекровей. Этот результат противоречит описанной выше прямой зависимости между благоприятными отношениями с родителем в детстве и сходством внешних качеств родителя и супруга. Это противоречие может объясняться тем, что процесс выбора партнера с учетом его личностных качеств является более сложным в сравнении с оценкой внешности. Например, жена мужчины может походить на его мать, с которой у него сформировались негативные отношения в детстве, лишь в рамках ограниченного набора черт личности, но при этом превосходить ее по ряду других — более важных — черт.
Big five), но при этом чем меньше эмоциональной теплоты и больше отвержения мужчины получали от матери в детстве, тем с большей вероятностью они выбирали в качестве супруги женщин, чьи качества по параметрам эмоциональной стабильности были схожи с качествами свекровей. Этот результат противоречит описанной выше прямой зависимости между благоприятными отношениями с родителем в детстве и сходством внешних качеств родителя и супруга. Это противоречие может объясняться тем, что процесс выбора партнера с учетом его личностных качеств является более сложным в сравнении с оценкой внешности. Например, жена мужчины может походить на его мать, с которой у него сформировались негативные отношения в детстве, лишь в рамках ограниченного набора черт личности, но при этом превосходить ее по ряду других — более важных — черт.
Также описываемый результат соответствует фигурирующему в ряде психотерапевтических течений концепту ретравматизации: негативный опыт отношений с родителем может выступать в роли травмы и повторять травмирующее влияние уже в рамках выбора партнера. Казалось бы, травмирующий опыт должен приводить к избеганию образа родителя как источника психологического дискомфорта и боли. Но процессы ретравматизации предполагают непроизвольное повторное воспроизведение травмирующих паттернов в попытках пережить прежний негативный опыт, дать выход незавершенным переживаниям и окончательно преодолеть травму. Зачастую такое воспроизведение формирует порочный круг и может служить индикатором для обращения к специалисту.
Казалось бы, травмирующий опыт должен приводить к избеганию образа родителя как источника психологического дискомфорта и боли. Но процессы ретравматизации предполагают непроизвольное повторное воспроизведение травмирующих паттернов в попытках пережить прежний негативный опыт, дать выход незавершенным переживаниям и окончательно преодолеть травму. Зачастую такое воспроизведение формирует порочный круг и может служить индикатором для обращения к специалисту.
Возвращаясь к генетическим факторам выбора партнера, обратимся к исследованиям уже состоящих в отношениях пар. Часть этих исследований показала, что партнеры разделяют больше общих HLA-аллелей, чем предполагала бы случайность. Другая часть не обнаружила значимых взаимосвязей. И лишь одно исследование установило пониженную частотность идентичных HLA-аллелей среди пар гуттеритов (представителей религиозной общины).
Возникает вопрос: может ли HLA-генотип выступать предиктором не только формирования отношений как таковых, но и качества этих отношений? Одно из исследований показало, что влияние генотипа распространилось не на все возможные компоненты качества отношений, а лишь на несколько показателей сексуальной удовлетворенности женщины (сексуальная отзывчивость (англ. sexual responsiveness), удовлетворенность уровнем собственного возбуждения и сексуальная предприимчивость (англ. sexual adventurousness)). Это влияние подразумевало, что чем больше общих HLA-аллелей обнаруживалось у женщин и их партнеров, тем хуже были эти показатели.
sexual responsiveness), удовлетворенность уровнем собственного возбуждения и сексуальная предприимчивость (англ. sexual adventurousness)). Это влияние подразумевало, что чем больше общих HLA-аллелей обнаруживалось у женщин и их партнеров, тем хуже были эти показатели.
Также чем более схожи были партнеры по HLA-генотипу, тем больше во время фертильного периода цикла женщина находила привлекательными других мужчин, но не собственного партнера. Для мужчин подобные результаты не наблюдались.
Более позднее исследование, в котором впервые было использовано более высокое разрешение анализа HLA-генотипа, показало для представителей обоих полов, что различия в HLA-генотипах партнеров повышали удовлетворенность от партнерства, сексуальную удовлетворенность и желание иметь детей. Предсказуемым образом эти результаты сопровождались и тем, что различные по HLA-генотипу партнеры предпочитали запах друг друга.
Проведенные исследования пока не позволяют вывести однозначный закон, по которому, опираясь на HLA-генотип человека, можно было бы определить для него оптимальных партнеров. Любые категоричные выводы были бы поспешными. Но этих исследований уже достаточно для того, чтобы заметить, что человек проявляет склонность к близким по генотипу партнерам (особенно в контексте долгосрочных отношений), близость которых при этом не нарушает критерий генетического разнообразия. Оба полярных сценария — близкородственное скрещивание и скрещивание с представителями других популяций — обладают своими преимуществами и недостатками, поэтому оптимальный уровень HLA-схожести находится посередине.
Читайте также
Скрепы страха. Как борцы за традиционные ценности изобретают новое прошлое
Генетические факторы могут служить лишь отправной точкой для запуска процессов, обуславливающих выбор партнера. Впрочем, возможно предположить, что их пока еще не достаточно изученное влияние настолько велико, что все те причины, которые мы озвучиваем в попытках объяснить, почему нас привлекает конкретный человек, выглядят как неубедительная рационализация задним числом, словно за этим стоит нечто непреодолимое и большее. Возможно также и то, что произвольные попытки совершить сознательный выбор бессмысленны. Достаточно просто прислушаться к себе и различить того, кто пусть и не будет являться нашей собственной утраченной половиной из известного платоновского мифа, но кого мы никогда не сможем назвать чужим…
Возможно также и то, что произвольные попытки совершить сознательный выбор бессмысленны. Достаточно просто прислушаться к себе и различить того, кто пусть и не будет являться нашей собственной утраченной половиной из известного платоновского мифа, но кого мы никогда не сможем назвать чужим…
генотип | Изучайте науку в Scitable
In
в широком смысле термин «генотип» относится к генетической структуре организма;
другими словами, он описывает полный набор генов организма. В более
В узком смысле этот термин может использоваться для обозначения аллелей или вариантных форм
ген, переносимый организмом. Люди — диплоидные организмы, т.
означает, что у них есть два аллеля в каждой генетической позиции или локусе с одним
аллель, унаследованный от каждого родителя. Каждая пара аллелей представляет генотип
конкретного гена. Например, у растений душистого горошка ген окраски цветков
имеет два аллеля. Один аллель кодирует пурпурные цветы и представлен
заглавная буква F, тогда как вторая кодирует белые цветы и
обозначается строчной буквой f. Разнообразная популяция растений душистого горошка
следовательно, в этом локусе могут присутствовать три возможных генотипа: FF, Ff или ff.
Генотип каждого растения вносит свой вклад в его фенотип, который в данном случае является
внешний вид его цветков. Определенный генотип описывается как
гомозиготным, если он содержит два идентичных аллеля, и гетерозиготным, если два
аллели различаются. Процесс определения генотипа называется генотипированием.
Разнообразная популяция растений душистого горошка
следовательно, в этом локусе могут присутствовать три возможных генотипа: FF, Ff или ff.
Генотип каждого растения вносит свой вклад в его фенотип, который в данном случае является
внешний вид его цветков. Определенный генотип описывается как
гомозиготным, если он содержит два идентичных аллеля, и гетерозиготным, если два
аллели различаются. Процесс определения генотипа называется генотипированием.
Дальнейшее исследование
Концептуальные ссылки для дальнейшего изучения
тестовый крест | ген | аллель | доминирующий | рецессивный | геномика | Равновесие Харди-Вайнберга | поток генов | гаплотип | эволюция | пенетрантность | принцип разделения | принцип независимого ассортимента | дигибридное скрещивание | ДНК | генетический дрейф | геном | генная терапия | фенотип | мозаицизм | Уравнение Харди-Вайнберга | принцип разделения | Принципы наследования
Связанные понятия (23)
Генетика
Клеточная биология
Научная коммуникация
Планирование карьеры
Связь между генотипом и фенотипом — Science Learning Hub
Добавить в коллекцию
Какую роль играют гены в развитии? Как ваш генотип влияет на ваш фенотип? Или, точнее, как гены работают вместе, чтобы произвести РНК, которая кодирует белки, из которых состоят ваши клетки, ткани и органы, что приводит к вашему фенотипу (физическому выражению ваших генов)?
Этот вопрос интересует профессора Питера Дердена, директора отдела генетики Отаго, который считает его одним из самых важных вопросов в биологии.
Фенотип и генотип
Генотип организма определяется как сумма всех его генов. Фенотип организма — это наблюдаемые физические или биохимические характеристики организма, определяемые как генетическими особенностями, так и влиянием окружающей среды.
Проект «Геном человека» повысил значимость исследований генома — к настоящему времени секвенированы геномы более 1000 организмов. Это дало много информации о генах и геномах и позволило исследовать связь между генотипом и фенотипом.
Исследователи обнаружили, что между геномами разных организмов больше сходства, чем различий, и что многие фенотипические различия между организмами обусловлены различиями в том, как их гены включаются и выключаются, а не тем, какие гены у них есть .
Использование моделей насекомых
Эволюция и развитие являются особыми темами исследований, проводимых Питером и его коллегами. Текущая работа сосредоточена на изучении того, как процессы, происходящие во время развития организма, меняются в эволюционных масштабах времени, чтобы дать разные формы одного и того же организма. Одним из ключевых аспектов этого исследования является изучение того, как генотип организма приводит к определенному фенотипу.
Одним из ключевых аспектов этого исследования является изучение того, как генотип организма приводит к определенному фенотипу.
Для проведения этого исследования Питер и его коллеги работают с рядом модельных организмов, включая медоносных пчел ( Apis mellifera ) и плодовых мушек ( Drosophila melanogaster ).
Природа науки
Животные и клеточные модели часто необходимы для изучения сложности человеческого развития и генетики. Биологические пути между моделями животных и людьми не идентичны, но открытия, сделанные с использованием модельного организма, часто позволяют ученым лучше понять развитие человека и болезни. Конкретное направление научного исследования будет информировать модель животного, которую выберет ученый.
Включение и выключение генов
Подход Питера к пониманию роли генов в процессе развития включает в себя включение и выключение генов, чтобы увидеть, как это влияет на фенотип. Тем не менее, этот тип исследования очень сложен!
В 20 -м -м веке D. melanogaster был популярной моделью насекомых для генетических исследовательских проектов. Включение или выключение гена у плодовой мушки — это хорошо отработанный метод, который позволяет ученым определить роль гена в развитии организма. Когда ген отключается химическими или физическими средствами, продукт его гена (белок) не производится, и можно увидеть влияние отсутствия этого белка на развитие. Однако включить или выключить ген в эмбрионе пчелы сложнее.
melanogaster был популярной моделью насекомых для генетических исследовательских проектов. Включение или выключение гена у плодовой мушки — это хорошо отработанный метод, который позволяет ученым определить роль гена в развитии организма. Когда ген отключается химическими или физическими средствами, продукт его гена (белок) не производится, и можно увидеть влияние отсутствия этого белка на развитие. Однако включить или выключить ген в эмбрионе пчелы сложнее.
Недавняя работа Питера была сосредоточена на разработке лабораторных методов отключения генов у медоносных пчел. Модифицируя технику, называемую РНК-интерференцией, они открыли способ отключения генов у эмбриона медоносной пчелы. Теперь они могут перейти к новому этапу исследований, где они могут манипулировать отдельными генами и смотреть, что происходит. Это позволит им сравнить роли, которые разные гены играют в развитии плодовой мушки по сравнению с медоносной пчелой.
Тот же ген, другой результат
Питер и его коллеги обнаружили, что D. melanogaster и A. mellifera имеют почти одинаковые гены, но во многих случаях их работа совершенно различна. Например, у обоих видов есть ген, называемый каудальным. У D. melanogaster он включает ген, называемый гигантским, а у A. mellifera он выключает гигантский. Его роль эволюционировала от включения гена до выключения гена.
melanogaster и A. mellifera имеют почти одинаковые гены, но во многих случаях их работа совершенно различна. Например, у обоих видов есть ген, называемый каудальным. У D. melanogaster он включает ген, называемый гигантским, а у A. mellifera он выключает гигантский. Его роль эволюционировала от включения гена до выключения гена.
Это не уникальная находка сама по себе. Их исследования показывают, что эволюционирует то, как гены влияют друг на друга, а не сами гены. Хотя это исследование все еще развивается, Питер надеется, что их работа внесет значительный вклад в текущее понимание развития и эволюции.
Посмотрите этот видеоклип ниже, в котором лауреат Нобелевской премии сэр Пол Нерс обсуждает влияние проекта «Геном человека» на научные исследования.
Полезные ссылки
Посетите веб-сайт Национального института исследования генома человека, чтобы узнать больше о сравнительной геномике и модельных организмах.
См. Биохимия Отаго: ресурсы для старшеклассников.
Биохимия Отаго: ресурсы для старшеклассников.
Опубликовано 8 июня 2011 г. Статьи Reference Hub
Перейти к полному глоссарию
Добавить 0 элементов в коллекцию
Загрузить 0 элементов
Загрузить все
Генетика человека и проект генома человека. фундаментальные единицы наследственности, а геном — совокупность генов организма. Генотип – это уникальный набор всех генов индивидуального организма. Комплексным образом генотип управляет фенотипом, который представляет собой совокупность всех признаков внешнего вида, функции и поведения организма. В настоящее время известно, что гены представляют собой последовательности дезоксирибонуклеиновой кислоты (ДНК), с которых транскрибируется рибонуклеиновая кислота (РНК). Затем транскрипты большинства, но не всех генов транслируются в белки, состоящие из аминокислотных последовательностей и выполняющие большинство клеточных функций благодаря своей каталитической активности и взаимодействиям, происходящим в их специфических сайтах связывания.
 Следовательно, ген необходим для фенотипического признака, поскольку он кодирует белок, участвующий в формировании признака.
Следовательно, ген необходим для фенотипического признака, поскольку он кодирует белок, участвующий в формировании признака. Точно неизвестно, сколько генов содержится в геноме человека, но оценки варьируются от 61 000 до 140 000 (Dickson 1999; Dunham et al. 1999). Для сравнения, нематода Caenorhabditis elegans имеет 19 000 генов. У человека только 5% ДНК генома фактически кодирует белки. Остальные служат либо регуляторными последовательностями, определяющими условия, при которых будет транскрибироваться ген, либо интронами (последовательности, которые транскрибируются, но не транслируются), либо спейсерной ДНК с еще неизвестной функцией. Каждый ген расположен в определенном месте на хромосоме, и в диплоидной фазе жизненного цикла человека и других метазоа в каждом ядре есть две хромосомы с этим участком гена. Эти две копии гена называются аллелями. Особое значение для этого отчета имеет то, что в ходе эволюции человека возникло множество вариантных аллелей каждого гена, и разные аллели часто придают небольшие или большие различия в некоторых конкретных признаках организма при сравнении членов популяции.
В этой главе комитет описывает области человеческой генетики и геномики. Обсуждается роль молекулярной эпидемиологии в обнаружении токсикантов развития, а также трудности выявления сложных взаимодействий генотип-среда.
ГЕНОТИП, ФЕНОТИП И МНОГОФАКТОРНОЕ НАСЛЕДОВАНИЕ
В своих классических экспериментах середины девятнадцатого века Грегор Мендель (1865) выбрал растение гороха ( Pisum sativum ) для изучения сегрегации и ассортимента частиц, детерминант фенотипа. черты. Ему посчастливилось выбрать несколько признаков, каждый из которых контролировался одним генетическим локусом. Аллели в каждом локусе при наследовании действовали либо доминантно, либо рецессивно, и на их действие не оказывали существенного влияния другие гены или факторы окружающей среды в его условиях тестирования. Следовательно, он наблюдал точные и интерпретируемые математические соотношения фенотипов потомства в каждом селекционном эксперименте. Признаки фенотипа, которые демонстрируют такие легко интерпретируемые модели наследования, называются простыми, или менделевскими, признаками, и они обычно регулируются одним генетическим локусом.
Однако связь между генотипом и фенотипом почти всегда очень сложна. Даже когда ученые рассматривают один конкретный ген и знают его конкретную аллельную форму, его влияние на фенотип часто зависит от одной или обеих двух переменных: (1) различных аллелей различных других основных и модифицирующих генов в геноме организма и (2 ) различные условия окружающей среды. Такие признаки демонстрируют многофакторный тип наследования (также называемый сложным или неменделевским наследованием) и называются сложными признаками или мультиплексными фенотипами (недавний обзор см. в Lander and Schork 19).94). Многофакторное наследование встречается гораздо чаще, чем простое наследование. Такие признаки влекут за собой взаимодействие двух или более генов (полигенный признак). Гены могут вносить вклад в фенотипический признак количественным и аддитивным образом (например, гены A , B и C могут вносить 20 %, 30 % и 50 % соответственно в такой признак, как рождение). масса). Эти гены называются «локусами количественных признаков», и генетические методы анализа их вклада очень эффективны. Аллели 9Например, ген 0119 BRCA1 , по-видимому, вносит около 5% общего риска рака груди (обзор см. в Brody and Bisecker 1998), но несколько других факторов, существование которых считается аналитическим, еще не идентифицированы. . Еще более сложные модели наследования можно проследить до множества генов, действующих неаддитивным образом. Сегрегированные аллели могут быть ни доминантными, ни рецессивными. Наконец, ген может проявлять неполную пенетрантность (только некоторые члены популяции проявляют признак) или переменную экспрессивность (члены популяции различаются по степени выраженности признака) или и то, и другое.
Эти гены называются «локусами количественных признаков», и генетические методы анализа их вклада очень эффективны. Аллели 9Например, ген 0119 BRCA1 , по-видимому, вносит около 5% общего риска рака груди (обзор см. в Brody and Bisecker 1998), но несколько других факторов, существование которых считается аналитическим, еще не идентифицированы. . Еще более сложные модели наследования можно проследить до множества генов, действующих неаддитивным образом. Сегрегированные аллели могут быть ни доминантными, ни рецессивными. Наконец, ген может проявлять неполную пенетрантность (только некоторые члены популяции проявляют признак) или переменную экспрессивность (члены популяции различаются по степени выраженности признака) или и то, и другое.
Другие черты могут быть изменены средой. Такие черты вовсе не необычны и могут пересекаться с полигенными чертами. Исследования на модельных организмах, таких как плодовая муха Drosophila melanogaster , уже давно показали, что влияние гена на признак может быть изменено такими внешними факторами, как температура, химические вещества, питание и скученность. Генетики, особенно интересующиеся эволюцией, утверждают, что взаимодействия генов и окружающей среды настолько распространены и важны, что следует говорить не о «фенотипическом признаке» организма, а о его «норме реакции», представляющей собой набор фенотипов, создаваемых индивидуальный генотип при воздействии различных условий окружающей среды (Stearnes 1989). Связь между генотипом, средой и фенотипом, которую иногда называют взаимодействием ген-среда, можно выразить как
Генетики, особенно интересующиеся эволюцией, утверждают, что взаимодействия генов и окружающей среды настолько распространены и важны, что следует говорить не о «фенотипическом признаке» организма, а о его «норме реакции», представляющей собой набор фенотипов, создаваемых индивидуальный генотип при воздействии различных условий окружающей среды (Stearnes 1989). Связь между генотипом, средой и фенотипом, которую иногда называют взаимодействием ген-среда, можно выразить как
Генотип + среда → фенотип.
Хотя многофакторная наследственность доставляет неудобства генетикам, она описывает большинство наследственных заболеваний человека и практически все предрасположенности. Как упоминалось в главе 2, примерно 25% дефектов развития человека, возможно, являются следствием многофакторного наследования. Известно, что люди и экспериментальные животные неоднородны в своей реакции на лекарства или загрязнители окружающей среды. В настоящее время предпочтительным объяснением является то, что гетерогенность отражает сочетание гетерогенных обстоятельств воздействия (внешние условия) и гетерогенных генотипов восприимчивости (внутренние условия). Примерами воздействия плюс восприимчивость могут быть возраст начала рака легких у курильщиков сигарет или вероятность развития астмы, вызванной городским загрязнением. Взаимосвязь между геном и окружающей средой еще больше запутывается в токсикологии развития из-за необходимости учитывать генотип как матери, так и эмбриона или плода, как и где метаболизируется токсикант, а также стадию развития, на которой токсикант проникает через плаценту. Взаимодействия генов с окружающей средой, очевидно, имеют отношение к областям молекулярной эпидемиологии и токсикологии развития.
Примерами воздействия плюс восприимчивость могут быть возраст начала рака легких у курильщиков сигарет или вероятность развития астмы, вызванной городским загрязнением. Взаимосвязь между геном и окружающей средой еще больше запутывается в токсикологии развития из-за необходимости учитывать генотип как матери, так и эмбриона или плода, как и где метаболизируется токсикант, а также стадию развития, на которой токсикант проникает через плаценту. Взаимодействия генов с окружающей средой, очевидно, имеют отношение к областям молекулярной эпидемиологии и токсикологии развития.
ПОЛИМОРФИЗМЫ
Полиморфизм означает наличие двух или более аллелей определенного гена в популяции организмов; аллель меньшинства присутствует с частотой гена не менее 1% (Hartl and Taubes 1998). Эта частота является несколько произвольным пределом, установленным популяционными генетиками, а аллели меньшинства с еще более низкой частотой называются «редкими аллелями». В соответствии с распределением Харди-Вайнберга (p 2 + 2pq + q 2 ) для двух аллелей в одном локусе, если миноритарная аллель присутствует с частотой гена 1%, она тогда присутствует в гетерозиготной форме в около 2% представителей этой популяции и в гомозиготной форме у 0,01% популяции.
Какой бы ни была частота, аллели в настоящее время определяются самым общим образом, а именно как различные нуклеотидные последовательности одного и того же гена, то есть как изменения одного или нескольких оснований (аденина, тимина, цитозина и гуанина) по отношению к эталонная последовательность оснований ДНК. Однако обнаружение такой разницы само по себе мало что говорит о влиянии на фенотип. Если разница в последовательности возникает в кодирующей области гена, это может повлиять на активность или стабильность белка. Если изменение является синонимичным (т. е. аминокислота не изменена), консервативным или расположенным в области белка, где приемлема любая из нескольких аминокислот, активность или стабильность белка могут не измениться. Если изменение последовательности ДНК происходит в транскрибируемой области гена, но не в кодирующей области, это может повлиять на рамку считывания, сплайсинг, стабильность мРНК, эффективность трансляции или регуляцию транскрипции. Находясь вне области транскрипции гена, изменение все же может повлиять на время, место и уровень экспрессии гена, но не на последовательность белка. Необходимо провести дополнительную работу, чтобы определить влияние конкретного изменения ДНК на функцию или уровень белка.
Необходимо провести дополнительную работу, чтобы определить влияние конкретного изменения ДНК на функцию или уровень белка.
Обычно ожидается, что полиморфизмы, достигающие уровня аллельной частоты 1%, будут иметь избирательно выгодные фенотипические последствия измененной активности или количества белка. Однако вариант может быть представлен ниже уровня 1% или близко к 1%, потому что он возник в небольшой группе организмов-основателей, которые из-за местных случайных обстоятельств размножились до большой популяции по сравнению с другими представителями этого вида. Такой полиморфизм может не влиять на активность или количество белка. Это было бы просто маркером этой линии организмов. Это может даже иметь отрицательный избирательный эффект.
Современные методы секвенирования значительно расширили возможности исследователей по обнаружению аллелей. Для конкретной последовательности генов любые два неродственных человека в популяции, вероятно, будут иметь различия в последовательности. Предполагается, что последовательность гена включает все регуляторные и транскрибируемые области ДНК. Когда впервые возникает изменение основания из-за окислительных ударов, ошибок репликации, индуцированных ультрафиолетом димеров тимина или других форм повреждения ДНК, обычно требуется один раунд синтеза новой ДНК, чтобы «зафиксироваться» в двухцепочечной форме, невосприимчивой к ремонта и считать мутацией. Перед этим синтезом замена основания часто приводит к несоответствию двойной спирали ДНК, и ряд ферментов репарации несоответствия устраняет такие ошибки (Snow 19).97). Однако из каждого миллиона или более участков ДНК, которые повреждаются, ошибка иногда остается неисправленной. Считается, что нерепарированные мутации происходят естественным образом с частотой один раз на 10 6 -10 8 оснований в поколении. Поскольку у людей такой большой геном, за всю жизнь на одного человека накапливается примерно 75 новых мутаций. Большинство из них, вероятно, не являются вредными.
Предполагается, что последовательность гена включает все регуляторные и транскрибируемые области ДНК. Когда впервые возникает изменение основания из-за окислительных ударов, ошибок репликации, индуцированных ультрафиолетом димеров тимина или других форм повреждения ДНК, обычно требуется один раунд синтеза новой ДНК, чтобы «зафиксироваться» в двухцепочечной форме, невосприимчивой к ремонта и считать мутацией. Перед этим синтезом замена основания часто приводит к несоответствию двойной спирали ДНК, и ряд ферментов репарации несоответствия устраняет такие ошибки (Snow 19).97). Однако из каждого миллиона или более участков ДНК, которые повреждаются, ошибка иногда остается неисправленной. Считается, что нерепарированные мутации происходят естественным образом с частотой один раз на 10 6 -10 8 оснований в поколении. Поскольку у людей такой большой геном, за всю жизнь на одного человека накапливается примерно 75 новых мутаций. Большинство из них, вероятно, не являются вредными. Многие из них не встречаются в областях, кодирующих белок (5% последовательности ДНК человека), или, если они встречаются, не меняют конкретную аминокислоту (синонимичные замены). Однако некоторые из них вредны, и частота вредных мутаций у людей (несинонимичные изменения аминокислот, влияющие на активность) недавно оценивалась как минимум 1,6 новых вредных мутаций на диплоидный геном на поколение. Авторы приходят к выводу, что этот уровень «близок к верхнему уровню, допустимому для таких видов, как люди, которые имеют низкую репродуктивную способность» (Эйр-Уокер и Кейтли 19).99). Вполне вероятно, что человеческая популяция полна генетических вариаций, и эти вариации необходимо учитывать и оценивать при любой оценке индивидуальной восприимчивости к токсикантам, связанным с развитием.
Многие из них не встречаются в областях, кодирующих белок (5% последовательности ДНК человека), или, если они встречаются, не меняют конкретную аминокислоту (синонимичные замены). Однако некоторые из них вредны, и частота вредных мутаций у людей (несинонимичные изменения аминокислот, влияющие на активность) недавно оценивалась как минимум 1,6 новых вредных мутаций на диплоидный геном на поколение. Авторы приходят к выводу, что этот уровень «близок к верхнему уровню, допустимому для таких видов, как люди, которые имеют низкую репродуктивную способность» (Эйр-Уокер и Кейтли 19).99). Вполне вероятно, что человеческая популяция полна генетических вариаций, и эти вариации необходимо учитывать и оценивать при любой оценке индивидуальной восприимчивости к токсикантам, связанным с развитием.
ПРОЕКТ «ГЕНОМ ЧЕЛОВЕКА»
Геном организма представляет собой все генетическое содержимое организма или, в более широком смысле, это все содержимое ДНК организма, включая нетранскрибируемые, не- цис-регуляторные области ДНК, такие как центромеры и теломеры. Изучение геномов организмов, которое называется геномикой, включает области исследований, определяющие генетические и физические карты геномов, последовательности ДНК геномов, функции генов и белков, цис — регуляторные элементы генов, а также время, место и условия экспрессии генов. Важной частью геномики стало управление огромным объемом собранной информации (область, именуемая биоинформатикой) и анализ данных в отношении, например, аспектов организации генома, сравнения геномов разных организмов и глобальные закономерности экспрессии генов.
Изучение геномов организмов, которое называется геномикой, включает области исследований, определяющие генетические и физические карты геномов, последовательности ДНК геномов, функции генов и белков, цис — регуляторные элементы генов, а также время, место и условия экспрессии генов. Важной частью геномики стало управление огромным объемом собранной информации (область, именуемая биоинформатикой) и анализ данных в отношении, например, аспектов организации генома, сравнения геномов разных организмов и глобальные закономерности экспрессии генов.
Проект «Геном человека» (HGP) стартовал 19 октября.90 Национальных институтов здравоохранения (NIH) в качестве инициативы, финансируемой из федерального бюджета. Непосредственной целью тогда, как и сейчас, было завершение точного секвенирования примерно 3,5 миллиардов пар оснований ДНК человека (гаплоидное количество) к концу 2003 г. (Ф. С. Коллинз и др., 1998). В середине 2000 г. был завершен «грубый набросок последовательности», включающий примерно 90% генома человека (www. ornl.gov/hgmis/project/progress.html). В более долгосрочной перспективе цель состоит в том, чтобы идентифицировать все человеческие гены. Идентификация затруднена. В таком организме, как дрожжи, который подходит для идентификации генов с помощью мутационно-генетического анализа, более половины генов оставались незамеченными до тех пор, пока не стала доступной последовательность генома (Браун и Ботштейн 19).99). Отсутствие обнаружения было частично связано с большими избыточными областями генома дрожжей. У позвоночных мутационный генетический анализ намного сложнее, и избыточность может быть более распространенной. Таким образом, первоначальная идентификация гена путем секвенирования является предпочтительным подходом. Ген первоначально идентифицируется как открытая рамка считывания (ORF), которую можно различить непосредственно, глядя на последовательность, или он первоначально идентифицируется как сайт экспрессируемой метки последовательности (EST), последовательность, комплементарная известному фрагменту транскрибируемой РНК.
ornl.gov/hgmis/project/progress.html). В более долгосрочной перспективе цель состоит в том, чтобы идентифицировать все человеческие гены. Идентификация затруднена. В таком организме, как дрожжи, который подходит для идентификации генов с помощью мутационно-генетического анализа, более половины генов оставались незамеченными до тех пор, пока не стала доступной последовательность генома (Браун и Ботштейн 19).99). Отсутствие обнаружения было частично связано с большими избыточными областями генома дрожжей. У позвоночных мутационный генетический анализ намного сложнее, и избыточность может быть более распространенной. Таким образом, первоначальная идентификация гена путем секвенирования является предпочтительным подходом. Ген первоначально идентифицируется как открытая рамка считывания (ORF), которую можно различить непосредственно, глядя на последовательность, или он первоначально идентифицируется как сайт экспрессируемой метки последовательности (EST), последовательность, комплементарная известному фрагменту транскрибируемой РНК. (Смотри ниже). После этого цель состоит в том, чтобы идентифицировать каждый ген как последовательность, кодирующую полноразмерную РНК и белок с известной функцией. Функции нетранскрибируемых областей, таких как многочисленные большие цис -регуляторные области, устанавливающие условия для экспрессии генов, также должны быть выяснены. Эта задача еще более сложна, поскольку в настоящее время используется ряд подходов, в том числе конструирование линий трансгенных животных, несущих части регуляторной области в сочетании с репортерным геном (например, зеленый флуоресцентный белок, GFP).
(Смотри ниже). После этого цель состоит в том, чтобы идентифицировать каждый ген как последовательность, кодирующую полноразмерную РНК и белок с известной функцией. Функции нетранскрибируемых областей, таких как многочисленные большие цис -регуляторные области, устанавливающие условия для экспрессии генов, также должны быть выяснены. Эта задача еще более сложна, поскольку в настоящее время используется ряд подходов, в том числе конструирование линий трансгенных животных, несущих части регуляторной области в сочетании с репортерным геном (например, зеленый флуоресцентный белок, GFP).
Функциональный анализ генома с точки зрения времени и места экспрессии генов и функций продуктов генов иногда называют «функциональной геномикой» или даже «постгеномикой». Анализ функции белка может быть простым, если последовательность белка напоминает последовательность другого хорошо изученного белка, и может быть трудным, если мотивы последовательности отсутствуют. Анализ белкового состава организма (называемого «протеом») и функции иногда называют «протеомикой». Целевые области HGP в настоящее время включают генетическое и физическое картирование генома человека, секвенирование ДНК, анализ геномов многочисленных важных нечеловеческих организмов, информатику для обработки огромного увеличения скорости генерируемой информации, развитие ресурсов и технологий, а также этические вопросы. юридические и социальные последствия (ELSI) генетических исследований для отдельных лиц и общества (F.S. Collins et al. 19).98).
Целевые области HGP в настоящее время включают генетическое и физическое картирование генома человека, секвенирование ДНК, анализ геномов многочисленных важных нечеловеческих организмов, информатику для обработки огромного увеличения скорости генерируемой информации, развитие ресурсов и технологий, а также этические вопросы. юридические и социальные последствия (ELSI) генетических исследований для отдельных лиц и общества (F.S. Collins et al. 19).98).
HGP поддерживается NIH и Министерством энергетики США (DOE) в 22 специализированных центрах исследования генома в США и во многих университетских, национальных и частных лабораториях. В NIH название было изменено на Национальный центр исследований генома человека в 1993 году, а с конца 1996 года он стал Национальным институтом исследования генома человека (NHGRI). По крайней мере, в 14 других странах также есть программы анализа геномов различных организмов — от микробов и экономически важных растений и животных до человека.
Взрыв геномной информации произошел раньше, чем могли бы предсказать самые смелые ученые. Вслед за первой полной последовательностью генома Haemophilus influenzae в 1995 г. в течение следующих 18 месяцев были завершены еще семь геномов, а именно еще четыре генома эубактерий, два генома архебактерий и один геном одноклеточного эукариот — геном дрожжей Saccharomyces. cerevisiae . В декабре 1998 года геном первого многоклеточного эукариота, Caenorhabditis elegans , был завершен (100 тысяч оснований последовательности ДНК и 19 000 генов, идентифицированных как минимум как ORF). По состоянию на конец 1999 г. было частично идентифицировано, локализовано и секвенировано более 30 000 генов человека. Человеческая хромосома 22 была секвенирована и, по прогнозам, содержит не менее 679 генов (Dunham et al., 1999). У мыши описано не менее 14 000 генов. Последовательность плодовой мухи ( Drosophila melanogaster ) была завершена в 1999 г. (Adams et al. 2000). В середине 2000 года был завершен примерный («рабочий проект») последовательности человека. К 2003 г.
Вслед за первой полной последовательностью генома Haemophilus influenzae в 1995 г. в течение следующих 18 месяцев были завершены еще семь геномов, а именно еще четыре генома эубактерий, два генома архебактерий и один геном одноклеточного эукариот — геном дрожжей Saccharomyces. cerevisiae . В декабре 1998 года геном первого многоклеточного эукариота, Caenorhabditis elegans , был завершен (100 тысяч оснований последовательности ДНК и 19 000 генов, идентифицированных как минимум как ORF). По состоянию на конец 1999 г. было частично идентифицировано, локализовано и секвенировано более 30 000 генов человека. Человеческая хромосома 22 была секвенирована и, по прогнозам, содержит не менее 679 генов (Dunham et al., 1999). У мыши описано не менее 14 000 генов. Последовательность плодовой мухи ( Drosophila melanogaster ) была завершена в 1999 г. (Adams et al. 2000). В середине 2000 года был завершен примерный («рабочий проект») последовательности человека. К 2003 г. будут секвенированы многочисленные нечеловеческие геномы, в том числе мышиный Mus musculus , данио Danio rerio , тутовый шелкопряд Bombyx mori , крыса, собака, кошка, курица, рис, кукуруза, пшеница, ячмень, хлопок, растение Arabidopsis thaliana , а также, возможно, корова , овца, свинья и лошадь. Секвенирование генома мыши идет с опережением графика.
будут секвенированы многочисленные нечеловеческие геномы, в том числе мышиный Mus musculus , данио Danio rerio , тутовый шелкопряд Bombyx mori , крыса, собака, кошка, курица, рис, кукуруза, пшеница, ячмень, хлопок, растение Arabidopsis thaliana , а также, возможно, корова , овца, свинья и лошадь. Секвенирование генома мыши идет с опережением графика.
Новые технологии, ресурсы и приложения становятся все более доступными для исследователей во многих различных научных областях, включая исследования рака, открытие лекарств, медицинскую генетику и генетику окружающей среды, и их доступность также должна ускорить многочисленные крупные достижения в области токсикологии развития в следующем году. десятилетие, как будет рассмотрено далее в этой главе.
Функциональная геномика и технология микрочипов
С самого начала ожидалось, что завершение секвенирования генома человека станет лишь первым шагом в HGP. Информация о последовательности и расположении генов в геноме значительно облегчит дальнейшие исследования не только генетической изменчивости человека, но и функциональной геномики. Как отмечалось выше, последний представляет собой всесторонний анализ экспрессии генов и функций генных продуктов. В случае дрожжей и C. elegans , для которых уже известна полная последовательность генома, в настоящее время осуществляются проекты по систематической оценке функции каждого продукта гена, например, путем выключения генов дрожжей (вызывая потерю функции) по одному и путем ассоциирование идентифицированной матричной (m) РНК с каждой ORF.
Как отмечалось выше, последний представляет собой всесторонний анализ экспрессии генов и функций генных продуктов. В случае дрожжей и C. elegans , для которых уже известна полная последовательность генома, в настоящее время осуществляются проекты по систематической оценке функции каждого продукта гена, например, путем выключения генов дрожжей (вызывая потерю функции) по одному и путем ассоциирование идентифицированной матричной (m) РНК с каждой ORF.
Часть этого функционального анализа может быть продолжена даже до секвенирования генома. В случае людей изучение ЭСТ было важным этапом такого анализа. мРНК можно выделить из организма и преобразовать в комплементарные (в) ДНК с помощью обратной транскрипции (ОТ) и полимеразной цепной реакции (ПЦР). Затем кДНК клонируют и секвенируют для получения большой и четко определенной библиотеки EST. Информация заносится в базу данных. Эти последовательности представляют собой гены, экспрессированные у человека. Например, в настоящее время доступно более 1 миллиона EST человека, представляющих более 50 000 генов. Каждый EST отражает фрагмент мРНК, а не полноразмерную последовательность. Наиболее полные библиотеки готовятся из широкого спектра тканей и периодов развития, чтобы включить все экспрессированные гены. (К сожалению для специалистов по токсикологии развития, хотя первоначальными источниками РНК была плацента, они были недостаточно представлены в различных тканях раннего эмбриона). считается, что последовательность генома человека обнаруживается в обработанных последовательностях мРНК). Появились новые методы получения полноразмерных кДНК из транскриптов, и они будут более полезными, чем фрагменты.
Каждый EST отражает фрагмент мРНК, а не полноразмерную последовательность. Наиболее полные библиотеки готовятся из широкого спектра тканей и периодов развития, чтобы включить все экспрессированные гены. (К сожалению для специалистов по токсикологии развития, хотя первоначальными источниками РНК была плацента, они были недостаточно представлены в различных тканях раннего эмбриона). считается, что последовательность генома человека обнаруживается в обработанных последовательностях мРНК). Появились новые методы получения полноразмерных кДНК из транскриптов, и они будут более полезными, чем фрагменты.
Следующим этапом анализа функции генома является определение времени, места и условий экспрессии каждого гена. До недавнего времени этот анализ проводился по одному гену за раз. Методы ДНК-микрочипов недавно сделали возможным описание одновременных изменений тысяч генов по мере развития клеток и тканей или различных изменений условий окружающей среды. При изучении действия токсикантов на организм анализ иногда называют «токсигеномикой» или, при изучении действия лекарственных средств, «фармакогеномикой». Подходы с ДНК-микрочипами получают широкое распространение (см. Nuwaysir et al. 19).99 для обсуждения его использования в токсикологии).
Подходы с ДНК-микрочипами получают широкое распространение (см. Nuwaysir et al. 19).99 для обсуждения его использования в токсикологии).
Технология теперь подходит для одновременного сравнения количества тысяч видов мРНК в двух образцах тканей или клеток (например, нормальная контрольная ткань по сравнению с тканью, обработанной тератогенным агентом). Для сравнения тысячи различных последовательностей ДНК (например, каждая представляет собой олигомер из не менее 25 нуклеотидов) автоматически наносятся на микропрепарат, и каждая последовательность помещается в известное место для создания ДНК-микрочипа. ДНК прилипает к стеклу, и каждое пятно ДНК обычно имеет диаметр 20 микрометров (м). Например, микроматрицы из 6200 последовательностей кДНК, представляющих все гены дрожжей, помещаются на одном или нескольких предметных стеклах, и 8,900 последовательностей кДНК, представляющих около 10% генов человека (в основном последовательности EST), были нанесены на несколько предметных стекол (Iyer et al. 1999). Стоимость и время изготовления таких слайдов достаточно скромны, чтобы можно было приготовить около сотни, каждый из которых служит для анализа одного условия сравнения (например, анализа нескольких моментов времени и условий концентрации). Каждый слайд представляет собой массив «зондов» ДНК, с помощью которых можно одновременно визуализировать количество тысяч видов мРНК в клетках, тканях или эмбрионах в любое время и при любых условиях.
1999). Стоимость и время изготовления таких слайдов достаточно скромны, чтобы можно было приготовить около сотни, каждый из которых служит для анализа одного условия сравнения (например, анализа нескольких моментов времени и условий концентрации). Каждый слайд представляет собой массив «зондов» ДНК, с помощью которых можно одновременно визуализировать количество тысяч видов мРНК в клетках, тканях или эмбрионах в любое время и при любых условиях.
В процедуре Brown and Botstein (1999) образцы тканей для сравнения извлекаются отдельно, а мРНК метятся различными молекулами флуоресцентного красителя, скажем, зеленым для контроля и красным для обработанной ткани (см. ). Затем РНК смешивают и добавляют к предметному стеклу микрочипа (в их случае, содержащем 8900 последовательностей ДНК человека) в условиях, подходящих для гибридизации РНК-ДНК, а затем промывают для удаления несвязанной РНК. Затем слайд просматривают во флуоресцентном микроскопе, чтобы увидеть, связывает ли каждое конкретное пятно ДНК больше зеленого или рРНК. Соотношение красного и зеленого говорит о том, экспрессируется ли конкретный ген больше или меньше, чем обычно, в условиях лечения. Желтый виден, когда гибридизуются одинаковые красные и зеленые мРНК. Недавно этот метод был применен к клеткам человека, культивируемым в присутствии или в отсутствие сыворотки. Действительно, сотни генов изменили экспрессию, в том числе многие гены, кодирующие связанные со стрессом белки, наблюдаемые при заживлении ран (Iyer et al. 19).98), факт, ранее не осознанный в годы изучения сывороточного ответа культивируемых клеток. Этот метод также применялся к дрожжевым клеткам, проходящим путь спорообразования (Chu et al. 1998), дрожжевым клеткам, проходящим клеточный цикл (Spellman et al. 1998), и дрожжевым клеткам в гаплоидном, диплоидном или тетраплоидном состоянии ( Галицкий и др., 1999). Недавно он был использован для обнаружения ответа одного вида клеток на два сигнальных лиганда, каждый из которых действует через разные рецепторные тирозинкиназы (Fambrough et al.
Соотношение красного и зеленого говорит о том, экспрессируется ли конкретный ген больше или меньше, чем обычно, в условиях лечения. Желтый виден, когда гибридизуются одинаковые красные и зеленые мРНК. Недавно этот метод был применен к клеткам человека, культивируемым в присутствии или в отсутствие сыворотки. Действительно, сотни генов изменили экспрессию, в том числе многие гены, кодирующие связанные со стрессом белки, наблюдаемые при заживлении ран (Iyer et al. 19).98), факт, ранее не осознанный в годы изучения сывороточного ответа культивируемых клеток. Этот метод также применялся к дрожжевым клеткам, проходящим путь спорообразования (Chu et al. 1998), дрожжевым клеткам, проходящим клеточный цикл (Spellman et al. 1998), и дрожжевым клеткам в гаплоидном, диплоидном или тетраплоидном состоянии ( Галицкий и др., 1999). Недавно он был использован для обнаружения ответа одного вида клеток на два сигнальных лиганда, каждый из которых действует через разные рецепторные тирозинкиназы (Fambrough et al. 19).99). Во всех случаях экспрессия сотен генов изменилась. Просмотр глобальных паттернов показывает, что каждый ген, по-видимому, не ведет себя индивидуально; вместо этого, по-видимому, при различных условиях происходит согласованная экспрессия больших наборов генов. Эти результаты подтверждают ценность анализа глобальных паттернов экспрессии генов. Предыдущие исследования отдельных генов могли упустить крупномасштабные закономерности. Однако многое еще предстоит сделать в интерпретации многообразных изменений экспрессии генов. Как упоминалось выше, сотни изменений экспрессии генов наблюдаются даже при кажущихся скромными изменениях условий клетки, таких как ее плоидность.
19).99). Во всех случаях экспрессия сотен генов изменилась. Просмотр глобальных паттернов показывает, что каждый ген, по-видимому, не ведет себя индивидуально; вместо этого, по-видимому, при различных условиях происходит согласованная экспрессия больших наборов генов. Эти результаты подтверждают ценность анализа глобальных паттернов экспрессии генов. Предыдущие исследования отдельных генов могли упустить крупномасштабные закономерности. Однако многое еще предстоит сделать в интерпретации многообразных изменений экспрессии генов. Как упоминалось выше, сотни изменений экспрессии генов наблюдаются даже при кажущихся скромными изменениях условий клетки, таких как ее плоидность.
РИСУНОК 5-1
ДНК-микрочипы как средство одновременного определения количества тысяч видов мРНК в клетке или ткани. Как показано в левом верхнем углу, мРНК получают отдельно из двух типов клеток, таких как нормальные и опухолевые, и каждая мРНК преобразуется (подробнее…)
При анализе токсического действия ожидается, что клетки или организмы можно было бы лечить токсикантами с неизвестным механизмом действия, а изменения экспрессии генов можно было бы профилировать методом ДНК-микрочипов. Если бы было достаточно известно о функции и взаимодействии белков, кодируемых генами, подвергающимися изменениям экспрессии, можно было бы сделать обоснованные выводы о механизме действия токсиканта. Ожидается, что в будущем методы ДНК-микрочипов позволят быстро и подробно охарактеризовать реакцию клетки или организма на токсикант. По мере сбора дополнительной информации различные токсиканты могут быть сгруппированы по сходству их действия, а анализ действия токсикантов может проводиться на более систематической основе. Метод ДНК-микрочипа уже используется для сравнения нормальных и раковых клеток. В этом случае также исследуются многие вопросы интерпретации различий в экспрессии генов.
Если бы было достаточно известно о функции и взаимодействии белков, кодируемых генами, подвергающимися изменениям экспрессии, можно было бы сделать обоснованные выводы о механизме действия токсиканта. Ожидается, что в будущем методы ДНК-микрочипов позволят быстро и подробно охарактеризовать реакцию клетки или организма на токсикант. По мере сбора дополнительной информации различные токсиканты могут быть сгруппированы по сходству их действия, а анализ действия токсикантов может проводиться на более систематической основе. Метод ДНК-микрочипа уже используется для сравнения нормальных и раковых клеток. В этом случае также исследуются многие вопросы интерпретации различий в экспрессии генов.
Хотя предпочтительно иметь большой набор клонированных и секвенированных ДНК (представляющих различные идентифицированные гены) для микрочипа, как в случае с дрожжами, это не обязательно. EST уже были полезны для исследований на людях и мышах, как в упомянутом выше исследовании сыворотки (Iyer et al. 1999). Если обнаружится, что экспрессия конкретной последовательности, известной только по ее EST, сильно меняется в тестовых условиях, она может считаться достаточно интересной, чтобы заслуживать полноразмерного клонирования, секвенирования и дальнейшего анализа функции.
1999). Если обнаружится, что экспрессия конкретной последовательности, известной только по ее EST, сильно меняется в тестовых условиях, она может считаться достаточно интересной, чтобы заслуживать полноразмерного клонирования, секвенирования и дальнейшего анализа функции.
При таких сравнениях накапливается огромное количество данных (например, когда 6200 генов дрожжей (весь геном дрожжей) или 8900 последовательностей человека экспрессируются по-разному при различных условиях в разные моменты времени). Многомерные наборы данных поставили перед прикладными математиками задачу найти средства для их выражения способами, полезными для биологов (например, см. методы двумерного кластерного анализа в Eisen et al., 1998; Alon et al., 1999; Tamayo et al., 1999). . Тем не менее, на горизонте маячат более крупные наборы данных (например, экспрессия, возможно, 100 000 генов мыши или человека во все времена и в разных местах развития, не говоря уже о воздействии различных токсикантов). Как описано ниже, спрос на менеджеров и аналитиков этих наборов данных велик.
Несмотря на то, что различные методы микрочипов обещают раскрыть новую интересную информацию о том, где, когда и при каких условиях транскрибируются гены генома, этот подход не даст информации о трансляции и посттрансляционной модификации белков, кодируемых этими мРНК. — то есть информация о том, когда и где белки присутствуют и активны. Функция белка почти всегда является непосредственной причиной функции клетки. Предоставление такой функциональной информации является целью протеомики. Определена протеомика (Андерсон и Андерсон 1998) как «использование количественных измерений экспрессии генов на уровне белка для характеристики биологических процессов (например, патологических процессов и эффектов лекарств) и расшифровки механизмов контроля экспрессии генов». В основе протеомики лежит белковый индекс человека, т. е. систематическая идентификация всех белков человека (Андерсон и Андерсон, 1982) с использованием высокопроизводительного двухмерного (2D) гель-электрофореза с высоким разрешением для получения геля с на ней до 1000 отдельных белковых пятен. Большой объем информации о 2D-гелях хранится в базе данных Proteomics (адрес в Интернете см. в Приложении B). Планируется идентифицировать каждое пятно белка на 2D-геле, потому что нанограмм белка в пятне достаточен для определения частичной аминокислотной последовательности с помощью тандемной масс-спектрометрии (Yates 19).98). Затем частичную последовательность можно найти в базе данных генома и идентифицировать белок. Когда белки модифицируются фосфорилированием, ацилированием, гликозилированием, фарнезилированием, ограниченным протеолизом или любым из других 30 или около того ковалентных посттрансляционных изменений, их миграция в 2D-геле изменяется, что позволяет установить корреляцию с их активностью или бездействием. в ткани. Такая информация об активности не может быть получена из измерений количества мРНК ДНК-микрочипом.
Большой объем информации о 2D-гелях хранится в базе данных Proteomics (адрес в Интернете см. в Приложении B). Планируется идентифицировать каждое пятно белка на 2D-геле, потому что нанограмм белка в пятне достаточен для определения частичной аминокислотной последовательности с помощью тандемной масс-спектрометрии (Yates 19).98). Затем частичную последовательность можно найти в базе данных генома и идентифицировать белок. Когда белки модифицируются фосфорилированием, ацилированием, гликозилированием, фарнезилированием, ограниченным протеолизом или любым из других 30 или около того ковалентных посттрансляционных изменений, их миграция в 2D-геле изменяется, что позволяет установить корреляцию с их активностью или бездействием. в ткани. Такая информация об активности не может быть получена из измерений количества мРНК ДНК-микрочипом.
Наконец, многие белки должны ассоциироваться с другими белками для достижения активности, и существуют различные неденатурирующие методы гель-электрофореза для обнаружения таких ассоциаций. Можно ожидать, что текущие и будущие усилия приведут к новым технологическим достижениям в области анализа белков и их функций. В токсикологии развития сочетание геномики и протеомики дает возможность оценить токсиканты развития не только по их способности изменять экспрессию генов, но и по их способности изменять функцию белков.
Можно ожидать, что текущие и будущие усилия приведут к новым технологическим достижениям в области анализа белков и их функций. В токсикологии развития сочетание геномики и протеомики дает возможность оценить токсиканты развития не только по их способности изменять экспрессию генов, но и по их способности изменять функцию белков.
Применение геномных технологий
Недавно исследователи использовали геномные технологии для идентификации и секвенирования генов, играющих роль в этиологии заболеваний. Вполне вероятно, что в ближайшем будущем эти геномные технологии будут применяться для изучения влияния химических веществ на развитие. Уже существуют две модели, демонстрирующие применение новых геномных технологий: Проект анатомии генома рака (CGAP), который начался в 1997 году и находится в ведении Национального института рака, и Проект генома окружающей среды (EGP), который начался в 1997 году.98 и находится в ведении Национального института наук об окружающей среде.
Целью CGAP является предоставление полного каталога всех генов, экспрессия которых изменяется в раковых клетках по сравнению с нормальными клетками для всех типов рака (Pennisi 1997). В прошлом основным препятствием для анализа раковых клеток была смесь типов клеток (нормальных и раковых), присутствующих в типичной опухоли. Трудно получить точную картину экспрессии генов в раковых клетках, если РНК, выделенная из всей опухоли, включает последовательности из многих различных типов клеток. Используя недавно разработанные методы, исследователи CGAP минимизируют эту проблему путем микроскопического отбора небольшой однородной группы клеток, нормальных, предраковых или злокачественных (Emmert-Buck et al. 19).96; Симоне и др. 1998), которые затем изолируются путем приклеивания их к специальной чувствительной к лазерному излучению пленке. Затем последовательности РНК экстрагируют из выделенных клеток и амплифицируют с помощью ОТ-ПЦР для создания библиотек кДНК (Peterson et al. 1998). Для получения широкого представления мРНК потребовалось около 5000 клеток гомогенной морфологии. Всего лишь 500 клеток необходимы для получения кДНК многочисленных видов мРНК. Такие библиотеки будут важными инструментами для описания прогрессирования рака и предоставления диагностических маркеров заболевания.
В прошлом основным препятствием для анализа раковых клеток была смесь типов клеток (нормальных и раковых), присутствующих в типичной опухоли. Трудно получить точную картину экспрессии генов в раковых клетках, если РНК, выделенная из всей опухоли, включает последовательности из многих различных типов клеток. Используя недавно разработанные методы, исследователи CGAP минимизируют эту проблему путем микроскопического отбора небольшой однородной группы клеток, нормальных, предраковых или злокачественных (Emmert-Buck et al. 19).96; Симоне и др. 1998), которые затем изолируются путем приклеивания их к специальной чувствительной к лазерному излучению пленке. Затем последовательности РНК экстрагируют из выделенных клеток и амплифицируют с помощью ОТ-ПЦР для создания библиотек кДНК (Peterson et al. 1998). Для получения широкого представления мРНК потребовалось около 5000 клеток гомогенной морфологии. Всего лишь 500 клеток необходимы для получения кДНК многочисленных видов мРНК. Такие библиотеки будут важными инструментами для описания прогрессирования рака и предоставления диагностических маркеров заболевания. Они также предоставляют последовательности для функционального анализа с помощью ДНК-микрочипов. По мере получения данных они вводятся на веб-сайте CGAP для быстрого доступа и использования другими исследователями, а также для интеграции с другими данными в большом хранилище.
Они также предоставляют последовательности для функционального анализа с помощью ДНК-микрочипов. По мере получения данных они вводятся на веб-сайте CGAP для быстрого доступа и использования другими исследователями, а также для интеграции с другими данными в большом хранилище.
Ожидается, что новые технологии сократят минимальное количество необходимых клеток до 1000 или менее и по-прежнему будут обеспечивать широкое представительство РНК. Чем ниже минимальное количество требуемых клеток, тем лучше для будущих токсикологических исследований развития, потому что многие типы развивающихся клеток присутствуют в небольшом количестве во время эмбриогенеза и развития плода.
Целью EGP является изучение взаимодействия между генетической предрасположенностью, воздействием окружающей среды и заболеванием. В частности, исследователи, работающие над этим 5-летним проектом, пытаются идентифицировать аллельные варианты (т. е. полиморфизмы) 200 генов, важных для экологических заболеваний, разработать централизованную базу данных полиморфизмов для этих генов и способствовать эпидемиологическим исследованиям взаимодействия генов с окружающей средой. в этиологии болезни. Как будет показано далее в этой главе, особенно убедительны доказательства повышенной химической чувствительности у лиц с полиморфизмом генов, кодирующих ферменты, метаболизирующие лекарственные средства (DME). EGP использует геномные технологии, такие как высокопроизводительный анализ последовательностей, разработанный для HGP, который облегчит эпидемиологические исследования взаимодействия генов и окружающей среды при заболеваниях.
в этиологии болезни. Как будет показано далее в этой главе, особенно убедительны доказательства повышенной химической чувствительности у лиц с полиморфизмом генов, кодирующих ферменты, метаболизирующие лекарственные средства (DME). EGP использует геномные технологии, такие как высокопроизводительный анализ последовательностей, разработанный для HGP, который облегчит эпидемиологические исследования взаимодействия генов и окружающей среды при заболеваниях.
Ожидается, что тип геномных технологий, используемых в CGAP и EGP, и многие из самих данных окажут огромное влияние на будущие исследования в области токсикологии развития. В идеале токсикология развития, аналог таких программ, как CGAP и EGP, должна быть сосредоточена на получении данных об экспрессии генов в любое время и во всех тканях во время нормального развития. Затем можно было бы провести сравнения между эмбрионами и плодами беременных контрольных (нормальных) животных и беременных обработанных животных, чтобы найти различия в экспрессии генов. Изменения могут быть идентифицированы в экспрессии генов, кодирующих белки, которые, как известно, участвуют в клеточной передаче сигналов, регуляции транскрипции, клеточном делении, клеточной подвижности, клеточной адгезии, апоптозе, дифференцировке, метаболизме, репарации, балансе электролитов, гомеостазе или транспорте. Такие исследования помогут выяснить механизмы, с помощью которых внешние химические вещества (потенциальные токсиканты для развития) действуют как агонисты или антагонисты опосредованных рецепторами и ферментами субклеточных процессов во время эмбриогенеза и развития плода. Такие исследования станут основной силой в объединении областей биологии развития, геномики и токсикологии развития.
Изменения могут быть идентифицированы в экспрессии генов, кодирующих белки, которые, как известно, участвуют в клеточной передаче сигналов, регуляции транскрипции, клеточном делении, клеточной подвижности, клеточной адгезии, апоптозе, дифференцировке, метаболизме, репарации, балансе электролитов, гомеостазе или транспорте. Такие исследования помогут выяснить механизмы, с помощью которых внешние химические вещества (потенциальные токсиканты для развития) действуют как агонисты или антагонисты опосредованных рецепторами и ферментами субклеточных процессов во время эмбриогенеза и развития плода. Такие исследования станут основной силой в объединении областей биологии развития, геномики и токсикологии развития.
Управление последовательностями генома и данными функциональной геномики
Взрыв молекулярной биологии за последние два десятилетия привел к огромному прогрессу в секвенировании ДНК, что, в свою очередь, привело к все более быстрой идентификации генов как ORF и сайтов EST и идентификация функции генных продуктов по мотивам последовательности (например, гомеодомены, домены цинковых пальцев, домены киназы и домены Sh3 и Sh4). Существует четыре основных базы данных нуклеотидных последовательностей: GenBank и База данных геномных последовательностей (GSDB) в США, Европейская библиотека молекулярной биологии (EMBL) и Банк данных ДНК Японии (DDBJ). Все группы обмениваются новыми и обновленными последовательностями в электронном виде и обычно в тот же день подачи.
Существует четыре основных базы данных нуклеотидных последовательностей: GenBank и База данных геномных последовательностей (GSDB) в США, Европейская библиотека молекулярной биологии (EMBL) и Банк данных ДНК Японии (DDBJ). Все группы обмениваются новыми и обновленными последовательностями в электронном виде и обычно в тот же день подачи.
История этих баз данных насчитывает два десятилетия. Целью Лос-Аламосской библиотеки последовательностей в 1979 году в Лос-Аламосской национальной лаборатории (LANL), спонсируемой Министерством энергетики (DOE), было хранение данных о последовательностях ДНК в электронной форме. В том же году аналогичная база данных была создана в EMBL в Гейдельберге. В 1982 г. было решено, что любые данные, представленные или введенные одной группой, будут немедленно переданы другой, что позволит избежать дублирования усилий. В 1982 году база данных LANL стала GenBank, когда Bolt, Beranek and Newman (BBN) стали основным подрядчиком по распространению данных и поддержки пользователей, а LANL стала субподрядчиком BBN. Работа с данными о последовательностях в BBN и LANL спонсировалась Национальным институтом общих медицинских наук (NIGMS), а также Министерством энергетики и другими агентствами. По истечении первого 5-летнего контракта IntelliGenetics стала основным подрядчиком, а LANL снова стала субподрядчиком, отвечающим за проектирование и создание базы данных. 19 октября92, по окончании второго 5-летнего контракта NIGMS передала GenBank Национальному центру биотехнологической информации (NCBI) в Национальной медицинской библиотеке. В августе 1993 года ресурсы баз данных LANL и NCBI стали независимыми друг от друга. GenBank остался в NCBI, а LANL взяла новое название База данных последовательностей генома (GSDB) и переехала в Национальный центр ресурсов генома (NCGR) в Санта-Фе, штат Нью-Мексико. База данных нуклеотидных последовательностей EMBL, созданная в 1982 году, в настоящее время поддерживается Европейским институтом биоинформатики (EBI), расположенным недалеко от Кембриджа, Англия, который также курирует базу данных белковых последовательностей SWISS-PROT и более 30 других специализированных баз данных.
Работа с данными о последовательностях в BBN и LANL спонсировалась Национальным институтом общих медицинских наук (NIGMS), а также Министерством энергетики и другими агентствами. По истечении первого 5-летнего контракта IntelliGenetics стала основным подрядчиком, а LANL снова стала субподрядчиком, отвечающим за проектирование и создание базы данных. 19 октября92, по окончании второго 5-летнего контракта NIGMS передала GenBank Национальному центру биотехнологической информации (NCBI) в Национальной медицинской библиотеке. В августе 1993 года ресурсы баз данных LANL и NCBI стали независимыми друг от друга. GenBank остался в NCBI, а LANL взяла новое название База данных последовательностей генома (GSDB) и переехала в Национальный центр ресурсов генома (NCGR) в Санта-Фе, штат Нью-Мексико. База данных нуклеотидных последовательностей EMBL, созданная в 1982 году, в настоящее время поддерживается Европейским институтом биоинформатики (EBI), расположенным недалеко от Кембриджа, Англия, который также курирует базу данных белковых последовательностей SWISS-PROT и более 30 других специализированных баз данных. DDBJ, созданный в 1984 и спонсируемая Министерством образования, науки и культуры Японии с 1986 года, собирает данные о последовательностях нуклеотидов, в основном от японских ученых, и посредством электронной передачи делает доступными более дюжины других баз данных.
DDBJ, созданный в 1984 и спонсируемая Министерством образования, науки и культуры Японии с 1986 года, собирает данные о последовательностях нуклеотидов, в основном от японских ученых, и посредством электронной передачи делает доступными более дюжины других баз данных.
В течение десятилетия будут секвенированы геномы не менее 200 организмов, от многочисленных видов бактерий до человека. К тому времени анализы экспрессии с использованием высокопроизводительных микрочипов ДНК, кДНК или белковых микрочипов станут обычным явлением и предоставят нам огромное количество новой информации о времени и месте (т. изменения экспрессии генов в развитии организма и реакции на различные условия воздействия (Reichhardt 1999). Возникнет огромная потребность в отделах или подразделениях биоинформатики в университетах и промышленности для отслеживания данных и их анализа в отношении интересных вопросов об организации и функциях генома (см. комментарий Reichhardt 1999). Дополнительная информация может быть получена при сравнении геномов разных организмов. Потребность в обучении большого количества людей новой области биоинформатики будет велика. Информация, доступная в Интернете, должна способствовать интеграции областей токсикологии развития, генетики человека, геномики и биологии развития. В будущем токсикологи, занимающиеся вопросами развития, безусловно, во многом выиграют от быстрого и немедленного доступа к этой новой информации, но следует понимать, что потребуется обучение, прежде чем можно будет эффективно использовать огромные объемы информации. В настоящее время также не определено, как лучше всего организовать данные, чтобы те, кто занимается оценкой риска, могли получить наиболее важную информацию.
Потребность в обучении большого количества людей новой области биоинформатики будет велика. Информация, доступная в Интернете, должна способствовать интеграции областей токсикологии развития, генетики человека, геномики и биологии развития. В будущем токсикологи, занимающиеся вопросами развития, безусловно, во многом выиграют от быстрого и немедленного доступа к этой новой информации, но следует понимать, что потребуется обучение, прежде чем можно будет эффективно использовать огромные объемы информации. В настоящее время также не определено, как лучше всего организовать данные, чтобы те, кто занимается оценкой риска, могли получить наиболее важную информацию.
ПОСЛЕДНИЕ РАЗРАБОТКИ В МОЛЕКУЛЯРНОЙ ЭПИДЕМИОЛОГИИ
Молекулярные инструменты недавно использовались для выявления взаимодействий между генетическими факторами и факторами окружающей среды в возникновении сложных заболеваний, таких как дефекты развития. Большинство неблагоприятных исходов беременности у людей имеют неизвестную этиологию и рассматриваются как сложные признаки, при которых экзогенные агенты могут взаимодействовать с определенными комбинациями аллельных вариантов генов, контролирующих развитие и дифференцировку, что приводит к неблагоприятным исходам беременности. Исследования взаимодействия генов и окружающей среды во время эмбриогенеза и развития плода стали обычным явлением и получили все большее признание. Категории этиологии болезней можно рассматривать как охватывающие диапазон от полностью генетических причин до полностью экологических причин. Эти категории включают причины с одним геном, хромосомные причины, многофакторные причины с высокой наследуемостью, многофакторные причины с низкой наследуемостью, инфекционные причины и причины, связанные с окружающей средой (Khoury et al. 19).93а).
Исследования взаимодействия генов и окружающей среды во время эмбриогенеза и развития плода стали обычным явлением и получили все большее признание. Категории этиологии болезней можно рассматривать как охватывающие диапазон от полностью генетических причин до полностью экологических причин. Эти категории включают причины с одним геном, хромосомные причины, многофакторные причины с высокой наследуемостью, многофакторные причины с низкой наследуемостью, инфекционные причины и причины, связанные с окружающей средой (Khoury et al. 19).93а).
Многие моногенные расстройства характеризуются низкой частотой аллеля болезни в общей популяции (частота аллеля 1% или менее) и высокой пенетрантностью (большая часть людей с аллелем болезни развивается). Гены предрасположенности к этим моногенным нарушениям обычно демонстрируют менделевские модели наследования и связаны с высоким риском заболевания. Хотя единичные менделевские расстройства встречаются редко, они вносят значительный вклад в младенческую заболеваемость и смертность. Приблизительно 4-7% педиатрических госпитализаций приходится на выявленные менделевские заболевания (Khoury et al. 19).93б). Из более чем 2000 вероятных одногенных синдромов дефектов развития у людей ген был выделен и картирован для 100 из этих синдромов и картирован, но еще не выделен для еще 100 (Winter 1996). У мыши, для сравнения, примерно 500 спонтанно возникающих дефектов одного гена, связанных с дефектами развития. Приблизительно 75 из этих генов были выделены и картировано более 400 (Winter 1996). Кроме того, было получено более 1000 мутантов мышей с известными дефектами генов (многие в компонентах сигнальных путей), и многие из них имеют фенотипы, которые полностью квалифицируют их как мышиные дефекты развития одного гена. Несмотря на наличие мутантов мышей и идентификацию генов, важных для развития C. elegans , Drosophila и рыбок данио (см. главы 6 и 7), изучение дефектов одного гена, способствующих дефектам развития у человека, еще не получило большого экспериментального внимания.
Приблизительно 4-7% педиатрических госпитализаций приходится на выявленные менделевские заболевания (Khoury et al. 19).93б). Из более чем 2000 вероятных одногенных синдромов дефектов развития у людей ген был выделен и картирован для 100 из этих синдромов и картирован, но еще не выделен для еще 100 (Winter 1996). У мыши, для сравнения, примерно 500 спонтанно возникающих дефектов одного гена, связанных с дефектами развития. Приблизительно 75 из этих генов были выделены и картировано более 400 (Winter 1996). Кроме того, было получено более 1000 мутантов мышей с известными дефектами генов (многие в компонентах сигнальных путей), и многие из них имеют фенотипы, которые полностью квалифицируют их как мышиные дефекты развития одного гена. Несмотря на наличие мутантов мышей и идентификацию генов, важных для развития C. elegans , Drosophila и рыбок данио (см. главы 6 и 7), изучение дефектов одного гена, способствующих дефектам развития у человека, еще не получило большого экспериментального внимания. Однако гены, идентифицированные как важные для развития C. elegans , Drosophila и рыбок данио, представляют собой богатый источник информации для идентификации генов потенциальной восприимчивости у людей. Это поражает этот комитет как недоиспользуемый ресурс.
Однако гены, идентифицированные как важные для развития C. elegans , Drosophila и рыбок данио, представляют собой богатый источник информации для идентификации генов потенциальной восприимчивости у людей. Это поражает этот комитет как недоиспользуемый ресурс.
Многофакторные расстройства или комплексные заболевания характеризуются генетической сложностью и вероятным взаимодействием генов и окружающей среды (Ellsworth et al. 1997). Эти заболевания имеют тенденцию накапливаться внутри семьи, но не наследуются простым менделевским способом. Они, как правило, обнаруживаются в большей пропорции в пораженных семьях, чем ожидается среди населения в целом. В отличие от моногенных заболеваний, гены предрасположенности к сложным заболеваниям, как правило, распространены в популяции (частота аллелей более 1%) и могут рассматриваться как полиморфизмы. Гены предрасположенности обычно связаны с низким риском для индивидуума, но с высоким атрибутивным риском в популяции. В случаях высокой наследуемости признак болезни может иметь аллели нескольких основных генов и нескольких генов-модификаторов, способствующих его пенетрантности и экспрессивности. У людей с низкой наследуемостью могут быть аллели нескольких генов, а также специфические факторы окружающей среды, которые вместе увеличивают риск заболевания в популяции.
У людей с низкой наследуемостью могут быть аллели нескольких генов, а также специфические факторы окружающей среды, которые вместе увеличивают риск заболевания в популяции.
Недавние примеры, в которых взаимодействия генов и окружающей среды были успешно объяснены для дефектов развития, следующие: были двусмысленными (Hwang et al. 1995). В этом исследовании не было выявлено общей значимой связи между курением матери и расщелинами рта у новорожденных. Однако, если у новорожденного был вариантный аллель ( TAQL C2) гена TGF α, отношение шансов развития расщелин ротовой полости у детей от курящих матерей (более 10 сигарет в день) составило 8,7, что в 10 раз больше, чем у детей от курящих матерей, у которых не было этот вариант аллеля. Сам по себе вариантный аллель не был связан с повышенным риском расщелины полости рта. TGF α представляет собой лиганд тирозинкиназного рецептора.
Ген гомеобокса MSX1 , дефекты конечностей и курение: частоты редких аллелей в MSX1 несколько выше у детей с дефектами конечностей по сравнению с детьми с другими типами дефектов развития (отношение шансов 2,4). Младенцы, несущие редкие аллели, имели в 2 раза повышенный риск недостаточности конечностей, когда мать курила во время беременности (отношение шансов 4,8), по сравнению с младенцами, носителями редкого аллеля, чьи матери не курили. Курение само по себе не было связано с повышенным риском недостаточности конечностей в этом исследовании (Hwang et al., 1998). MSX1 является фактором транскрипции, активность которого часто зависит от сигналов BMP2,4.
Младенцы, несущие редкие аллели, имели в 2 раза повышенный риск недостаточности конечностей, когда мать курила во время беременности (отношение шансов 4,8), по сравнению с младенцами, носителями редкого аллеля, чьи матери не курили. Курение само по себе не было связано с повышенным риском недостаточности конечностей в этом исследовании (Hwang et al., 1998). MSX1 является фактором транскрипции, активность которого часто зависит от сигналов BMP2,4.
Различная восприимчивость человека к дефектам развития, вызванным дифенилгидантоином (ДФГ или фенитоином): 10-20% потомства женщин с эпилепсией, принимавших фенитоин во время беременности, имеют гидантоиновый синдром плода (Hanson et al., 1976; van Dyke et al. 1988). Считается, что фенитоин превращается в реактивное промежуточное соединение, оказывающее тератогенное действие (Martz et al., 1977; обзор см. в Finnell et al., 1997a). Вариабельность популяции в ответ на фенитоин, возможно, отражает гетерогенность генотипов ДМО. В паре близнецов, в которых только у одного близнеца была дисморфология гидантоинового синдрома, у матери и больного близнеца была снижена активность фермента эпоксидгидроксилазы по сравнению со здоровым близнецом (Buehler 19).84). Бюлер и др. (1990) впоследствии показали, что дети с гидантоиновым синдромом действительно имеют более низкую активность эпоксидгидролазы. Эпоксидгидролаза может служить для детоксикации промежуточного соединения ареноксида фенитоина, и было высказано предположение, что сниженная активность этого фермента ответственна за повышенную чувствительность к фенитоину. Хассет и др. (1994) сообщили о полиморфизме гена эпоксидгидролазы, который заметно снижает активность фермента. И наоборот, исходное соединение DPH может быть тератогенным, а генетические дефекты CYP2C9и CYP2C19 (два фермента, которые метаболизируют ДФГ) могут приводить к накоплению тератогена ДФГ. Частота полиморфизмов медленного метаболизма CYP2C9 и CYP2C19 колеблется от 10% до 25% людей в разных популяциях, что очень похоже на процент женщин, принимающих DHP, у которых есть дети с фетальным гидантоиновым синдромом.
В паре близнецов, в которых только у одного близнеца была дисморфология гидантоинового синдрома, у матери и больного близнеца была снижена активность фермента эпоксидгидроксилазы по сравнению со здоровым близнецом (Buehler 19).84). Бюлер и др. (1990) впоследствии показали, что дети с гидантоиновым синдромом действительно имеют более низкую активность эпоксидгидролазы. Эпоксидгидролаза может служить для детоксикации промежуточного соединения ареноксида фенитоина, и было высказано предположение, что сниженная активность этого фермента ответственна за повышенную чувствительность к фенитоину. Хассет и др. (1994) сообщили о полиморфизме гена эпоксидгидролазы, который заметно снижает активность фермента. И наоборот, исходное соединение DPH может быть тератогенным, а генетические дефекты CYP2C9и CYP2C19 (два фермента, которые метаболизируют ДФГ) могут приводить к накоплению тератогена ДФГ. Частота полиморфизмов медленного метаболизма CYP2C9 и CYP2C19 колеблется от 10% до 25% людей в разных популяциях, что очень похоже на процент женщин, принимающих DHP, у которых есть дети с фетальным гидантоиновым синдромом.
Альдегиддегидрогеназа 2, алкогольдегидрогеназа 2 и предрасположенность к алкогольному синдрому плода: в метаболизме этилового спирта алкогольдегидрогеназа (АДГ) катализирует превращение алкоголя в ацетальдигид, а ацетилальдегиддегидрогеназа (АЛДГ) этот продукт в уксусную кислоту. Считается, что алкоголь и ацетальдегид, но не уксусная кислота, могут оказывать вредное воздействие. Люди обладают как минимум семью генами ADH и 13 генами ALDH. Крэбб (1990) указали, что мутация с одним основанием в ALDh3 (митохондриальная в отличие от цитозольной ALDH), которая отвечает за острую реакцию приливов к алкоголю и непереносимость алкоголя, в основном у азиатов, является наиболее хорошо охарактеризованным генетическим фактором, влияющим на употребление алкоголя. более низкая активность, коррелирующая с непереносимостью). Он предположил, что полиморфизмы в нескольких генах алкогольдегидрогеназы могут быть связаны с риском алкогольного синдрома плода (ФАС). Генетическое влияние алкогольного синдрома плода предполагается в исследованиях близнецов: Стрейссгут и Дехане (19). 93) установили, что конкордантность диагноза фетального алкогольного синдрома составляет 5 из 5 для монозиготных и 7 из 11 для дизиготных близнецов. В двух дизиготных парах у одного близнеца был ФАС, а у другого — фетальный алкогольный эффект (ФАЭ). В двух других дизиготных парах у одного близнеца не было явных аномалий, а у другого была FAE. Показатели коэффициента интеллекта были наиболее сходными в парах монозиготных близнецов и наименее схожими в парах дизиготных близнецов, не соответствующих диагнозу. Джонсон и др. (1996) задокументировали аномалии центральной нервной системы (ЦНС) ФАС с помощью магнитно-резонансной томографии. ЦНС и черепно-лицевые аномалии были преимущественно симметричными и центральными или срединными. Авторы заявили, что ассоциация подчеркивала концепцию срединной линии как особого поля развития. ЦНС уязвима для неблагоприятных факторов во время эмбриогенеза, роста и развития плода.
93) установили, что конкордантность диагноза фетального алкогольного синдрома составляет 5 из 5 для монозиготных и 7 из 11 для дизиготных близнецов. В двух дизиготных парах у одного близнеца был ФАС, а у другого — фетальный алкогольный эффект (ФАЭ). В двух других дизиготных парах у одного близнеца не было явных аномалий, а у другого была FAE. Показатели коэффициента интеллекта были наиболее сходными в парах монозиготных близнецов и наименее схожими в парах дизиготных близнецов, не соответствующих диагнозу. Джонсон и др. (1996) задокументировали аномалии центральной нервной системы (ЦНС) ФАС с помощью магнитно-резонансной томографии. ЦНС и черепно-лицевые аномалии были преимущественно симметричными и центральными или срединными. Авторы заявили, что ассоциация подчеркивала концепцию срединной линии как особого поля развития. ЦНС уязвима для неблагоприятных факторов во время эмбриогенеза, роста и развития плода.
Как показывают эти четыре примера, дальнейшее изучение взаимодействий генов и окружающей среды с использованием инструментов молекулярной эпидемиологии, вероятно, даст важную новую информацию о многофакторных причинах дефектов развития. Два из приведенных выше примеров касаются полиморфизмов генов, кодирующих ферменты, участвующие в метаболизме агента, а именно фенитоина или алкоголя, а два примера касаются полиморфизмов генов, кодирующих белковые интермедиаты путей передачи сигнала и генетических регуляторных цепей (9).0119 TGF α или MSX1 ), которые являются компонентами процессов развития.
Два из приведенных выше примеров касаются полиморфизмов генов, кодирующих ферменты, участвующие в метаболизме агента, а именно фенитоина или алкоголя, а два примера касаются полиморфизмов генов, кодирующих белковые интермедиаты путей передачи сигнала и генетических регуляторных цепей (9).0119 TGF α или MSX1 ), которые являются компонентами процессов развития.
Изучение взаимодействий генов и окружающей среды является особенно продвинутым для болезненных состояний, связанных с DME, и эта область исследований называется экогенетикой или фармакогенетикой. Существуют ферменты метаболизма фазы I и фазы II. Ферменты фазы I катализируют превращение экзогенного агента в модифицированную форму, часто в окисленную форму. В некоторых случаях экзогенный агент токсичен, а промежуточный продукт — нет, но в других случаях агент нетоксичен, а промежуточный продукт токсичен, что является примером метаболического потенцирования или активации. Вероятно, у млекопитающих (включая человека) существует несколько сотен видов ферментов фазы I (и кодирующих их генов). Большинство из них являются членами большого семейства монооксигеназ цитохрома Р450. Считается, что три или четыре вида ферментов P450 метаболизируют 70-80% рецептурных лекарств, принимаемых пациентами, а дефекты ферментов фазы I коррелируют с чувствительностью к лекарствам и опасными побочными эффектами. Ферменты фазы II впоследствии катализируют конъюгацию модифицированного промежуточного соединения с эндогенным безвредным метаболитом, таким как сахар или аминокислота, после чего конъюгированная форма, которая обычно нетоксична, выводится из организма. В нескольких тщательно проанализированных случаях было обнаружено, что пациенты с высоким уровнем фермента фазы I (следовательно, производящим большое количество токсического промежуточного продукта) и низким уровнем фермента фазы II (следовательно, неспособным избавиться от этого промежуточного продукта) особенно риск химических воздействий. Таким образом, человеческие варианты с измененными уровнями ферментов одной или другой группы, или обоих, могут иметь аномальные реакции на лекарственные средства, вплоть до 20- или 30-кратного увеличения чувствительности к лекарственным средствам.
Большинство из них являются членами большого семейства монооксигеназ цитохрома Р450. Считается, что три или четыре вида ферментов P450 метаболизируют 70-80% рецептурных лекарств, принимаемых пациентами, а дефекты ферментов фазы I коррелируют с чувствительностью к лекарствам и опасными побочными эффектами. Ферменты фазы II впоследствии катализируют конъюгацию модифицированного промежуточного соединения с эндогенным безвредным метаболитом, таким как сахар или аминокислота, после чего конъюгированная форма, которая обычно нетоксична, выводится из организма. В нескольких тщательно проанализированных случаях было обнаружено, что пациенты с высоким уровнем фермента фазы I (следовательно, производящим большое количество токсического промежуточного продукта) и низким уровнем фермента фазы II (следовательно, неспособным избавиться от этого промежуточного продукта) особенно риск химических воздействий. Таким образом, человеческие варианты с измененными уровнями ферментов одной или другой группы, или обоих, могут иметь аномальные реакции на лекарственные средства, вплоть до 20- или 30-кратного увеличения чувствительности к лекарственным средствам.
В настоящее время известно не менее 60 экогенетических или фармакогенетических различий; многие перечислены в . В этом исследовании эпидемиологические методы и геномные методы дополняют друг друга, и прогресс в ближайшем будущем кажется обеспеченным. Вполне вероятно, что плод подвергается повышенному риску дефектов развития, поскольку либо мать, либо плод не могут усваивать химические вещества так же хорошо, как другие, или потому, что они усваивают их лучше.
ТАБЛИЦА 5-1
Классификация частичного перечня фармакогенетических или экогенетических различий человека.
Другой обширной областью для исследования корреляции полиморфизмов с дефектами развития являются компоненты самих процессов развития, а именно, ключевые компоненты процессов развития, такие как пути передачи сигналов и цепи генетической регуляции. Эти компоненты являются мишенями для экзогенных агентов, которые ускользают от детоксикации или потенцируются ферментами фазы I. Прояснены два примера TGF α с копчением и MSX1 с дефектами конечностей. Однако в настоящее время имеется мало хороших примеров, возможно, просто потому, что информация о процессах развития до недавнего времени была недоступна. Поскольку компоненты развития консервативны для разных типов и хорошо описаны в Drosophila , C. elegans , а теперь и мышь, доступны средства для получения родственных человеческих последовательностей и поиска полиморфизмов. Это исследование будет далее обсуждаться в главах 8 и 9. Фенотипы нулевых мутантов мышей, созданные с помощью технологии нокаута эмбриональных стволовых клеток (ES), уже внесли существенный вклад в наши знания о том, как изменения в этих генах и путях влияют на развитие. Такого рода исследования развиваются быстрыми темпами. Полная делеция некоторых компонентов различных путей, лежащих в основе развития, приводит к гибели эмбрионов, но в других случаях, когда для компонента существует избыточность генов, делеция компонента приводит к рождению мышей с дефектами развития, напоминающими дефекты человека (см.
Однако в настоящее время имеется мало хороших примеров, возможно, просто потому, что информация о процессах развития до недавнего времени была недоступна. Поскольку компоненты развития консервативны для разных типов и хорошо описаны в Drosophila , C. elegans , а теперь и мышь, доступны средства для получения родственных человеческих последовательностей и поиска полиморфизмов. Это исследование будет далее обсуждаться в главах 8 и 9. Фенотипы нулевых мутантов мышей, созданные с помощью технологии нокаута эмбриональных стволовых клеток (ES), уже внесли существенный вклад в наши знания о том, как изменения в этих генах и путях влияют на развитие. Такого рода исследования развиваются быстрыми темпами. Полная делеция некоторых компонентов различных путей, лежащих в основе развития, приводит к гибели эмбрионов, но в других случаях, когда для компонента существует избыточность генов, делеция компонента приводит к рождению мышей с дефектами развития, напоминающими дефекты человека (см. примеры в главе 6). Работа над ключевыми компонентами развития у животных может значительно помочь в поиске человеческих вариантов компонентов развития.
примеры в главе 6). Работа над ключевыми компонентами развития у животных может значительно помочь в поиске человеческих вариантов компонентов развития.
Последним шагом будет оценка того, как конкретные токсиканты взаимодействуют с этими измененными путями, вызывая аномальное развитие. Затем можно исследовать соответствующие гены предрасположенности к развитию в человеческих популяциях и выявить взаимодействия между аллелями этих генов и воздействием токсикантов. Будут ли аллельные варианты генов, контролирующих развитие, таких как те, что кодируют компоненты основных путей передачи сигналов, более важными, столь же важными или менее важными, чем те, которые контролируют DME, еще предстоит определить, и им следует уделять первоочередное внимание в будущих исследованиях.
РЕЗЮМЕ
Секвенирование генома человека и различных геномов животных предоставит фундаментальную информацию об организации генома, эволюции генома, разнообразии последовательностей генов и генетических полиморфизмах. Секвенирование также обеспечит платформу для глобального систематического анализа функции и экспрессии генов. Ожидается, что токсикология развития и оценка риска во многом выиграют от новых методологий и информации, а именно, при анализе взаимодействий генов и окружающей среды при дефектах развития человека и при анализе действия токсикантов на процессы развития.
Секвенирование также обеспечит платформу для глобального систематического анализа функции и экспрессии генов. Ожидается, что токсикология развития и оценка риска во многом выиграют от новых методологий и информации, а именно, при анализе взаимодействий генов и окружающей среды при дефектах развития человека и при анализе действия токсикантов на процессы развития.
Считается, что от четверти до половины дефектов развития человека связаны с взаимодействием генотипа и окружающей среды, то есть с воздействием на особей определенного генетического состава определенных условий окружающей среды, к которым они более чувствительны, чем другие . Сложные взаимодействия генов и окружающей среды представляют серьезную проблему для токсикологии развития. Чтобы добиться прогресса в понимании взаимодействия генов и окружающей среды, потребуются лучшие эпидемиологические методы, самые четкие молекулярные оценки воздействия и воздействия, а также самый подробный анализ генетических различий. Недавние улучшения в высокопроизводительном секвенировании генома человека и в идентификации полиморфных маркеров, удобно расположенных вдоль каждой хромосомы, увеличивают шансы на прогресс в этом направлении. В этой новой области молекулярной эпидемиологии недавнее понимание человеческих различий в уровнях активности различных DME и генетической основы этих различий сулит большие надежды. Другие виды генных продуктов, которые могут быть важны для восприимчивости, но менее известны, включают компоненты процессов развития, особенно компоненты путей передачи сигналов и генетических регуляторных цепей. Эти компоненты будут обсуждаться в последующих главах.
В этой новой области молекулярной эпидемиологии недавнее понимание человеческих различий в уровнях активности различных DME и генетической основы этих различий сулит большие надежды. Другие виды генных продуктов, которые могут быть важны для восприимчивости, но менее известны, включают компоненты процессов развития, особенно компоненты путей передачи сигналов и генетических регуляторных цепей. Эти компоненты будут обсуждаться в последующих главах.
В настоящее время доступны методы для описания паттернов одновременной экспрессии тысяч генов развивающихся клеток и тканей и, в принципе, для описания изменений экспрессии в эмбрионах нормальных экспериментальных животных и эмбрионов после тестирования с токсикантами. Ожидается, что использование таких методов улучшит категоризацию и анализ дефектов развития, вызванных токсикантами.
Количество данных, полученных с помощью современных геномных методов, огромно. Чтобы в полной мере воспользоваться данными, потребуются отделы или отделы биоинформатики в университетах и отраслях, чтобы отслеживать данные и анализировать их в отношении вопросов об организации и функционировании генома.
Дифференциальный взгляд на отношения генотип-фенотип
- Список журналов
- Фронт Жене
- PMC4437230
Передняя Генетика. 2015 г.; 6: 179.
Опубликовано в Интернете 19 мая 2015 г. doi: 10.3389/fgene.2015.00179
, 1 , * , 2 и 3
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности между генотипами и фенотипами. Здесь мы вновь подчеркиваем старую точку зрения, согласно которой отношения генотип-фенотип (GP) лучше всего рассматривать как связь между двумя различиями, одно на генетическом уровне, а другое на фенотипическом уровне. На сегодняшний день в биологических исследованиях преобладает мнение, что несколько генов взаимодействуют с несколькими переменными окружающей среды (такими как абиотические факторы, культура или симбионты) для создания фенотипа. Часто проблема связи генотипов и фенотипов формулируется в терминах карт генотипов и фенотипов, и такие графические представления неявным образом уводят нас от дифференциального взгляда на отношения ГП. Здесь мы показываем, что дифференциальный взгляд на отношения GP является полезной объяснительной основой в контексте всепроникающей плейотропии, эпистаза и эффектов окружающей среды. В таких случаях уместно рассматривать отношения ГП как различия, встроенные в различия. Мышление с точки зрения различий проясняет сравнение между влиянием окружающей среды и генетики на фенотипы и помогает лучше понять связь между генотипами и фенотипами.
Часто проблема связи генотипов и фенотипов формулируется в терминах карт генотипов и фенотипов, и такие графические представления неявным образом уводят нас от дифференциального взгляда на отношения ГП. Здесь мы показываем, что дифференциальный взгляд на отношения GP является полезной объяснительной основой в контексте всепроникающей плейотропии, эпистаза и эффектов окружающей среды. В таких случаях уместно рассматривать отношения ГП как различия, встроенные в различия. Мышление с точки зрения различий проясняет сравнение между влиянием окружающей среды и генетики на фенотипы и помогает лучше понять связь между генотипами и фенотипами.
Ключевые слова: генотип, фенотип, генетика, сложный признак, GxE, GxG. человек человеком». В противовес0052 генотип , наследственный материал, передаваемый гаметами. Начиная с раннего предположения, что генотипы и фенотипы образуют два фундаментально разных уровня биологической абстракции (Johannsen, 1911), задача состояла в том, чтобы понять, как они взаимодействуют друг с другом, как генотипы отображаются на фенотипы. За последние 15 лет более 1000 примеров изменений последовательности ДНК были связаны с естественными невредными фенотипическими различиями между особями или видами у эукариот (Martin and Orgogozo, 2013b). У человека OMIM 9Каталог 0066® (онлайн-менделевское наследование у человека, http://omim.org/), в котором собраны генетические детерминанты фенотипов, связанных с заболеванием, насчитывает более 4300 записей и в общей сложности 2493 опубликованных полногеномных ассоциативных исследования (GWAS). обнаружение множества участков в геноме, которые статистически связаны со сложными признаками (Welter et al., 2014). Поскольку обнаружение причинно-следственных связей между генетическими и фенотипическими вариациями ускоряется, пересмотр наших концептуальных инструментов может помочь нам найти объединяющие принципы в рое данных. Здесь мы размышляем о взаимосвязи между генотипами и фенотипами и адресуем это эссе биологам, которые готовы попытаться бросить вызов своему нынешнему пониманию фенотипов.
За последние 15 лет более 1000 примеров изменений последовательности ДНК были связаны с естественными невредными фенотипическими различиями между особями или видами у эукариот (Martin and Orgogozo, 2013b). У человека OMIM 9Каталог 0066® (онлайн-менделевское наследование у человека, http://omim.org/), в котором собраны генетические детерминанты фенотипов, связанных с заболеванием, насчитывает более 4300 записей и в общей сложности 2493 опубликованных полногеномных ассоциативных исследования (GWAS). обнаружение множества участков в геноме, которые статистически связаны со сложными признаками (Welter et al., 2014). Поскольку обнаружение причинно-следственных связей между генетическими и фенотипическими вариациями ускоряется, пересмотр наших концептуальных инструментов может помочь нам найти объединяющие принципы в рое данных. Здесь мы размышляем о взаимосвязи между генотипами и фенотипами и адресуем это эссе биологам, которые готовы попытаться бросить вызов своему нынешнему пониманию фенотипов. Выделим одну полезную точку зрения — дифференциальную. Затем мы показываем, что эта простая структура остается полезной в контексте всепроникающей плейотропии, эпистаза и воздействия окружающей среды.
Выделим одну полезную точку зрения — дифференциальную. Затем мы показываем, что эта простая структура остается полезной в контексте всепроникающей плейотропии, эпистаза и воздействия окружающей среды.
Мутации, выделенные из лабораторных штаммов, сыграли важную роль в понимании карты GP. В классической схеме мутацию сравнивают с эталоном дикого типа, и ее фенотипические эффекты используются для вывода о функции гена. Эта структура часто приводит к семантическому сокращению: от генетического изменения, вызывающего вариацию фенотипа, часто бывает удобно ассимилировать соответствующий ген в качестве причинной детерминанты признака (Keller, 2010; Рисунок ). Часто можно встретить заголовки, выражающие эти упрощения, трубящие перед широкой аудиторией об открытии гена «долголетия» или «благополучия», которые приносят научную точность в жертву психологическому воздействию. В соответствии с этим следует ли называть ген, мутация которого летальна, «геном жизни»? На самом деле эти упрощенные формулировки означают, что вариация данного гена вызывает вариацию данного фенотипа (Dawkins, 1982; Schwartz, 2000; Waters, 2007). На самом деле ген сам по себе не может ни вызвать наблюдаемый фенотипический признак, ни быть необходимым и достаточным для появления наблюдаемых признаков. Гены нуждаются в клеточной среде, совместном действии множества других генов, а также в определенных физико-химических условиях, чтобы оказывать заметное влияние на организмы ( Рисунок ). Например, пигментация каштановых волос у одного человека является результатом не только генов, кодирующих ферменты, синтезирующие пигмент, но и наличия клеток, продуцирующих пигменты соответствующих молекул субстрата (таких как тирозин для меланина), и количества полученного вещества. солнечный свет (Liu et al., 2013). Таким образом, генетический редукционистский подход, который исследует лишь несколько генетических параметров среди множества причинных факторов, бесполезен для полного решения широкого вопроса о том, что делает волосы коричневыми, что порождает определенную биологическую структуру или процесс в целом. Тем не менее, генетический редукционизм может быть вполне подходящим для идентификации генетических локусов, где изменение вызывает фенотипическое различие (9).
На самом деле ген сам по себе не может ни вызвать наблюдаемый фенотипический признак, ни быть необходимым и достаточным для появления наблюдаемых признаков. Гены нуждаются в клеточной среде, совместном действии множества других генов, а также в определенных физико-химических условиях, чтобы оказывать заметное влияние на организмы ( Рисунок ). Например, пигментация каштановых волос у одного человека является результатом не только генов, кодирующих ферменты, синтезирующие пигмент, но и наличия клеток, продуцирующих пигменты соответствующих молекул субстрата (таких как тирозин для меланина), и количества полученного вещества. солнечный свет (Liu et al., 2013). Таким образом, генетический редукционистский подход, который исследует лишь несколько генетических параметров среди множества причинных факторов, бесполезен для полного решения широкого вопроса о том, что делает волосы коричневыми, что порождает определенную биологическую структуру или процесс в целом. Тем не менее, генетический редукционизм может быть вполне подходящим для идентификации генетических локусов, где изменение вызывает фенотипическое различие (9). 0363 Рисунок ). Различие в цвете волос между двумя людьми может быть обусловлено в некоторых случаях их генетическими различиями. Заметим, однако, что не все фенотипические изменения можно отнести к генетическим изменениям. Различия в цвете волос также могут быть вызваны негенетическими факторами, такими как возраст, интенсивность солнечного излучения или окраска волос, или сочетанием как генетических, так и негенетических различий.
0363 Рисунок ). Различие в цвете волос между двумя людьми может быть обусловлено в некоторых случаях их генетическими различиями. Заметим, однако, что не все фенотипические изменения можно отнести к генетическим изменениям. Различия в цвете волос также могут быть вызваны негенетическими факторами, такими как возраст, интенсивность солнечного излучения или окраска волос, или сочетанием как генетических, так и негенетических различий.
Открыть в отдельном окне
Схематические изображения звеньев ГП. (А) Традиционное представление в классическом генетическом редукционизме. (B) Интегративный взгляд на биологию развития. (C) Схема экспериментального подхода в генетике. (D) Схема экспериментального подхода в эволюционной генетике. (E) Один из примеров таксономически надежной связи GP: SLC45A2 и внутривидовые различия в пигментации у тигров и кур. Отношения ГП обозначены пунктирными линиями на панелях 9. 0363 (D–E) .
0363 (D–E) .
В то время как современная генетика находилась в зачаточном состоянии, Альфред Стертевант сформулировал вопрос о карте ВП простыми словами: «одной из центральных проблем биологии является проблема дифференцировки — как яйцо развивается в сложный многоклеточный организм? Это, конечно, традиционная главная проблема эмбриологии; но он также появляется в генетике в форме вопроса: как гены производят свои эффекты?» (Стёртевант, 1932). Долгое время некоторые генетики, возможно, думали, что они анализируют морфогенетические механизмы, лежащие в основе формирование фенотипических признаков, в то время как их экспериментальный подход фактически заключался в выявлении генов, отсутствие или изменение которых (мутации, делеции, дупликации, перестройки и т. д.) приводит к фенотипическим различиям (сравните рис. с рис. ). На самом деле предложение «ваши волосы каштановые» можно интерпретировать либо как абсолютное наблюдение (описание определенного набора молекул, содержащих определенные уровни темного пигмента эумеланина и светлого пигмента феомеланина), либо как имплицитную ссылку на другие возможности. (он коричневый, а не другого цвета). Заблуждения возникают из-за того, что фенотипы обычно определяются относительно возможностей, которые не сформулированы явно. Наше сознание и наш язык часто склонны путать объекты, изменчивость которых рассматривается, с самой изменчивостью (Keller, 2010), и важно напомнить, что в генетике интересующие нас объекты (например, данный генотип, аллель или фенотип) заслуживают определения относительно к другому эталонному состоянию.
(он коричневый, а не другого цвета). Заблуждения возникают из-за того, что фенотипы обычно определяются относительно возможностей, которые не сформулированы явно. Наше сознание и наш язык часто склонны путать объекты, изменчивость которых рассматривается, с самой изменчивостью (Keller, 2010), и важно напомнить, что в генетике интересующие нас объекты (например, данный генотип, аллель или фенотип) заслуживают определения относительно к другому эталонному состоянию.
Таким образом, классический генетический редукционистский подход по своей сути неспособен объяснить все факторы, ответственные за наблюдаемые характеристики в живом мире (Stotz, 2012), но является мощным и актуальным методом анализа генетических рычагов наследуемой фенотипической изменчивости. Сосредоточение внимания на фенотипической изменчивости между особями, а не на абсолютных признаках, присутствующих в отдельных организмах, является ключом к лучшему пониманию генетических причин фенотипического разнообразия.
Мышление с точки зрения различий делает очевидной абстрактную сущность, которая включает в себя как генетический, так и фенотипический уровни. Этот объект состоит из вариации генетического локуса (два аллеля), связанного с ним фенотипического изменения (два различных фенотипических состояния) и их взаимоотношений (, рисунок ). Мы втроем называем совокупность этих элементов «гефе», но здесь мы называем это просто «отношением генотип-фенотип» (отношением ГП). Мы покажем, что отношения ГП — это гораздо больше, чем простое и слабо определенное взаимодействие между двумя уровнями организации: это причинно-следственная связь, которая облегчает наше понимание фенотипического разнообразия.
Генетическая часть взаимосвязи GP
В современных базах данных аннотаций генома ген обычно определяется как участок нуклеиновых кислот, который транскрибируется и кодирует РНК или полипептид с известной или предполагаемой функцией (Gerstein et al. др., 2007). Генетический локус, лежащий в основе фенотипических различий, не обязательно является геном в строгом смысле; он может охватывать определенную пару оснований, кодирующую область, регуляторную область цис- или распространяться на весь ген с его цис -регуляторные области или даже кластер генов ( Таблица ). Как ранее отмечалось другими (Falk, 1984; Gilbert, 2000; Stern, 2000; Moss, 2003; Griffiths and Stotz, 2013), концепция гена в биологии развития и в современных базах данных аннотаций генома отличается от концепции гена в эволюционная биология. Здесь акцент делается не на сам ген, как он определен в геномных базах данных, а скорее на индивидуальном функциональном разделении генома на определяющие различия локусы. Генотипическая часть родства GP может принимать форму различных аллелей: разные кодоны, кодирующие разные аминокислоты, вставки/делеции в последовательности, кодирующей белок, расходящиеся версии конкретных cis- регуляторный элемент, наличие/отсутствие вставок транспозонов, количество копий генов в пределах генного кластера, склонного к структурной изменчивости, и т.
др., 2007). Генетический локус, лежащий в основе фенотипических различий, не обязательно является геном в строгом смысле; он может охватывать определенную пару оснований, кодирующую область, регуляторную область цис- или распространяться на весь ген с его цис -регуляторные области или даже кластер генов ( Таблица ). Как ранее отмечалось другими (Falk, 1984; Gilbert, 2000; Stern, 2000; Moss, 2003; Griffiths and Stotz, 2013), концепция гена в биологии развития и в современных базах данных аннотаций генома отличается от концепции гена в эволюционная биология. Здесь акцент делается не на сам ген, как он определен в геномных базах данных, а скорее на индивидуальном функциональном разделении генома на определяющие различия локусы. Генотипическая часть родства GP может принимать форму различных аллелей: разные кодоны, кодирующие разные аминокислоты, вставки/делеции в последовательности, кодирующей белок, расходящиеся версии конкретных cis- регуляторный элемент, наличие/отсутствие вставок транспозонов, количество копий генов в пределах генного кластера, склонного к структурной изменчивости, и т. д. В геноме не все нуклеотидные участки связаны с фенотипической изменчивостью. Например, вероятно, существуют фрагменты нуклеотидных последовательностей, в том числе так называемая мусорная ДНК (Graur et al., 2015), присутствие которых не оказывает никакого влияния на наблюдаемые характеристики организма, кроме того, что они реплицируются и, возможно, транскрибируются. Существуют также генетические локусы, которые могли быть связаны с фенотипической изменчивостью в прошлом и больше не связаны с фенотипической изменчивостью. Например, генетическая изменчивость в кодирующих областях, связывающих гистоновую ДНК, могла быть важной во время ранней эволюции эукариотических клеток, но эти генетические локусы больше не содержат фенотипически релевантных вариаций, кроме летальных мутаций. Таким образом, в геноме есть участки нуклеотидов, которые абсолютно необходимы для жизни, но сами по себе не содержат жизнеспособных фенотипически релевантных вариаций.
д. В геноме не все нуклеотидные участки связаны с фенотипической изменчивостью. Например, вероятно, существуют фрагменты нуклеотидных последовательностей, в том числе так называемая мусорная ДНК (Graur et al., 2015), присутствие которых не оказывает никакого влияния на наблюдаемые характеристики организма, кроме того, что они реплицируются и, возможно, транскрибируются. Существуют также генетические локусы, которые могли быть связаны с фенотипической изменчивостью в прошлом и больше не связаны с фенотипической изменчивостью. Например, генетическая изменчивость в кодирующих областях, связывающих гистоновую ДНК, могла быть важной во время ранней эволюции эукариотических клеток, но эти генетические локусы больше не содержат фенотипически релевантных вариаций, кроме летальных мутаций. Таким образом, в геноме есть участки нуклеотидов, которые абсолютно необходимы для жизни, но сами по себе не содержат жизнеспособных фенотипически релевантных вариаций.
Таблица 1
Несколько примеров отношений GP.
| Genetic locus | Phenotypic trait | Organisms |
|---|---|---|
| Two coding sites in the ABO HBGG gene | A/B blood group | Human, chimpanzee, gibbon |
| Цис -регуляторный элемент в гене лактазы | Способность переваривать молоко | Различные популяции человека |
| Number of duplications of the amylase genes AMY1 or AMY2B | Ability to digest starch | Human, dog |
| Presence/absence of a complex of adjacent genes coding for carotenoid desaturases and carotenoid cyclase/ синтазы | Способность продуцировать каротиноиды | Гороховая тля, паутинный клещ, галлица, нематода |
| Кодирующие сайты в опсинах генах | Цветовое зрение | Human, cetaceans, fishes, butterflies |
| Coding region of F 3’5’H | Flower pigmentation | Soybean, pea, annual phlox, potato, Iochroma |
| Coding region of FRIGIDA | Flowering time | Thale cress, oilseed rape |
| Coding region of BADh3 | Fragrance | Soybean, rice |
| Coding region of HMA3 | Heavy metal tolerance | Thale cress, rice |
| Coding and cis -regulatory regions of myostatin | Muscle size | Cattle, sheep, dog, pig, horse, human |
| Cis -регуляторные области в комплексе achaete-scute | Количество и положение сенсорных щетинок | Плодовые мушки |
| Cis -регуляторный элемент0052 pitx1 gene | Pelvis morphology | Stickleback fish |
| Coding region of SLC45A2 | Pigmentation of eye, hair, and skin | Human, tiger, chicken |
| Coding region of Mc1R | Пигментация волос и кожи, но не глаз | Человек, мышь, крупный рогатый скот, курица, морская свинка, лошадь, лиса, свинья, овца, собака, кролик, медведь, ягуар, ягуарунди, белка, птицы, прыткая ящерица |
| Cis -regulatory regions of tan and ebony | Pigmentation pattern | Fruitflies |
| Cis -regulatory elements in the shavenbaby gene | Position and number of trichomes | Плодовые мушки |
| Цис — регуляторные элементы в гене optix | Красный рисунок на крыльях бабочки | Длиннокрылые бабочки |
| Coding region of hemoglobin alpha and beta chain genes | Resistance to hypoxia | Human, llama, crocodile, deer mouse, waterfowl |
| Coding region of Ace | Resistance to organophosphate insecticides | Картофельный жук, тля, комары, комнатная муха, плодовая муха, восточная плодовая муха |
| Наличие/отсутствие вставки CypA в пределах TRIM5a gene | Resistance to retrovirus | Owl monkey, macaque, Old World monkeys |
Coding sites in the Nav1. 4 gene 4 gene | Resistance to tetrodotoxin or saxotoxin | Snakes, pufferfish, clam |
| Кодирующая область TAS2R38 | Чувствительность к горечи | Человек, шимпанзе |
| Cis -регуляторные и кодирующие области в Agouti | Пигментация кожи и шерсти | Человек, мышь-олень, крупный рогатый скот, свинья, собака, кошка, лошадь, лисица, домашняя лиса, перепел, овца |
| Количество дупликаций гена переносчика глюкозы в среде с низким содержанием глюкозы | Дрожжи | |
| Количество дупликаций гена CCL3L1 | Восприимчивость к ВИЧ-инфекции и скорость прогрессирования СПИДа после инфицирования | Человек |
| Cis -regulatory element in the WntA gene | Wing pigmentation pattern | Butterflies |
Open in a separate window
See (Martin and Orgogozo, 2013a) for references and for additional случаи.
Фенотипическая часть связи ГП
Фенотипическая часть связи ГП относится к разновидности вариации (цвет волос, уровень устойчивости к токсинам и т. д.), а не к состоянию (светлые волосы, дегустация фенилтиокарбамида и т. д.). .; Таблица ).
Фенотип, связанный с генетическим изменением, не обязательно ограничивается организмом, содержащим генетическую мутацию. Например, различие между лево- и правозакрученными раковинами у улитки Lymnaea peregra определяется одним генетическим локусом с материнским эффектом: генотип матери, а не самой особи, отвечает за направление скручивание раковины (Boycott et al., 1931). В других случаях причинное генетическое изменение связано с бактериями-симбионтами: термостойкость тли может различаться у разных особей из-за точечной мутации в их бактериальном симбионте (Dunbar et al., 2007). Определенные фенотипические эффекты могут проявляться и на более высоком уровне, чем организм, несущий генетическое изменение (Dawkins, 19). 82), одним из показательных случаев является социальная организация муравьиной колонии (Wang et al., 2013).
82), одним из показательных случаев является социальная организация муравьиной колонии (Wang et al., 2013).
Дифференциальная часть родства GP
Как определено выше, родство GP охватывает генетическое различие и фенотипическое различие. Связь различия как на генетическом, так и на фенотипическом уровне довольно абстрактна и может соответствовать трем различным различиям в живом мире: (#1) различие между двумя репродуктивно изолированными таксонами (живущими или вымершими), (# 2) различие, сегрегирующее внутри популяции, и (3) различие, впервые появившееся в ходе эволюции, между организмом, имеющим наследственный аллель/признак, и его прямым потомком, развившим новый аллель/признак. Следует отметить, что изменчивость фенотипа не всегда сразу следует за появлением новой вызывающей мутации, но может появиться позже из-за единичного набора аллелей, сегрегирующих в популяции. Например, новый фенотип рецессивных панцирей появился в популяции пресноводной колюшки, когда рецессивный 9Аллель 0052 EDA , уже присутствующий на криптических уровнях, оказался в гомозиготном состоянии у одного человека (Colosimo et al. , 2005; Jones et al., 2012). Главный концептуальный прорыв, сделанный Чарльзом Дарвином, заключался в том, чтобы связать изменчивость среди особей внутри скрещивающейся группы (различие № 2) с изменчивостью между таксономическими группами в пространстве и времени (различие № 1; Левонтин, 1974а).
, 2005; Jones et al., 2012). Главный концептуальный прорыв, сделанный Чарльзом Дарвином, заключался в том, чтобы связать изменчивость среди особей внутри скрещивающейся группы (различие № 2) с изменчивостью между таксономическими группами в пространстве и времени (различие № 1; Левонтин, 1974а).
Отметим также, что определенные фенотипические изменения могут проявляться на уровне всего организма, когда «причинная» мутация сопровождается дополнительными соматическими мутациями, которые весьма вероятны. Например, у женщин, несущих аллель дикого типа и мутантный аллель BRCA1 , клетки могут продуцировать белки BRCA1 дикого типа, поскольку они несут одну копию аллеля BRCA1 дикого типа. Тем не менее, у этих женщин риск развития рака груди или яичников к 70 годам составляет до 80% по сравнению с женщинами, имеющими две копии дикого типа BRCA1 , из-за появления дополнительных вредных мутаций в диком типе BRCA1 . аллель в их соматических клетках молочной железы (Narod and Foulkes, 2004).
Важно отметить, что разница GP всегда определяется относительно интересующей популяции или таксона (Sober, 1988). В менее развитых с медицинской точки зрения странах люди, несущие две дефектные копии гена фенилаланингидроксилазы, имеют серьезные проблемы со здоровьем, включая судороги и умственную отсталость. Напротив, в большинстве развитых стран такие люди диагностируются при рождении и имеют нормальную продолжительность жизни с нормальным умственным развитием благодаря диете с ограничением фенилаланина (Armstrong and Tyler, 1955). Таким образом, взаимосвязь с GP, включающая мутацию с дефектом фенилаланингидроксилазы, зависит от контекста: мутация связана с проблемами со здоровьем в менее развитых в медицинском отношении странах, но не в других странах. Этот пример показывает, что причинно-следственная связь между генетическим изменением и связанным с ним фенотипическим изменением может скрывать множество встроенных параметров (например, медицинскую практику в случае фенилаланингидроксилазы) в пределах при прочих равных условиях допущение «при прочих равных условиях».
Таким образом, связь GP лучше всего рассматривать как связь между двумя вариациями, одна на уровне генотипа, а другая на уровне фенотипа. Человеческий разум может разрабатывать концепции возрастающей абстракции: концепции вещей (например, клетки), концепции изменения (например, эволюции) и концепции отношений (например, гомологии; Cassirer, 1910; Simondon, 1968). Здесь понятие отношения ВП устанавливает отношение между двумя меняет (генетические и фенотипические). В следующих абзацах мы покажем, что по сравнению с использованием интуитивных представлений о вещах этот обходной путь через усиление абстракции может оказаться более эффективным для лучшего понимания фенотипического разнообразия.
Выше мы утверждали, что при размышлении о связи между генотипами и фенотипами следует всегда помнить о дифференциальном подходе. GWAS, представляющие собой наиболее популярный метод выявления геномных локусов, ассоциированных со сложными признаками в популяциях, основаны на анализе различий (Visscher et al. , 2012). Тем не менее, в современных исследованиях дифференцированная точка зрения иногда неявно отвергается. Когда наблюдается влияние нескольких факторов на фенотипические признаки ( Рисунок ), дифференциальный взгляд считается слишком упрощенным, и исследователи часто предпочитают сосредотачиваться на фенотипах отдельных особей, не связывая их явно с фенотипическим эталоном.
, 2012). Тем не менее, в современных исследованиях дифференцированная точка зрения иногда неявно отвергается. Когда наблюдается влияние нескольких факторов на фенотипические признаки ( Рисунок ), дифференциальный взгляд считается слишком упрощенным, и исследователи часто предпочитают сосредотачиваться на фенотипах отдельных особей, не связывая их явно с фенотипическим эталоном.
В большинстве современных статей проблема связи генотипа с фенотипом формулируется в терминах карт генотипа и фенотипа. Первая карта ВП была представлена Ричардом Левонтином в его книге «Генетическая основа эволюционных изменений» (Левонтин, 1974а; ).0364). Он указал средний генотип популяции как точку в пространстве всех возможных генотипов (пространство G) и средний фенотип той же популяции как соответствующую точку в пространстве всех возможных фенотипов (пространство P). Таким образом, эволюционный процесс был разбит на четыре этапа: (1) средний фенотип возникает в результате развития различных генотипов в различных условиях; (2) миграция, спаривание и естественный отбор действуют в пространстве P, чтобы изменить средний фенотип исходной популяции на средний фенотип особей, которые будут иметь потомство; (3) идентичность успешных родителей определяет, какие генотипы сохраняются; и (4) генетические процессы, такие как мутация и рекомбинация, изменяют положение в G-пространстве.
Открыть в отдельном окне
Три текущих графических представления карт GP. (A) Ранняя версия карты GP, предложенная Левонтином (1974a). (B) Карта GP, где каждая точка представляет одного человека (Houle et al., 2010; Gjuvsland et al., 2013; Salazar-Ciudad and Marín-Riera, 2013). (C) Взаимосвязь между признаками и генами, описанная Вагнером (1996). Подробности смотрите в тексте.
В другом распространенном графическом представлении ( Рисунок ), точка в пространстве G и соответствующая ей точка в пространстве P соответствуют генотипу и фенотипу отдельной особи (Fontana, 2002; Landry and Rifkin, 2012). При таком представлении абстрактный объект, который мы определили выше как отношение ГП, будет соответствовать «ходу» в пространстве генотипов, связанному с «ходом» в пространстве фенотипа (или, лучше, сумме нескольких «ходов» в пространстве генотипа, и пространства фенотипов, потому что несколько различных геномов могут нести два альтернативных аллеля данного родства GP). В третьем представлении, выдвинутом Вагнером (1996; Рисунок ), отдельные гены связаны с отдельными признаками.
В третьем представлении, выдвинутом Вагнером (1996; Рисунок ), отдельные гены связаны с отдельными признаками.
Хотя эти три графических представления карт ВП могут облегчить наше понимание некоторых аспектов биологии, во всех из них взаимосвязь ВП и дифференциальное представление понять нелегко. Вызывает недоумение тот факт, что первым человеком, нарисовавшим такую карту ВП, был Ричард Левонтин, красноречивый сторонник дифференциального взгляда (см., например, его предисловие к Oyama, 2000, шедевр убеждения). Поскольку эти графики сосредоточены на индивидуальных, а не на дифференциальных объектах, мы полагаем, что эти три репрезентации имплицитно побуждают нас вернуться к более интуитивной идее об одном генотипе, связанном с одним фенотипом. Упускание из виду дифференциального взгляда также может происходить с точки зрения молекулярной биологии, где белки рассматриваются как имеющие причинные эффекты сами по себе, такие как фосфорилирование субстрата или связывание с последовательностью ДНК. Из-за двух запутанных определений гена, либо как кодирующего белок, либо как вызывающего фенотипическое изменение (Griffiths and Stotz, 2013), легко перейти от дифференциального взгляда к недифференциальному взгляду на отношения GP.
Из-за двух запутанных определений гена, либо как кодирующего белок, либо как вызывающего фенотипическое изменение (Griffiths and Stotz, 2013), легко перейти от дифференциального взгляда к недифференциальному взгляду на отношения GP.
Таким образом, многие современные ментальные представления о связи между генотипом и фенотипом имплицитно отвергают дифференциальную точку зрения. Теперь мы покажем, что дифференциальная точка зрения совместима с тем фактом, что на фенотипические черты влияет сложная комбинация множества факторов, и что мы можем найти соответствующее схематическое представление взаимосвязей GP.
Разложение организма на элементарные единицы, такие как анатомические структуры, сыграло важную роль во многих биологических дисциплинах, таких как физиология, палеонтология и эволюция. Однако вопрос состоит в том, чтобы определить разложение на признаки, наиболее адекватное интересующему вопросу. Для вопросов, связанных с отношениями между органами различных особей или видов (таких как гомология), может быть уместно сохранить традиционную декомпозицию на анатомические структуры (Wagner, 2014). Рихард Левонтин и Гюнтер Вагнер определили характеры как элементы внутри организма, которые отвечают на адаптивные вызовы и представляют собой квазинезависимые единицы эволюционных изменений (Левонтин, 19).78; Вагнер, 2000). Их определение касается абсолютных признаков, наблюдаемых у отдельных организмов (например, форма крыла или количество пальцев у особи), и поэтому далеко от дифференциального взгляда. Здесь, чтобы лучше понять эволюцию и фенотипическое разнообразие живого мира, мы предлагаем разложить наблюдаемые признаки организма на множество элементарных вариаций ГП, которые накапливались в течение многих поколений, начиная с исходного состояния. Мы настаиваем на том, что с этой точки зрения персонажи — это не конкретные объекты (например, кожа), а абстрактные сущности, определяемые существованием различия между двумя возможными наблюдаемыми состояниями (например, цветом кожи). В качестве аналогии можно представить два способа изготовления изношенной кожаной обуви определенной формы.
Рихард Левонтин и Гюнтер Вагнер определили характеры как элементы внутри организма, которые отвечают на адаптивные вызовы и представляют собой квазинезависимые единицы эволюционных изменений (Левонтин, 19).78; Вагнер, 2000). Их определение касается абсолютных признаков, наблюдаемых у отдельных организмов (например, форма крыла или количество пальцев у особи), и поэтому далеко от дифференциального взгляда. Здесь, чтобы лучше понять эволюцию и фенотипическое разнообразие живого мира, мы предлагаем разложить наблюдаемые признаки организма на множество элементарных вариаций ГП, которые накапливались в течение многих поколений, начиная с исходного состояния. Мы настаиваем на том, что с этой точки зрения персонажи — это не конкретные объекты (например, кожа), а абстрактные сущности, определяемые существованием различия между двумя возможными наблюдаемыми состояниями (например, цветом кожи). В качестве аналогии можно представить два способа изготовления изношенной кожаной обуви определенной формы. Можно либо собрать разные атомы в одну организацию, либо можно купить в магазине ботинок, а затем подвергнуть его ряду механических воздействий. Мы естественно склонны сравнивать организмы с машинами и мыслить в терминах частей, которые должны быть собраны, чтобы создать функциональное целое. Однако безудержной метафоры дизайнера или создателя недостаточно для понимания происхождения современных организмов (Coen, 2012). Чтобы понять фенотипические особенности данного организма, более эффективно разложить его на абстрактные изменения, которые происходили последовательно на протяжении эволюционного времени, а не на протяжении времени развития. Исходное состояние является гипотетическим предком изучаемого организма.
Можно либо собрать разные атомы в одну организацию, либо можно купить в магазине ботинок, а затем подвергнуть его ряду механических воздействий. Мы естественно склонны сравнивать организмы с машинами и мыслить в терминах частей, которые должны быть собраны, чтобы создать функциональное целое. Однако безудержной метафоры дизайнера или создателя недостаточно для понимания происхождения современных организмов (Coen, 2012). Чтобы понять фенотипические особенности данного организма, более эффективно разложить его на абстрактные изменения, которые происходили последовательно на протяжении эволюционного времени, а не на протяжении времени развития. Исходное состояние является гипотетическим предком изучаемого организма.
Наблюдается, что некоторые мутации (квалифицированные как плейотропные) поражают сразу несколько органов, в то время как другие изменяют только один за раз (Paaby, Rockman, 2013; Zhang, Wagner, 2013). Для плейотропных мутаций мы считаем, что родство ГП должно включать все фенотипические изменения (в разных органах, на разных стадиях и т. д.), связанные с генетическим различием. Например, мутация V370A рецептора EDAR связана не только с толщиной волос, но и с изменением плотности потовых и молочных желез в азиатских популяциях (Камберов и др., 2013). Отношения GP в таких случаях являются один-ко-многим. Рассмотрение кожи и глаза как независимых анатомических модулей человеческого тела может показаться уместным для многих эволюционных изменений, но несколько неадекватным в тех случаях, когда эти два органа одновременно развили новый признак пигментации в результате единственной мутации в Ген SLC45A2 (Liu et al., 2013). Рассуждения в терминах взаимосвязей ГП снимают проблему нахождения соответствующей декомпозиции на элементарные анатомические структуры. Сами элементарные отношения ГП представляются адекватными полунезависимыми модулями, комбинация которых может объяснить наблюдаемые характеристики организма.
д.), связанные с генетическим различием. Например, мутация V370A рецептора EDAR связана не только с толщиной волос, но и с изменением плотности потовых и молочных желез в азиатских популяциях (Камберов и др., 2013). Отношения GP в таких случаях являются один-ко-многим. Рассмотрение кожи и глаза как независимых анатомических модулей человеческого тела может показаться уместным для многих эволюционных изменений, но несколько неадекватным в тех случаях, когда эти два органа одновременно развили новый признак пигментации в результате единственной мутации в Ген SLC45A2 (Liu et al., 2013). Рассуждения в терминах взаимосвязей ГП снимают проблему нахождения соответствующей декомпозиции на элементарные анатомические структуры. Сами элементарные отношения ГП представляются адекватными полунезависимыми модулями, комбинация которых может объяснить наблюдаемые характеристики организма.
В рамках дифференциальной концепции отношений ГП одним из важнейших моментов является разложение наблюдаемых признаков на ряд полунезависимых фенотипических вариаций, то есть выявление элементарных изменений, произошедших в ходе эволюции. Доступны экспериментальные подходы для разложения данного фенотипического различия на соответствующие более тонкие подвариации. Например, скрещивание растений с разной формой листьев дает потомство, которое демонстрирует составной набор промежуточных форм листьев. Анализ основных компонентов выявил элементарные изменения формы листа, которые вместе могут объяснить разницу в форме между родительскими линиями и, по-видимому, вызваны разными геномными областями (Langlade et al., 2005). Это наводит на мысль, что «сумма затемняет части». То, что мы традиционно считаем сложными признаками, может быть составлено из более простых признаков, более поддающихся генетическому анализу. Другим ярким примером является пигментация живота в Группа Drosophila dunni . Взятые как одна переменная, уровни пигментации демонстрируют сложную генетическую архитектуру, но разложение взрослых паттернов на анатомические субъединицы раскрывает дискретный генетический контроль для каждого субпризнака (Hollocher et al.
Доступны экспериментальные подходы для разложения данного фенотипического различия на соответствующие более тонкие подвариации. Например, скрещивание растений с разной формой листьев дает потомство, которое демонстрирует составной набор промежуточных форм листьев. Анализ основных компонентов выявил элементарные изменения формы листа, которые вместе могут объяснить разницу в форме между родительскими линиями и, по-видимому, вызваны разными геномными областями (Langlade et al., 2005). Это наводит на мысль, что «сумма затемняет части». То, что мы традиционно считаем сложными признаками, может быть составлено из более простых признаков, более поддающихся генетическому анализу. Другим ярким примером является пигментация живота в Группа Drosophila dunni . Взятые как одна переменная, уровни пигментации демонстрируют сложную генетическую архитектуру, но разложение взрослых паттернов на анатомические субъединицы раскрывает дискретный генетический контроль для каждого субпризнака (Hollocher et al. , 2000). Более известным случаем является эволюция цвета тела пляжных мышей. Различие в окраске между светлыми пляжными мышами и темными мышами можно разложить на отдельные фенотипы (оттенок спины, яркость спины, ширина полосы на хвосте и дорсовентральная граница), которые все связаны с различными мутациями в Ген Agouti (Linnen et al., 2013; Рисунок ). Каждый генетический локус Agouti , по-видимому, предназначен для спецификации пигментации в данной части тела. Вместе они образуют группу тесно связанных локусов, связанных с изменениями пигментации шерсти.
, 2000). Более известным случаем является эволюция цвета тела пляжных мышей. Различие в окраске между светлыми пляжными мышами и темными мышами можно разложить на отдельные фенотипы (оттенок спины, яркость спины, ширина полосы на хвосте и дорсовентральная граница), которые все связаны с различными мутациями в Ген Agouti (Linnen et al., 2013; Рисунок ). Каждый генетический локус Agouti , по-видимому, предназначен для спецификации пигментации в данной части тела. Вместе они образуют группу тесно связанных локусов, связанных с изменениями пигментации шерсти.
Открыть в отдельном окне
Эволюция светлоокрашенных пляжных мышей обусловлена несколькими мутациями с выраженными эффектами пигментации в локусе Agouti . Темный и светлый фенотипы можно разложить на четыре фенотипических признака, которые связаны с различными однонуклеотидными полиморфизмами (SNP, цветные точки), расположенными в ген агути . Показаны только SNP с предполагаемым коэффициентом отбора светлого аллеля выше 0,1. Кодирующие экзоны представлены темными прямоугольниками, а нетранслируемые экзоны — белыми прямоугольниками. Адаптировано из Linnen et al. (2013).
Показаны только SNP с предполагаемым коэффициентом отбора светлого аллеля выше 0,1. Кодирующие экзоны представлены темными прямоугольниками, а нетранслируемые экзоны — белыми прямоугольниками. Адаптировано из Linnen et al. (2013).
Хотя сложные признаки не всегда могут быть сведены к набору простых взаимосвязей GP, возможно, что такие признаки, как рост взрослого человека, наиболее характерный количественный признак, который, по прогнозам, состоит из множества генетических эффектов небольшого размера (Fisher, 1930), также могут быть разложены на элементарные вариации, каждая из которых объясняет более дискретные субпризнаки. В то время как некоторые детерминанты человеческого роста, такие как LIN28B были связаны с ростом взрослого человека в разном возрасте, другие гены достигли статистической значимости только в стадийных исследованиях, посвященных росту плода и скорости роста в период полового созревания (Lettre, 2011). Другими словами, эти данные предполагают, что рост человека может быть составным признаком, который модулируется несколькими отношениями GP, каждое из которых действует на разных фазах развития.
Взаимодействие генов с окружающей средой (GxE) происходит, когда фенотипический эффект данного генетического изменения зависит от параметров окружающей среды. Сходным образом, эпистаз или взаимодействие GxG возникает, когда фенотипический эффект данного генетического изменения зависит от аллельного состояния по крайней мере одного другого локуса (Phillips, 2008; Hansen, 2013). Появляется все больше свидетельств того, что взаимодействия GxG и GxE имеют фундаментальное значение для понимания эволюции и наследования сложных признаков (Gilbert and Epel, 2009).; Хансен, 2013). Мы предполагаем, что оба явления могут быть интегрированы в базовую дифференциальную структуру GP, где взаимодействия GxG и GxE вводят уровень контекстной зависимости и приводят к различиям, встроенным в различия.
Разница в цветовой пигментации между темными и светлыми пляжными мышами, упомянутая ранее ( Рисунок ), обусловлена не только мутациями в Agouti , но и кодирующей мутацией в гене MC1R , который уменьшает пигментацию (Steiner et и др. , 2007; Рисунок ). Эффект мутации MC1R виден только в присутствии ассоциированного со светлым цветом производного гаплотипа Agouti . Здесь считается, что локус Mc1R эпистатически взаимодействует с локусом Agouti . В этом случае мы предполагаем, что отношение GP включает не одно фенотипическое различие, а два возможных фенотипических различия (изменение пигментации шерсти или полное отсутствие изменений). Выбор между этими двумя фенотипическими различиями определяется генетическим фоном (здесь на Агути местонахождение). Дифференциальный взгляд, таким образом, остается относительно простым для взаимодействия двух локусов: зависимость фенотипа от контекста транслируется в выбор между двумя возможными фенотипическими различиями. Мы предполагаем, что отношения GP, включающие мутацию, подверженную множественным эпистатическим взаимодействиям, должны включать все возможные фенотипические различия, которые могут возникнуть в результате мутации во всех генетических фонах.
, 2007; Рисунок ). Эффект мутации MC1R виден только в присутствии ассоциированного со светлым цветом производного гаплотипа Agouti . Здесь считается, что локус Mc1R эпистатически взаимодействует с локусом Agouti . В этом случае мы предполагаем, что отношение GP включает не одно фенотипическое различие, а два возможных фенотипических различия (изменение пигментации шерсти или полное отсутствие изменений). Выбор между этими двумя фенотипическими различиями определяется генетическим фоном (здесь на Агути местонахождение). Дифференциальный взгляд, таким образом, остается относительно простым для взаимодействия двух локусов: зависимость фенотипа от контекста транслируется в выбор между двумя возможными фенотипическими различиями. Мы предполагаем, что отношения GP, включающие мутацию, подверженную множественным эпистатическим взаимодействиям, должны включать все возможные фенотипические различия, которые могут возникнуть в результате мутации во всех генетических фонах. Среди всех возможных фенотипических вариаций фенотипическое различие, которое будет наблюдаться, определяется другими генетическими локусами. В общем, взаимодействия GxG включают несколько сайтов, разбросанных по всему геному (Bloom et al., 2013).
Среди всех возможных фенотипических вариаций фенотипическое различие, которое будет наблюдаться, определяется другими генетическими локусами. В общем, взаимодействия GxG включают несколько сайтов, разбросанных по всему геному (Bloom et al., 2013).
Открыть в отдельном окне
Взаимодействие генов с окружающей средой (GxE) и GxG. (A) Мутация, кодирующая npr-1 , влияет на поведение нематод при агрегации при уровне кислорода 21%, но не при 10% (Andersen et al., 2014). (B) Мутация Mc1R, кодирующая , влияет на пигментацию тела мыши в присутствии доминантных светлых аллелей Agouti , но не в гомозиготном фоне Agouti по рецессивному темному аллелю (Steiner et al., 2007).
Примером взаимодействия GxE (см. также Рисунок ) является природный аллель потери функции brx у растений Arabidopsis , который связан с ускоренным ростом и повышенной приспособленностью к кислым почвам, а также к сильно замедленный рост корней по сравнению с диким типом в нормальных почвах (Gujas et al. , 2012). Взаимодействия GxE обычно анализируются в виде нормы реакции , которая представляет все наблюдаемые черты с одним генотипом в различных средах (Johannsen, 1911; Sarkar, 1999). В случае взаимодействий GxE мы предполагаем, что отношения GP должны включать все возможные фенотипические изменения , которые могут быть вызваны ассоциированными генетическими изменениями в различных экспериментальных условиях. Таким образом, связанное с этим фенотипическое изменение представляет собой разницу между двумя нормами реакции. Примером из учебника является изменение правила температуры и размера у C. elegans . Как и большинство других животных, 9Нематоды 0052 C. elegans увеличиваются в размерах при низкой температуре, но лабораторный штамм C. elegans дикого типа, происходящий с Гавайских островов, не показывает изменений в размере тела при различных температурах. Аминокислотное изменение в кальций-связывающем белке ответственно за снижение способности гавайского штамма увеличиваться в размерах при низкой температуре (Kammenga et al.
, 2012). Взаимодействия GxE обычно анализируются в виде нормы реакции , которая представляет все наблюдаемые черты с одним генотипом в различных средах (Johannsen, 1911; Sarkar, 1999). В случае взаимодействий GxE мы предполагаем, что отношения GP должны включать все возможные фенотипические изменения , которые могут быть вызваны ассоциированными генетическими изменениями в различных экспериментальных условиях. Таким образом, связанное с этим фенотипическое изменение представляет собой разницу между двумя нормами реакции. Примером из учебника является изменение правила температуры и размера у C. elegans . Как и большинство других животных, 9Нематоды 0052 C. elegans увеличиваются в размерах при низкой температуре, но лабораторный штамм C. elegans дикого типа, происходящий с Гавайских островов, не показывает изменений в размере тела при различных температурах. Аминокислотное изменение в кальций-связывающем белке ответственно за снижение способности гавайского штамма увеличиваться в размерах при низкой температуре (Kammenga et al. , 2007). Здесь норма реакции (представляющая размер тела нематоды в диапазоне температур) различается между нематодами, и связанное с ней отношение GP охватывает разницу между этими двумя наклонами.
, 2007). Здесь норма реакции (представляющая размер тела нематоды в диапазоне температур) различается между нематодами, и связанное с ней отношение GP охватывает разницу между этими двумя наклонами.
Диапазон фенотипических вариаций, воплощенных в отношениях GP, подверженных взаимодействиям GxG и GxE, может быть весьма огромным, особенно в случаях, когда одна и та же мутация затрагивает несколько тканей, и когда на фенотипическую изменчивость каждой ткани влияют другие геномные локусы и по условиям окружающей среды. Фактически, фенотипические эффекты мутации всегда зависят от других фрагментов ДНК из того же генома, так что можно считать, что любые отношения GP испытывают эпистаз. Другими словами, генетический локус, влияющий на фенотип, никогда не действует независимо от других последовательностей ДНК. Например, данный аллель опсина будет приводить к определенным свойствам цветового зрения только в том случае, если глаз сформирован и если этот глаз получает свет во время своего развития, что позволяет сформировать эффективные зрительные нейронные цепи. Для того чтобы дифференцированный взгляд был приемлемым, мы советуем не рассматривать все возможные генетические предпосылки и условия окружающей среды, а ограничивать возможности потенциальной средой и выделять аллели, которые имеют отношение к интересующей популяции (Sober, 19).88).
Для того чтобы дифференцированный взгляд был приемлемым, мы советуем не рассматривать все возможные генетические предпосылки и условия окружающей среды, а ограничивать возможности потенциальной средой и выделять аллели, которые имеют отношение к интересующей популяции (Sober, 19).88).
Таким образом, при наличии эпистаза или взаимодействия GxE генетическое изменение связано не с одним фенотипическим отличием, а с несколькими возможными фенотипическими различиями, среди которых будет достигнуто одно, в зависимости от окружающей среды и генетического фона. Зависимость от контекста может быть схематически представлена как различия ГП, встроенные в другие различия генотипа и среды.
Дифференциальный взгляд на генетические и экологические эффекты на фенотипы
Как подчеркивают многие авторы (прежде всего Waddington, 1957; Oyama, 2000; Keller, 2010), гены и среда действуют на фенотип совместно, и в большинстве случаев невозможно отделить влияние одного от другого. Здесь мы показываем, что рассуждения с точки зрения различий помогают прояснить сравнение между генетическими и экологическими эффектами на фенотипы. Однако мы выделяем некоторые случаи, когда сравнение остается затруднительным.
Однако мы выделяем некоторые случаи, когда сравнение остается затруднительным.
По аналогии с отношением ГП мы можем определить отношение среда-фенотип как вариацию среды (две среды), связанное с ней фенотипическое изменение (различные фенотипические состояния) и их взаимосвязь. Например, у многих видов черепах изменение температуры во время развития яиц связано с половыми различиями между самцами и самками (9).0363 Рисунок ) и по крайней мере шесть переходов от определения пола в окружающей среде к генетическому ( Рисунок ) произошли в филогенезе черепах (Pokorná and Kratochvíl, 2009). В этом случае средовые и генетические эффекты можно сопоставить: половые хромосомы и температура оказывают одинаковое фенотипическое влияние на черепах. Такие наблюдения привели Уэст-Эберхард (West-Eberhard, 2003, 2005) к предложению гипотезы «гены как последователи», которая предполагает, что новые фенотипические состояния с большей вероятностью возникают в первую очередь из-за изменения окружающей среды, чем из-за генетической мутации, и что мутации происходят только позже, при изменении порога экспрессии нового признака. Уэст-Эберхард (2003, 2005) экстраполировал различия, сегрегирующие внутри популяций (различие № 2), на различия, возникшие во времени во время эволюции популяции (различие № 1).
Уэст-Эберхард (2003, 2005) экстраполировал различия, сегрегирующие внутри популяций (различие № 2), на различия, возникшие во времени во время эволюции популяции (различие № 1).
Открыть в отдельном окне
Связь между средой и фенотипом по сравнению с зависимостью от GP для определения пола у черепах. (A) У некоторых видов температура во время эмбрионального развития определяет пол взрослой особи. (B) У других пол определяется половыми хромосомами.
Независимая эволюция направленной лево-правой асимметрии от симметричных предков во множественных линиях предоставила главный аргумент в поддержку гипотезы «ген как последователь» (Palmer, 2004). В рамках этой схемы оговаривается, что направленная асимметрия, при которой все люди односторонние, часто развилась из состояния «случайной асимметрии», когда направленность будет зависеть от факторов окружающей среды и, таким образом, различаться между генетически идентичными людьми. Например, самая сильная клешня омара будет развиваться в зависимости от использования и имеет априори равные вероятности развития с левой или с правой стороны. Мы можем видеть, как здесь работает формула «гены как последователи»: окружающая среда запускает асимметрию, и позже в ходе эволюции некоторые генетические эффекты могут изменить ее направленность в ту или иную сторону. Но в то время как асимметрия «происходит до того, как существует генетическая изменчивость, чтобы контролировать ее», дифференциальная точка зрения ясно дает понять, что генетическое влияние на направленность несопоставимо с влиянием окружающей среды, которое запускает асимметрию. Генетическое изменение приводит к переключению между окончательным 100% односторонним состоянием и начальным состоянием, при котором 50% случаев являются правосторонними и 50% левосторонними. Напротив, два альтернативных фенотипических состояния, возникающие в результате изменчивости в окружающей среде, считаются 100% правосторонним и 100% левосторонним. Этот пример показывает, что ради точности важно явно указать различия, которые учитываются в отношениях GP.
Мы можем видеть, как здесь работает формула «гены как последователи»: окружающая среда запускает асимметрию, и позже в ходе эволюции некоторые генетические эффекты могут изменить ее направленность в ту или иную сторону. Но в то время как асимметрия «происходит до того, как существует генетическая изменчивость, чтобы контролировать ее», дифференциальная точка зрения ясно дает понять, что генетическое влияние на направленность несопоставимо с влиянием окружающей среды, которое запускает асимметрию. Генетическое изменение приводит к переключению между окончательным 100% односторонним состоянием и начальным состоянием, при котором 50% случаев являются правосторонними и 50% левосторонними. Напротив, два альтернативных фенотипических состояния, возникающие в результате изменчивости в окружающей среде, считаются 100% правосторонним и 100% левосторонним. Этот пример показывает, что ради точности важно явно указать различия, которые учитываются в отношениях GP.
Дифференциальное представление обеспечивает теоретическую основу, которая может помочь в разработке экспериментов для исследования соответствующих переменных: можно сравнивать различные генотипы в фиксированной среде (классическая взаимосвязь GP), сравнивать реакцию фиксированного генотипа на две разные среды (фенотипическая пластичность). ), или сравнить чувствительность двух разных генотипов к двум разным средам (где фенотипическая вариация становится различием в различии; см., например, Engelman et al., 2009).; Томас, 2010).
), или сравнить чувствительность двух разных генотипов к двум разным средам (где фенотипическая вариация становится различием в различии; см., например, Engelman et al., 2009).; Томас, 2010).
Были разработаны различные количественные методы, чтобы отделить генетику от эффектов окружающей среды и количественно оценить взаимодействия GxE (Lynch and Walsh, 1998). Тем не менее, в определенных ситуациях может оказаться невозможным биологически значимым образом отделить генетические эффекты от воздействий окружающей среды, даже если рассуждать в терминах различий (Lewontin, 1974b). Популяции жука Calathus melanocephalus представлены двумя морфами: длиннокрылой и короткокрылой (Schwander, Leimar, 2011). Длиннокрылая морфа развивается только из гомозиготных особей по рецессивному аллелю, сегрегирующему в популяции, и только при хороших пищевых условиях. В этом случае генетические и средовые эффекты смешиваются (9).0363 Фигуры ). В теоретическом случае популяции, состоящей только из короткокрылых гетерозиготных животных, выращенных в условиях голодания, и длиннокрылых, за разницу крыльев между особями ответственны как гены, так и среда, и невозможно оценить соотношение факторов среды и среды. генетические эффекты, поскольку гены и окружающая среда действуют на различных уровнях сложной причинно-следственной связи между генотипами и фенотипами.
генетические эффекты, поскольку гены и окружающая среда действуют на различных уровнях сложной причинно-следственной связи между генотипами и фенотипами.
Открыть в отдельном окне
Перспективы взаимосвязи среда-фенотип и взаимосвязи GP для полиморфизма длины крыла у жука Calathus melanocephalus . (A) С точки зрения взаимосвязи среда-фенотип изменение условий питания связано с изменением размера крыльев, но только в гомозиготном фоне по рецессивному аллелю ( l ) локуса размера крыльев. (B) С точки зрения взаимосвязи GP генетическое изменение в локусе размера крыла связано с изменением размера крыла, но только при хороших условиях питания.
Другой случай, который ставит под сомнение классическое различие между окружающей средой и генетикой, — это когда добавление определенных симбиотических бактерий изменяет фенотип хозяина. Мыши, которых кормили штаммом бактерий Lactobacillus , демонстрируют меньшее поведение, связанное с тревогой, по сравнению с контрольными мышами, которых кормили бульоном без бактерий (Bravo et al. , 2011). Здесь разница в поведении вызвана переключением между присутствием или отсутствием определенного кишечного симбионта. Причиной фенотипических различий является не простое изменение в последовательности ДНК, не простое изменение окружающей среды, не связанное с генетическими изменениями, а переключение между присутствием и отсутствием фактора, который можно рассматривать как фактор окружающей среды, — бактерий, — который содержит ДНК, мутации которой могут также изменить фенотип хозяина.
, 2011). Здесь разница в поведении вызвана переключением между присутствием или отсутствием определенного кишечного симбионта. Причиной фенотипических различий является не простое изменение в последовательности ДНК, не простое изменение окружающей среды, не связанное с генетическими изменениями, а переключение между присутствием и отсутствием фактора, который можно рассматривать как фактор окружающей среды, — бактерий, — который содержит ДНК, мутации которой могут также изменить фенотип хозяина.
В заключение, рассуждения с точки зрения различий могут помочь прояснить сравнение между генетическими и экологическими эффектами на фенотипы. Тем не менее, вопросы не более чем простые. Поскольку гены и среда действуют на разных уровнях сложной причинной связи между генотипами и фенотипами, в некоторых случаях невозможно распутать обе причины.
Фенотипические различия, по-видимому, подпадают под две основные категории: либо наличие/отсутствие чего-то (например, волосы на теле или способность переваривать молоко), либо сдвиг между двумя альтернативами, которые оба присутствуют (например, два цвета волос). Точно так же со стороны генотипа мутация может соответствовать присутствию/отсутствию соответствующей последовательности ДНК или полиморфизму нуклеотидов. Дифференциальная точка зрения делает очевидным, что потеря фенотипа не обязательно связана с потерей генетического материала, и наоборот. Например, эволюционное приобретение темных пигментов, покрывающих всю шерсть животных, часто связывают с утратой Ген Mc1R (Gompel, Prud’homme, 2009). Кроме того, как ранее отмечал один из нас (приложение Stern and Orgogozo, 2008), усиление или потеря фенотипа субъективны. Например, выпадение волос также можно рассматривать как приобретение обнаженного эпидермиса. Большинство эпидермальных клеток насекомых дифференцируются в одно из этих двух альтернативных состояний, и в обоих состояниях участвуют большие сети регуляции генов. Неясно, какое фенотипическое состояние представляет собой выигрыш или потерю по сравнению с другим. Даже с точки зрения генотипа определение потерь и приобретений может быть затруднено.
Точно так же со стороны генотипа мутация может соответствовать присутствию/отсутствию соответствующей последовательности ДНК или полиморфизму нуклеотидов. Дифференциальная точка зрения делает очевидным, что потеря фенотипа не обязательно связана с потерей генетического материала, и наоборот. Например, эволюционное приобретение темных пигментов, покрывающих всю шерсть животных, часто связывают с утратой Ген Mc1R (Gompel, Prud’homme, 2009). Кроме того, как ранее отмечал один из нас (приложение Stern and Orgogozo, 2008), усиление или потеря фенотипа субъективны. Например, выпадение волос также можно рассматривать как приобретение обнаженного эпидермиса. Большинство эпидермальных клеток насекомых дифференцируются в одно из этих двух альтернативных состояний, и в обоих состояниях участвуют большие сети регуляции генов. Неясно, какое фенотипическое состояние представляет собой выигрыш или потерю по сравнению с другим. Даже с точки зрения генотипа определение потерь и приобретений может быть затруднено. Вставка мобильного элемента может сбить ген, тогда как делеция иногда может создать новый сайт связывания для активатора транскрипции. На самом деле, эволюционный выигрыш 9Экспрессия 0052 desatF в D. melanogaster произошла посредством серии из трех делеций, каждая из которых создавала гексамерный мотив, необходимый для экспрессии desatF (Shirangi et al., 2009).
Вставка мобильного элемента может сбить ген, тогда как делеция иногда может создать новый сайт связывания для активатора транскрипции. На самом деле, эволюционный выигрыш 9Экспрессия 0052 desatF в D. melanogaster произошла посредством серии из трех делеций, каждая из которых создавала гексамерный мотив, необходимый для экспрессии desatF (Shirangi et al., 2009).
Точно так же дифференциальная точка зрения на воздействие окружающей среды выдвигает на первый план ошибочность различия между разрешительными и инструктивными сигналами. Разрешающий сигнал связан с наличием/отсутствием фенотипа, а инструктивный сигнал — со сдвигом между двумя присутствующими альтернативами. Как утверждалось выше, эти различия на фенотипическом уровне не являются четкими.
В заключение мы предлагаем с осторожностью использовать терминологию «прибыль/убыток» и «поучительная/разрешительная» терминология.
Ожидается, что мутация вызовет в некоторой степени воспроизводимую фенотипическую изменчивость в популяции. Такая воспроизводимость фенотипического исхода необходима для обеспечения генетической эволюции и адаптации путем естественного отбора (Lewontin, 1974a; Kirschner and Gerhart, 1998). В самом деле, вновь образованный аллель, который будет генерировать еще один фенотип каждый раз, когда он попадает в другой организм, не будет подвергаться естественному отбору. Рассуждение с точки зрения изменчивости, а не рассмотрение аллелей как изолированных объектов, проясняет, что конкуренция происходит между аллелями, которые охватывают один и тот же генетический локус. Естественный отбор воздействует непосредственно на аллельную вариацию, которая устойчиво связана с данной фенотипической вариацией, что и является родством ГП. Таким образом, отношения ГП являются базовой единицей эволюционных изменений, на которые действует естественный отбор.
Такая воспроизводимость фенотипического исхода необходима для обеспечения генетической эволюции и адаптации путем естественного отбора (Lewontin, 1974a; Kirschner and Gerhart, 1998). В самом деле, вновь образованный аллель, который будет генерировать еще один фенотип каждый раз, когда он попадает в другой организм, не будет подвергаться естественному отбору. Рассуждение с точки зрения изменчивости, а не рассмотрение аллелей как изолированных объектов, проясняет, что конкуренция происходит между аллелями, которые охватывают один и тот же генетический локус. Естественный отбор воздействует непосредственно на аллельную вариацию, которая устойчиво связана с данной фенотипической вариацией, что и является родством ГП. Таким образом, отношения ГП являются базовой единицей эволюционных изменений, на которые действует естественный отбор.
Главное открытие последних 20 лет состоит в том, что изменчивость в определенных генетических локусах приводит к сопоставимой фенотипической изменчивости не только у разных особей одной популяции, но и у чрезвычайно разных таксонов (Martin and Orgogozo, 2013b). Другими словами, определенные отношения GP являются таксономически надежными и присутствуют у большого количества видов. Это означает, что генетические и экологические предпосылки оставались относительно постоянными или неоднократно появлялись на протяжении эволюции, что позволяло генетическим локусам генерировать сходные фенотипические изменения в различных таксономических группах. Это важное открытие было совершенно неожиданным около 50 лет назад. Долгое время ожидалось, что сингулярность, наблюдаемая в живом мире, будет отражать сравнимую сингулярность на генетическом уровне, затрагивая несопоставимые и неконсервативные гены, специфичные для каждой линии (Mayr, 19).63). Как однажды предположил Майр (1963) в 1963 году: «Многое из того, что было известно о физиологии генов, делает очевидным, что поиск гомологичных генов совершенно бесполезен, за исключением очень близких родственников […]. Поговорка «Многие дороги ведут в Рим» справедлива как в эволюции, так и в повседневных делах» (Mayr, 1963).
Другими словами, определенные отношения GP являются таксономически надежными и присутствуют у большого количества видов. Это означает, что генетические и экологические предпосылки оставались относительно постоянными или неоднократно появлялись на протяжении эволюции, что позволяло генетическим локусам генерировать сходные фенотипические изменения в различных таксономических группах. Это важное открытие было совершенно неожиданным около 50 лет назад. Долгое время ожидалось, что сингулярность, наблюдаемая в живом мире, будет отражать сравнимую сингулярность на генетическом уровне, затрагивая несопоставимые и неконсервативные гены, специфичные для каждой линии (Mayr, 19).63). Как однажды предположил Майр (1963) в 1963 году: «Многое из того, что было известно о физиологии генов, делает очевидным, что поиск гомологичных генов совершенно бесполезен, за исключением очень близких родственников […]. Поговорка «Многие дороги ведут в Рим» справедлива как в эволюции, так и в повседневных делах» (Mayr, 1963). Другими словами, ожидалось, что генетические локусы, которые делают человека мужчиной, будут отличаться от тех, которые делают собаку или рыбу. Позже, в 80–90-х годах, некоторые исследователи предположили, что эволюция происходит за счет мутаций в консервативных генах, кодирующих белок (Romero-Herrera et al., 19).78; Перуц, 1983; Стюарт и др., 1987; Carroll et al., 2005), но у них было мало экспериментальных данных, подтверждающих их точку зрения (Tautz and Schmid, 1998). Накопившиеся на сегодняшний день данные о мутациях, ответственных за естественную изменчивость, ясно показывают, что разнообразие живых организмов имеет общую генетическую основу как минимум в трех пунктах. Во-первых, сравнительная биология развития показала, что животные имеют общие наборы ключевых регуляторных генов с законсервированными функциями (Wilkins, 2002, 2014; Carroll et al., 2005). Во-вторых, большинство межвидовых различий у животных и растений, для которых хотя бы частично идентифицирована лежащая в основе генетическая основа (154 случая из 160), обусловлено мутациями в гомологичных генах, и очень немногие (6/160) обусловлены новыми генами.
Другими словами, ожидалось, что генетические локусы, которые делают человека мужчиной, будут отличаться от тех, которые делают собаку или рыбу. Позже, в 80–90-х годах, некоторые исследователи предположили, что эволюция происходит за счет мутаций в консервативных генах, кодирующих белок (Romero-Herrera et al., 19).78; Перуц, 1983; Стюарт и др., 1987; Carroll et al., 2005), но у них было мало экспериментальных данных, подтверждающих их точку зрения (Tautz and Schmid, 1998). Накопившиеся на сегодняшний день данные о мутациях, ответственных за естественную изменчивость, ясно показывают, что разнообразие живых организмов имеет общую генетическую основу как минимум в трех пунктах. Во-первых, сравнительная биология развития показала, что животные имеют общие наборы ключевых регуляторных генов с законсервированными функциями (Wilkins, 2002, 2014; Carroll et al., 2005). Во-вторых, большинство межвидовых различий у животных и растений, для которых хотя бы частично идентифицирована лежащая в основе генетическая основа (154 случая из 160), обусловлено мутациями в гомологичных генах, и очень немногие (6/160) обусловлены новыми генами. которые, тем не менее, представляют собой дубликаты существующих генов (Martin and Orgogozo, 2013b). В-третьих, было показано, что множественные случаи сходных фенотипических изменений связаны с мутациями одних и тех же гомологичных генов в независимых линиях (9).0363 Таблица ), иногда через большие филогенетические расстояния. Например, разница в пигментации между белыми и оранжевыми бенгальскими тиграми недавно была сопоставлена с единственной мутацией в гене белка-транспортера SLC45A2 (Xu et al., 2013), и этот ген также был связан с гипопигментацией глаз, кожи , волосы и перья у людей и кур (Xu et al., 2013; Figure ). Более ярким примером является недавняя эволюция устойчивости к токсинам у трех видов, которые разошлись более 500 миллионов лет назад – моллюска, змеи и иглобрюха – посредством замены одной и той же аминокислоты в законсервированном гене (Bricelj et al., 2005). ; Geffeney et al., 2005; Venkatesh et al., 2005; Feldman et al., 2012).
которые, тем не менее, представляют собой дубликаты существующих генов (Martin and Orgogozo, 2013b). В-третьих, было показано, что множественные случаи сходных фенотипических изменений связаны с мутациями одних и тех же гомологичных генов в независимых линиях (9).0363 Таблица ), иногда через большие филогенетические расстояния. Например, разница в пигментации между белыми и оранжевыми бенгальскими тиграми недавно была сопоставлена с единственной мутацией в гене белка-транспортера SLC45A2 (Xu et al., 2013), и этот ген также был связан с гипопигментацией глаз, кожи , волосы и перья у людей и кур (Xu et al., 2013; Figure ). Более ярким примером является недавняя эволюция устойчивости к токсинам у трех видов, которые разошлись более 500 миллионов лет назад – моллюска, змеи и иглобрюха – посредством замены одной и той же аминокислоты в законсервированном гене (Bricelj et al., 2005). ; Geffeney et al., 2005; Venkatesh et al., 2005; Feldman et al., 2012). Такие поразительные паттерны генетического повторения в настоящее время обнаружены для более чем 100 генов животных и растений (Martin and Orgogozo, 2013b). Несмотря на существующие методологические предубеждения в пользу консервативных генов при поиске локусов количественных признаков (Rockman, 2012; Martin and Orgogozo, 2013b), уровень генетического повторения остается поразительным и предполагает, что для эволюции по крайней мере некоторых фенотипических различий требуется относительно мало генетических путей. ведут в Рим (Stern, 2013). В наши дни не следует удивляться тому, что фрагмент ДНК, связанный со сложной окраской крыльев в одном 9Вид бабочек 0052 Heliconius обеспечивает сходные крылья и коллективную защиту от одних и тех же хищников при введении в геном других бабочек (Supple et al., 2014). То, что делает собаку собакой или человека человеком, теперь частично объясняется уникальным набором таксономически устойчивых отношений ГП, которые обнаруживаются во многих ветвях линии.
Такие поразительные паттерны генетического повторения в настоящее время обнаружены для более чем 100 генов животных и растений (Martin and Orgogozo, 2013b). Несмотря на существующие методологические предубеждения в пользу консервативных генов при поиске локусов количественных признаков (Rockman, 2012; Martin and Orgogozo, 2013b), уровень генетического повторения остается поразительным и предполагает, что для эволюции по крайней мере некоторых фенотипических различий требуется относительно мало генетических путей. ведут в Рим (Stern, 2013). В наши дни не следует удивляться тому, что фрагмент ДНК, связанный со сложной окраской крыльев в одном 9Вид бабочек 0052 Heliconius обеспечивает сходные крылья и коллективную защиту от одних и тех же хищников при введении в геном других бабочек (Supple et al., 2014). То, что делает собаку собакой или человека человеком, теперь частично объясняется уникальным набором таксономически устойчивых отношений ГП, которые обнаруживаются во многих ветвях линии.
Определенные отношения между средой и фенотипом также таксономически устойчивы. Например, у большинства таксонов на размер тела влияет питание; Дефицит железа может вызвать анемию, а некоторые токсичные соединения могут привести к летальному исходу. У экзотермов температура организма зависит от температуры окружающей среды. Учитывая устрашающее количество условий окружающей среды, которые можно представить, вероятно, невозможно определить, преобладают ли таксономически устойчивые отношения GP или таксономически устойчивые отношения среда-фенотип. Кроме того, вопрос о том, представляют ли таксономически устойчивые отношения GP исключительную и небольшую долю или значительную долю всех отношений GP, является предметом споров. В любом случае, существование таксономически устойчивых взаимосвязей GP теперь ясно и должно быть широко признано исследовательским сообществом.
Некоторые из самых поразительных учений современной биологии включают открытие того, что живые существа имеют один и тот же генетический материал (ДНК или РНК), один и тот же генетический код (за некоторыми исключениями) и один и тот же базовый клеточный механизм. Таким образом, далеко не парадоксально, что индивидуальные различия строятся на сходствах, и тот факт, что определенные отношения ГП сохраняются на протяжении длительного времени эволюции, завершает картину.
Таким образом, далеко не парадоксально, что индивидуальные различия строятся на сходствах, и тот факт, что определенные отношения ГП сохраняются на протяжении длительного времени эволюции, завершает картину.
Точная предсказательная сила, возникающая в результате существования таксономически устойчивых взаимосвязей GP, редко встречается в биологии и только начинает использовать свой полный потенциал. Сохранение связей GP на большие расстояния теперь полностью оправдывает использование подходов сравнительной генетики для решения прагматических проблем. Например, одомашнивание сельскохозяйственных культур приняло форму аналогичного давления отбора у многих видов, и теперь у нас есть экспериментальные доказательства того, что этот процесс неоднократно включал мутации в одном и том же наборе консервативных генов (Peterson et al., 19).95; Мартин и Оргогозо, 2013b). Это наблюдение открывает интересные возможности для применения, поскольку мы можем использовать эту новую совокупность генетических знаний, чтобы помочь одомашниванию будущих культур или использовать стратегии с помощью маркеров для производства и поддержания биоразнообразия сельскохозяйственных культур (Lenser and Theißen, 2013). Предсказуемость GP уже используется для идентификации штаммов, которые развили устойчивость к различным стратегиям борьбы с вредителями, причем крайние случаи нацелены на толерантность к противомалярийным препаратам у Plasmodium 9.0053 паразитов (Manske et al., 2012), устойчивость бактерий и дрожжей к антибиотикам (Fischbach, 2009; MacCallum et al., 2010) или, что еще более драматично, антропогенная эволюция устойчивости к инсектицидам у различных когорт насекомых, независимо от их статус вредителя (Ffrench-Constant et al., 2004; Martin and Orgogozo, 2013b).
Предсказуемость GP уже используется для идентификации штаммов, которые развили устойчивость к различным стратегиям борьбы с вредителями, причем крайние случаи нацелены на толерантность к противомалярийным препаратам у Plasmodium 9.0053 паразитов (Manske et al., 2012), устойчивость бактерий и дрожжей к антибиотикам (Fischbach, 2009; MacCallum et al., 2010) или, что еще более драматично, антропогенная эволюция устойчивости к инсектицидам у различных когорт насекомых, независимо от их статус вредителя (Ffrench-Constant et al., 2004; Martin and Orgogozo, 2013b).
Кроме того, повторяемость генетической основы фенотипической изменчивости предполагает, что клинические исследования, вероятно, также получат пользу от генетических исследований большого числа модельных видов (Robinson and Webber, 2014). Например, естественная изменчивость толерантности к метотрексату, химиотерапевтическому препарату, была картирована в 9 случаях.0052 Drosophila плодовых мушек к генам, человеческие ортологи которых также связаны с реакцией пациентов на этот препарат (Kislukhin et al. , 2013), что расширяет возможности использования модельных организмов в качестве моделей заболеваний.
, 2013), что расширяет возможности использования модельных организмов в качестве моделей заболеваний.
Один из оригинальных аспектов описания связи GP с точки зрения индивидуальных отношений GP заключается в том, что это позволяет классифицировать фенотипы в соответствии с лежащей в их основе генетической основой. На первом уровне отношения GP, затрагивающие разные регионы одного и того же гена и дающие сопоставимые фенотипические результаты, могут быть сгруппированы вместе. Простые случаи взаимодействия GxG были обнаружены между тесно связанными мутациями, как правило, внутри кодирующей последовательности или внутри цис- регуляторный элемент, когда они вызывают неаддитивный эффект на фенотип. Например, было обнаружено, что определенная мутация в энхансере вызывает различные сдвиги в паттерне экспрессии нижестоящего кодирующего гена в зависимости от соседней последовательности ДНК (Frankel et al., 2011; Rogers et al., 2013). Сходным образом было обнаружено, что аминокислотные мутации в гене гемоглобина увеличивают или уменьшают сродство к кислороду в зависимости от аллельного состояния других сайтов (Natarajan et al. , 2013). В таких случаях интуитивно понятно сгруппировать такие генетически связанные сайты вместе, поскольку все они влияют на один и тот же тип фенотипического признака.
, 2013). В таких случаях интуитивно понятно сгруппировать такие генетически связанные сайты вместе, поскольку все они влияют на один и тот же тип фенотипического признака.
Отсутствие пигментов меланина у животных было связано с мутациями в нескольких генах, включая OCA2 , kit-лиганд или Mc1R (обзор в Gompel and Prud’homme, 2009; Liu et al., 2013). В то время как отсутствие меланина традиционно рассматривается как одно из состояний признака, альбинизм, независимо от лежащей в основе генетической основы, мы предлагаем здесь различать OCA2 -ассоциированный альбинизм от Mc1R -ассоциированного альбинизма или альбинизма, связанного с любым другим геном. Одним из преимуществ разложения изменчивости живого мира на эти множественные элементарные отношения ЗП является то, что эти элементы затем могут быть сгруппированы в последовательно увеличивающиеся группы. Элементарные фенотипические изменения, затрагивающие разные гены, которые являются частью одного и того же генетического пути, также могут быть сгруппированы вместе как сопутствующие компоненты одного и того же механизма модуляции фенотипа. Это явно относится к сигнальным молекулам TGF-β BMP15, GDF9.и рецептор TGF-β BMPR1B, которые неоднократно связывали с изменениями функции яичников у людей и домашних овец (обзор в Luong et al., 2011).
Это явно относится к сигнальным молекулам TGF-β BMP15, GDF9.и рецептор TGF-β BMPR1B, которые неоднократно связывали с изменениями функции яичников у людей и домашних овец (обзор в Luong et al., 2011).
Другим важным следствием перспективы родства GP является то, что очевидно различные фенотипические изменения, вызванные сходными генетическими локусами в различных организмах, могут быть исследованы далее, чтобы выявить то, что может быть общим базовым фенотипическим изменением (Deans et al., 2015). Например, личинки мух и черви-нематоды имеют разное поведение при поиске пищи, но имеют мутации в одном и том же ортологическом гене (9).0052 для / egl-4 ) изменяют интенсивность поведения в поисках пищи у обоих организмов (Osborne et al., 1997; Mery et al., 2007; Hong et al., 2008). Таким образом, вполне вероятно, что основное поведенческое изменение, которое лежит в основе кажущихся отличительными изменений поиска пищи мухами и нематодами, представляет собой консервативное отношение GP между нематодами и мухами. Этот несколько пограничный пример иллюстрирует проблему включения широко распространенного сравнительного мышления в наше глобальное понимание биологии. Имеет ли отношение мутация в мышиной модели к заболеванию человека? Можем ли мы считать, что фенотип мыши подобен состоянию человека, если его генетическая основа иная? Мы и другие прогнозируем, что поиск ортологичных фенотипов, или «фенологов» (McGary et al., 2010), станет главной задачей современной генетики и потребует плодотворного союза между прикладной и эволюционной биологией.
Этот несколько пограничный пример иллюстрирует проблему включения широко распространенного сравнительного мышления в наше глобальное понимание биологии. Имеет ли отношение мутация в мышиной модели к заболеванию человека? Можем ли мы считать, что фенотип мыши подобен состоянию человека, если его генетическая основа иная? Мы и другие прогнозируем, что поиск ортологичных фенотипов, или «фенологов» (McGary et al., 2010), станет главной задачей современной генетики и потребует плодотворного союза между прикладной и эволюционной биологией.
В этой статье мы возвращаем дифференциальную концепцию гена (Schwartz, 2000) в нашу структуру для понимания карты GP. Дифференциальный взгляд на отношения GP помогает прояснить генетические и экологические эффекты на фенотипы и их связь. Это также открывает новые возможности для размышлений, в частности, в отношении декомпозиции наблюдаемых признаков внутри организма и представления карт GP. Кроме того, существование таксономически надежных взаимосвязей GP поощряет беззастенчивое использование сравнительной генетики для предсказания генетической основы фенотипической изменчивости в различных группах организмов, и эта предсказательная сила имеет важный потенциал для трансляционных исследований в области агрономии и клинических исследований.
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Мы глубоко признательны Мари-Анн Феликс за содержательные обсуждения и Томасу Прадеу за то, что он обратил наше внимание на несколько важных статей. Мы также благодарим Giuseppe Baldacci, Marie-Anne Félix, Pierre-Henri Gouyon, Alexandre Peluffo, Mark Siegal, David Stern и рецензентов за их проницательные комментарии к рукописи. Исследование, которое привело к написанию этой статьи, финансировалось Европейским исследовательским советом в рамках Седьмой рамочной программы Европейского сообщества (FP7/2007-2013 Грантовое соглашение № 337579).) и от Фонда Джона Темплтона (грант № 43903).
| ГП | генотип-фенотип. |
- Андерсен Э. К., Блум Дж. С., Герке Дж. П., Кругляк Л. (2014). Вариант нейропептидного рецептора npr-1 является основной детерминантой роста и физиологии Caenorhabditis elegans .
 Генетика PLoS. 10:e1004156
10.1371/journal.pgen.1004156 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Генетика PLoS. 10:e1004156
10.1371/journal.pgen.1004156 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Армстронг М. Д., Тайлер Ф. Х. (1955). Исследования на фенилкетонурию. I. Ограничение приема фенилаланина при фенилкетонурии. Дж. Клин. Инвестировать. 34 565–580. 10.1172/JCI103105 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Bloom J. S., Ehrenreich I. M., Loo W. T., Lite T.-L. В., Кругляк Л. (2013). Поиск источников отсутствующей наследственности при скрещивании дрожжей. Природа 494 234–237. 10.1038/nature11867 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Бойкот А. Э., Дайвер К., Гарстанг С. Л., Тернер Ф. М. (1931). Наследование левосторонней формы у limnæa peregra (Mollusca, Pulmonata). Филос. Транс. Р. Соц. Лонд. сер. Б 219 51–131. 10.1098/rstb.1931.0002 [CrossRef] [Google Scholar]
- Браво Дж. А., Форсайт П., Чу М. В., Эскаравэдж Э., Савиньяк Х. М.
 , Динан Т. Г. и др. (2011). Прием внутрь штамма Lactobacillus регулирует эмоциональное поведение и экспрессию центрального рецептора ГАМК у мышей через блуждающий нерв. Проц. Натл. акад. науч. США 108
16050–16055. 10.1073/pnas.1102999108 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Динан Т. Г. и др. (2011). Прием внутрь штамма Lactobacillus регулирует эмоциональное поведение и экспрессию центрального рецептора ГАМК у мышей через блуждающий нерв. Проц. Натл. акад. науч. США 108
16050–16055. 10.1073/pnas.1102999108 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Брисель В. М., Коннелл Л., Коноки К., Маккуорри С. П., Шойер Т., Каттералл В. А. и др. (2005). Мутация натриевого канала, приводящая к устойчивости моллюсков к сакситоксину, увеличивает риск ПНП. Природа 434 763–767. 10.1038/nature03415 [PubMed] [CrossRef] [Google Scholar]
- Кэрролл С. Б., Гренье Дж., Уэзерби С. (2005). От ДНК к разнообразию: молекулярная генетика и эволюция дизайна животных . Молден, Массачусетс: John Wiley & Sons. [Google Scholar]
- Кассирер Э. (1910). Вещество и функция 2010 Эдн Париж: Набу Пресс. [Google Scholar]
- Коэн Э. (2012). От клеток к цивилизациям: принципы изменения, формирующие жизнь .
 Принстон, Нью-Джерси: Издательство Принстонского университета;
10.1515/9781400841653 [CrossRef] [Google Scholar]
Принстон, Нью-Джерси: Издательство Принстонского университета;
10.1515/9781400841653 [CrossRef] [Google Scholar] - Colosimo P. F., Hosemann K. E., Balabhadra S., Villarreal G., Jr., Dickson M., Grimwood J., et al. (2005). Широко распространенная параллельная эволюция у колюшек путем повторной фиксации аллелей эктодисплазина. Наука 307 1928–1933 гг. 10.1126/science.1107239 [PubMed] [CrossRef] [Google Scholar]
- Докинз Р. (1982). Расширенный фенотип: длинная досягаемость гена . Оксфорд: Издательство Оксфордского университета. [Google Scholar]
- Динс А. Р., Льюис С. Э., Хуала Э., Анзальдо С. С., Эшбернер М., Балхофф Дж. П. и др. (2015). Находим свой путь через фенотипы. PLoS Биол. 13:e1002033 10.1371/journal.pbio.1002033 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Данбар Х.Е., Уилсон А.К.С., Фергюсон Н.Р., Моран Н.А. (2007). Термическая устойчивость тли определяется точечной мутацией в бактериальных симбионтах.
 PLoS Биол. 5:e96
10.1371/journal.pbio.0050096 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Биол. 5:e96
10.1371/journal.pbio.0050096 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Engelman C.D., Baurley J.W., Chiu Y.-F., Joubert B.R., Lewinger J.P., Maenner M.J., et al. (2009). Обнаружение взаимодействий генов и окружающей среды в данных полногеномной ассоциации. Жен. Эпидемиол. 33(Приложение 1) С68–С73. 10.1002/gepi.20475 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Фальк Р. (1984). Ген в поисках идентичности. Гул. Жене. 68 195–204. 10.1007/BF00418388 [PubMed] [CrossRef] [Google Scholar]
- Feldman C.R., Brodie E.D., Jr., Brodie E.D., III, Pfrender M.E. (2012). Ограничение формирует конвергенцию в устойчивых к тетродотоксину натриевых каналах змей. Проц. Натл. акад. науч. США 109 4556–4561. 10.1073/pnas.1113468109 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ffrench-Constant R.H., Daborn P.J., Le Goff G. (2004). Генетика и геномика устойчивости к инсектицидам.
 Тенденции Жене. 20
163–170. 10.1016/j.tig.2004.01.003 [PubMed] [CrossRef] [Google Scholar]
Тенденции Жене. 20
163–170. 10.1016/j.tig.2004.01.003 [PubMed] [CrossRef] [Google Scholar] - Fischbach MA (2009). Антибиотики от микробов: сходятся, чтобы убить. Курс. мнение микробиол. 12 520–527. 10.1016/j.mib.2009.07.002 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Fisher RA (1930). Генетическая теория естественного отбора . Оксфорд: Кларендон; 10.5962/bhl.title.27468 [CrossRef] [Google Scholar]
- Фонтана В. (2002). Моделирование «эво-дево» с помощью РНК. Новости BioEssays Rev. Mol. Клетка. Дев. биол. 24 1164–1177 гг. 10.1002/bies.10190 [PubMed] [CrossRef] [Google Scholar]
- Frankel N., Erezyilmaz D.F., McGregor A.P., Wang S., Payre F., Stern D.L. (2011). Морфологическая эволюция, вызванная множеством малозаметных замен в регуляторной ДНК. Природа 474 598–603. 10.1038/nature10200 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Geffeney S.L., Fujimoto E.
 , Brodie E.D., III, Brodie E.D., Jr., Ruben P.C. (2005). Эволюционная диверсификация устойчивых к ТТХ натриевых каналов во взаимодействии хищник-жертва. Природа 434
759–763. 10.1038/nature03444 [PubMed] [CrossRef] [Google Scholar]
, Brodie E.D., III, Brodie E.D., Jr., Ruben P.C. (2005). Эволюционная диверсификация устойчивых к ТТХ натриевых каналов во взаимодействии хищник-жертва. Природа 434
759–763. 10.1038/nature03444 [PubMed] [CrossRef] [Google Scholar] - Gerstein M.B., Bruce C., Rozowsky J.S., Zheng D., Du J., Korbel J.O., et al. (2007). Что такое ген после кодирования? История и обновленное определение. Рез. генома. 17 669–681. 10.1101/gr.6339607 [PubMed] [CrossRef] [Google Scholar]
- Гилберт С. Ф. (2000). «Классические гены и гены развития: различное использование генов в эволюционном синтезе», в Концепция гена в развитии и эволюции редакторы Бертон П., Фальк Р., Райнбергер Х.-Дж. (Кембридж, Нью-Йорк: Издательство Кембриджского университета;). [Google Scholar]
- Гилберт С. Ф., Эпель Д. (2009). Экологическая биология развития: интеграция эпигенетики, медицины и эволюции . Сандерленд, Массачусетс: Sinauer Associates. [Google Scholar]
- Гьювсланд А.
 Б., Вик Дж. О., Бирд Д. А., Хантер П. Дж., Омхолт С. В. (2013). Преодоление разрыва между генотипом и фенотипом: что для этого нужно? J. Physiol. 591
2055–2066 гг. 10.1113/jphysiol.2012.248864 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Б., Вик Дж. О., Бирд Д. А., Хантер П. Дж., Омхолт С. В. (2013). Преодоление разрыва между генотипом и фенотипом: что для этого нужно? J. Physiol. 591
2055–2066 гг. 10.1113/jphysiol.2012.248864 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Гомпель Н., Прюдом Б. (2009). Причины повторной генетической эволюции. Дев. биол. 332 36–47. 10.1016/j.ydbio.2009.04.040 [PubMed] [CrossRef] [Google Scholar]
- Граур Д., Чжэн Ю., Азеведо Р.Б.Р. (2015). Эволюционная классификация геномной функции. Геном Биол. Эвол. 7 642–645. 10.1093/gbe/evv021 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Griffiths P., Stotz K. (2013). Генетика и философия: введение . Кембридж: Издательство Кембриджского университета; 10.1017/CBO9780511744082 [CrossRef] [Google Scholar]
- Gujas B., Alonso-Blanco C., Hardtke C.S. (2012). Природные аллели потери функции Arabidopsis brx обеспечивают адаптацию корней к кислой почве.
 Курс. биол. 22
1962–1968 гг. 10.1016/j.cub.2012.08.026 [PubMed] [CrossRef] [Google Scholar]
Курс. биол. 22
1962–1968 гг. 10.1016/j.cub.2012.08.026 [PubMed] [CrossRef] [Google Scholar] - Хансен Т. Ф. (2013). Почему эпистаз важен для отбора и адаптации. Эволюция 67 3501–3511. 10.1111/evo.12214 [PubMed] [CrossRef] [Google Scholar]
- Холлочер Х., Хэтчер Дж. Л., Дайресон Э. Г. (2000). Генетический анализ и анализ развития различий в пигментации брюшка у разных видов подгруппы Drosophila dunni . Эволюция. Междунар. Дж. Орг. Эвол. 54 2057–2071 гг. 10.1111/j.0014-3820.2000.tb01249.x [PubMed] [CrossRef] [Google Scholar]
- Хонг Р.Л., Витте Х., Соммер Р.Дж. (2008). Естественная вариация в привлечении феромонов насекомых Pristionchus pacificus включает протеинкиназу EGL-4. Проц. Натл. акад. науч. США 105 7779–7784. 10.1073/pnas.0708406105 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Houle D., Govindaraju D.R., Omholt S. (2010). Феномика: следующий вызов. Нац. Преподобный Жене.
 11
855–866. 10.1038/nrg2897 [PubMed] [CrossRef] [Google Scholar]
11
855–866. 10.1038/nrg2897 [PubMed] [CrossRef] [Google Scholar] - Johannsen W. (1911). Генотипическая концепция наследственности. утра. Нац. 45 129–159. 10.1086/279202 [CrossRef] [Google Scholar]
- Jones F.C., Grabherr M.G., Chan Y.F., Russell P., Mauceli E., Johnson J., et al. (2012). Геномные основы адаптивной эволюции трехиглой колюшки. Природа 484 55–61. 10.1038/nature10944 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Камберов Ю.Г., Ван С., Тан Дж., Гербо П., Уорк А., Тан Л. и др. (2013). Моделирование недавней эволюции человека у мышей путем экспрессии выбранного варианта EDAR. Сотовый 152 691–702. 10.1016/j.cell.2013.01.016 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Камменга Дж. Э., Дорошук А., Риксен Дж. А. Г., Хазендонк Э., Спиридон Л., Петреску А.-Й. , и другие. (2007). А Caenorhabditis elegans дикого типа не поддается правилу «температура-размер» из-за полиморфизма одного нуклеотида в tra-3.
 Генетика PLoS 3:е34
10.1371/journal.pgen.0030034 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Генетика PLoS 3:е34
10.1371/journal.pgen.0030034 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Keller E. F. (2010). Мираж пространства между природой и воспитанием . Дарем, Северная Каролина: Издательство Университета Дьюка; 10.1215/9780822392811 [CrossRef] [Google Scholar]
- Киршнер М., Герхарт Дж. (1998). Эволюционируемость. Проц. Натл. акад. науч. США 95 8420–8427. 10.1073/pnas.95.15.8420 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Кислухин Г., Кинг Э. Г., Уолтерс К. Н., Макдональд С. Дж., Лонг А. Д. (2013). Генетическая архитектура токсичности метотрексата аналогична Drosophila melanogaster и людям. 3 1301–1310 гг. 10.1534/g3.113.006619 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Landry CR, Rifkin S.A. (2012). Генотип-фенотипические карты системной биологии и количественной генетики: различные и взаимодополняющие. Доп. Эксп. Мед. биол. 751
371–398.
 10.1007/978-1-4614-3567-9_17 [PubMed] [CrossRef] [Google Scholar]
10.1007/978-1-4614-3567-9_17 [PubMed] [CrossRef] [Google Scholar] - Langlade N.B., Feng X., Dransfield T., Copsey L., Hanna A.I., Thébaud C., et al. (2005). Эволюция через генетически контролируемое аллометрическое пространство. Проц. Натл. акад. науч. США 102 10221–10226. 10.1073/pnas.0504210102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lenser T., Theißen G. (2013). Молекулярные механизмы, вовлеченные в конвергентное одомашнивание сельскохозяйственных культур. Тенденции Растениеводство. 18 704–714. 10.1016/j.tplants.2013.08.007 [PubMed] [CrossRef] [Google Scholar]
- Lettre G. (2011). Последние успехи в изучении генетики роста. Гул. Жене. 129 465–472. 10.1007/s00439-011-0969-x [PubMed] [CrossRef] [Google Scholar]
- Левонтин Р. (1974a). Генетическая основа эволюционных изменений (Колумбийская биологическая серия) . Колумбия: Издательство Колумбийского университета. [Google Scholar]
- Левонтин Р.
 К. (1974б). Дисперсионный анализ и анализ причин. утра. Дж. Хам. Жене. 26
400–411. [Бесплатная статья PMC] [PubMed] [Google Scholar]
К. (1974б). Дисперсионный анализ и анализ причин. утра. Дж. Хам. Жене. 26
400–411. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Левонтин Р. (1978). Приспособление. науч. Являюсь. 293 212–228. 10.1038/scientificamerican0978-212 [PubMed] [CrossRef] [Google Scholar]
- Linnen C.R., Poh Y.-P., Peterson B.K., Barrett R.D.H., Larson J.G., Jensen J.D., et al. (2013). Адаптивная эволюция нескольких признаков посредством множественных мутаций в одном гене. Наука 339 1312–1316 гг. 10.1126/science.1233213 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Liu F., Wen B., Kayser M. (2013). Красочные полиморфизмы ДНК у человека. Семин. Сотовый Дев. биол. 24 562–575. 10.1016/j.semcdb.2013.03.013 [PubMed] [CrossRef] [Google Scholar]
- Luong H.T.T., Chaplin J., McRae A.F., Medland S.E., Willemsen G., Nyholt D.R., et al. (2011). Вариации BMPR1B, TGFRB1 и BMPR2 и контроль дизиготного двойникования. Двойной рез.
 Гум. Жене. Выключенный. Дж. Междунар. соц. Твин Стад. 14
408–416. 10.1375/twin.14.5.408 [PubMed] [CrossRef] [Google Scholar]
Гум. Жене. Выключенный. Дж. Междунар. соц. Твин Стад. 14
408–416. 10.1375/twin.14.5.408 [PubMed] [CrossRef] [Google Scholar] - Линч М., Уолш Б. (1998). Генетика и анализ количественных признаков . Сандерленд, Массачусетс: Sinauer Associates. [Google Scholar]
- Маккаллум Д. М., Кост А., Ишер Ф., Якобсен М. Д., Оддс Ф. К., Санглард Д. (2010). Генетическое исследование механизмов устойчивости к азолам у Candida albicans и их проверка на модели диссеминированной инфекции на мышах. Антимикроб. Агенты Чемотер. 54 1476–1483 гг. 10.1128/AAC.01645-1649 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Манске М., Миотто О., Кампино С., Оберн С., Альмагро-Гарсия Дж., Маслен Г., и другие. (2012). Анализ разнообразия Plasmodium falciparum при естественных инфекциях методом глубокого секвенирования. Природа 487 375–379. 10.1038/nature11174 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Martin A.
 , Orgogozo V. (2013a). Данные из: Локусы повторяющейся эволюции: Каталог генетических горячих точек фенотипической изменчивости .
Доступно по адресу: http://datadryad.org/resource/
10.5061/dryad.v66p0 [PubMed] [CrossRef] [Google Scholar]
, Orgogozo V. (2013a). Данные из: Локусы повторяющейся эволюции: Каталог генетических горячих точек фенотипической изменчивости .
Доступно по адресу: http://datadryad.org/resource/
10.5061/dryad.v66p0 [PubMed] [CrossRef] [Google Scholar] - Мартин А., Оргогозо В. (2013b). Локусы повторной эволюции: каталог генетических очагов фенотипической изменчивости. Эволюция. Междунар. Дж. Оргн. Эвол. 67 1235–1250 гг. 10.1111/evo.12081 [PubMed] [CrossRef] [Google Scholar]
- Mayr E. (1963). Виды животных и эволюция . Гарвард: Издательство Гарвардского университета; 10.4159/harvard.9780674865327 [CrossRef] [Google Scholar]
- МакГэри К.Л., Парк Т.Дж., Вудс Дж.О., Ча Х.Дж., Уоллингфорд Дж.Б., Маркотт Э.М. (2010). Систематическое открытие неочевидных моделей болезней человека с помощью ортологических фенотипов. Проц. Натл. акад. науч. США 107 6544–6549. 10.1073/pnas.00107 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Мери Ф.
 , Белай А. Т., Со А. К.-К., Соколовский М. Б., Кавецкий Т. Дж. (2007). Природный полиморфизм, влияющий на обучение и память у дрозофилы . Проц. Натл. акад. науч. США 104
13051–13055. 10.1073/pnas.0702923104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Белай А. Т., Со А. К.-К., Соколовский М. Б., Кавецкий Т. Дж. (2007). Природный полиморфизм, влияющий на обучение и память у дрозофилы . Проц. Натл. акад. науч. США 104
13051–13055. 10.1073/pnas.0702923104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Moss L. (2003). Один, два (тоже?), много генов? Q. Rev. Biol. 78 57–67. 10.1086/367581 [CrossRef] [Google Scholar]
- Narod SA, Foulkes WD (2004). BRCA1 и BRCA2: 1994 г. и последующие годы. Нац. Преподобный Рак 4 665–676. 10.1038/nrc1431 [PubMed] [CrossRef] [Google Scholar]
- Натараджан С., Иногути Н., Вебер Р. Э., Фаго А., Морияма Х., Сторц Дж. Ф. (2013). Эпистаз среди адаптивных мутаций гемоглобина оленьих мышей. Наука 340 1324–1327 гг. 10.1126/science.1236862 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Noble D. (2006). Музыка жизни: биология за пределами генома .
Оксфорд: Издательство Оксфордского университета.
 [Google Scholar]
[Google Scholar] - Осборн К. А., Робишон А., Берджесс Э., Батленд С., Шоу Р. А., Култхард А. и др. (1997). Естественный полиморфизм поведения, обусловленный цГМФ-зависимой протеинкиназой Drosophila . Наука 277 834–836. 10.1126/science.277.5327.834 [PubMed] [CrossRef] [Google Scholar]
- Ояма С. (2000). Онтогенез информации: системы развития и эволюция 2-е изд. Кембридж, Нью-Йорк: Издательство Университета Дьюка; 10.1215/9780822380665 [CrossRef] [Google Scholar]
- Пааби А. Б., Рокман М. В. (2013). Многоликость плейотропии. Тенденции Жене. 29 66–73. 10.1016/j.tig.2012.10.010 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Палмер А. Р. (2004). Нарушение симметрии и эволюция развития. Наука 306 828–833. 10.1126/science.1103707 [PubMed] [CrossRef] [Google Scholar]
- Патерсон А. Х., Лин Ю. Р., Ли З., Шерц К. Ф., Добли Дж. Ф., Пинсон С. Р. и др. (1995). Конвергентное одомашнивание злаковых культур путем независимых мутаций в соответствующих генетических локусах.
 Наука 269
1714–1718 гг. 10.1126/science.269.5231.1714 [PubMed] [CrossRef] [Google Scholar]
Наука 269
1714–1718 гг. 10.1126/science.269.5231.1714 [PubMed] [CrossRef] [Google Scholar] - Перуц М. Ф. (1983). Видовая адаптация в белковой молекуле. Мол. биол. Эвол. 1 1–28. [PubMed] [Академия Google]
- Phillips PC (2008 г.). Эпистаз – существенная роль взаимодействий генов в структуре и эволюции генетических систем. Нац. Преподобный Жене. 9 855–867. 10.1038/nrg2452 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Pokorná M., Kratochvíl L. (2009). Филогения механизмов определения пола у чешуйчатых рептилий: половые хромосомы — эволюционная ловушка? Зоол. Дж. Линн. соц. 156 168–183. 10.1111/j.1096-3642.2008.00481.x [CrossRef] [Google Scholar]
- Робинсон П. Н., Уэббер К. (2014). Онтологии фенотипов и межвидовой анализ для трансляционных исследований. Генетика PLoS 10:e1004268 10.1371/journal.pgen.1004268 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Rockman MV (2012).
 Программа QTN и аллели, имеющие значение для эволюции: все золото не блестит. Эволюция. Междунар. Дж. Оргн. Эвол. 66
1–17. 10.1111/j.1558-5646.2011.01486.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Программа QTN и аллели, имеющие значение для эволюции: все золото не блестит. Эволюция. Междунар. Дж. Оргн. Эвол. 66
1–17. 10.1111/j.1558-5646.2011.01486.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Роджерс В. А., Саломоне Дж. Р., Тейси Д. Дж., Камино Э. М., Дэвис К. А., Ребейз М. и др. (2013). Рекуррентная модификация консервативного цис-регуляторного элемента лежит в основе разнообразия пигментации плодовых мушек. Генетика PLoS 9:e1003740 10.1371/journal.pgen.1003740 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Romero-Herrera AE, Lehmann H., Joysey KA, Friday AE (1978). Об эволюции миоглобина. Филос. Транс. Р. Соц. Лонд. Б. биол. науч. 283 61–163. 10.1098/rstb.1978.0018 [PubMed] [CrossRef] [Google Scholar]
- Salazar-Ciudad I., Marín-Riera M. (2013). Адаптивная динамика по картам генотип-фенотип, основанным на развитии. Природа 497 361–364. 10.1038/nature12142 [PubMed] [CrossRef] [Google Scholar]
- Саркар С.
 (1999). От нормы реакции к норме адаптации: норма реакции, 1909–1960 гг. Биол. Филос. 14
235–252. 10.1023/A:10066
(1999). От нормы реакции к норме адаптации: норма реакции, 1909–1960 гг. Биол. Филос. 14
235–252. 10.1023/A:10066648 [CrossRef] [Google Scholar] - Швандер Т., Леймар О. (2011). Гены как лидеры и последователи эволюции. Тренды Экол. Эвол. 26 143–151. 10.1016/j.tree.2010.12.010 [PubMed] [CrossRef] [Google Scholar]
- Шварц С. (2000). «Дифференциальная концепция гена: прошлое и настоящее». Концепция гена в развитии и эволюции редакторы Бертон П. Дж., Фальк Р., Райнбергер Х. Дж. (Кембридж, Нью-Йорк: издательство Кембриджского университета;) 26–39. 10.1017/CBO9780511527296.004 [CrossRef] [Google Scholar]
- Ширанги Т. Р., Дюфур Х. Д., Уильямс Т. М., Кэрролл С. Б. (2009). Быстрая эволюция экспрессии фермента, продуцирующего половые феромоны, у Drosophila . PLoS Биол. 7:e1000168 10.1371/journal.pbio.1000168 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Simondon G.
 (1968). L’individuation à la Lumière des Notions de Forme et d’Information 2005-е изд.
Гренобль: Миллон. [Google Scholar]
(1968). L’individuation à la Lumière des Notions de Forme et d’Information 2005-е изд.
Гренобль: Миллон. [Google Scholar]- Собер Э. (1988). Распределение причинной ответственности. Дж. Филос. 85 303–318. 10.2307/2026721 [CrossRef] [Академия Google]
- Steiner C.C., Weber JN, Hoekstra HE (2007). Адаптивная вариация у пляжных мышей, вызванная двумя взаимодействующими генами пигментации. PLoS Биол. 5:e219 10.1371/journal.pbio.0050219 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Stern DL (2000). Эволюционная биология развития и проблема изменчивости. Эволюция. Междунар. Дж. Оргн. Эвол. 54 1079–1091. 10.1111/j.0014-3820.2000.tb00544.x [PubMed] [CrossRef] [Google Scholar]
- Стерн Д. Л. (2013). Генетические причины конвергентной эволюции. Нац. Преподобный Жене. 14 751–764. 10.1038/nrg3483 [PubMed] [CrossRef] [Google Scholar]
- Стерн Д., Оргогозо В. (2008). Локусы эволюции: насколько предсказуема генетическая эволюция? Эволюция.
 Междунар. Дж. Оргн. Эвол. 62
2155–2177. 10.1111/j.1558-5646.2008.00450.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Междунар. Дж. Оргн. Эвол. 62
2155–2177. 10.1111/j.1558-5646.2008.00450.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]- Stewart C.B., Schilling J.W., Wilson A.C. (1987). Адаптивная эволюция в желудочных лизоцимах ферментеров передней кишки. Природа 330 401–404. 10.1038/330401a0 [PubMed] [CrossRef] [Google Scholar]
- Стоц К. (2012). Убийство на экспрессе развития: кто убил природу/воспитание? биол. Филос. 27 919–929. 10.1007/s10539-012-9343-1 [CrossRef] [Google Scholar]
- Sturtevant AH (1932). Использование мозаики в изучении влияния генов на развитие. Проц. Шестой межд. конгр. Жене. Итака, штат Нью-Йорк, 1 304–307. [Google Scholar]
- Supple M., Papa R., Counterman B., McMillan W. O. (2014). Геномика адаптивного излучения: понимание континуума видообразования геликониуса. Доп. Эксп. Мед. Биол . 781 249–271. 10.1007/978-94-007-7347-9_13 [PubMed] [CrossRef] [Google Scholar]
- Таутц Д.
 , Шмид К. Дж. (1998). От генов к индивидуумам: гены развития и формирование фенотипа. Филос. Транс. Р. Соц. Лонд. Б. биол. науч. 353
231–240. 10.1098/rstb.1998.0205 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Шмид К. Дж. (1998). От генов к индивидуумам: гены развития и формирование фенотипа. Филос. Транс. Р. Соц. Лонд. Б. биол. науч. 353
231–240. 10.1098/rstb.1998.0205 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]- Томас Д. (2010). Исследования ассоциации генов и окружающей среды: новые подходы. Нац. Преподобный Жене. 11 259–272. 10.1038/nrg2764 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Venkatesh B., Lu S.Q., Dandona N., See S.L., Brenner S., Soong T.W. (2005). Генетическая основа устойчивости к тетродотоксину у иглобрюхов. Курс. биол. 15 2069–2072 гг. 10.1016/j.cub.2005.10.068 [PubMed] [CrossRef] [Google Scholar]
- Висшер П. М., Браун М. А., Маккарти М. И., Ян Дж. (2012). Пять лет открытия GWAS. утра. Дж. Хам. Жене. 90 7–24. 10.1016/j.ajhg.2011.11.029[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Waddington CH (1957). Стратегия генов 2014 Эдн Репринт Лондон: Рутледж.
 [Google Scholar]
[Google Scholar]- Вагнер Г. П. (1996). Гомологи, природные виды и эволюция модульности. утра. Зоол. 36 36–43. 10.1093/icb/36.1.36 [CrossRef] [Google Scholar]
- Wagner GP (2000). Концепция характера в эволюционной биологии . Сан-Диего, Калифорния: Academic Press. [Академия Google]
- Вагнер Г. П. (2014). Гомология, гены и эволюционные инновации . Принстон, Нью-Джерси: Издательство Принстонского университета; 10.1515/9781400851461 [CrossRef] [Google Scholar]
- Wang J., Wurm Y., Nipitwattanaphon M., Riba-Grognuz O., Huang Y.-C., Shoemaker D., et al. (2013). Y-подобная социальная хромосома вызывает альтернативную организацию колонии у огненных муравьев. Природа 493 664–668. 10.1038/nature11832 [PubMed] [CrossRef] [Google Scholar]
- Waters CK (2007). Причины, которые имеют значение. Дж. Филос. 104 551–579. [Google Scholar]
- Велтер Д., Макартур Дж., Моралес Дж., Бердетт Т., Холл П.
 , Джанкинс Х. и др. (2014). Каталог NHGRI GWAS, курируемый ресурс ассоциаций SNP-признаков. Рез. нуклеиновых кислот. 42
Д1001–Д1006. 10.1093/nar/gkt1229 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Джанкинс Х. и др. (2014). Каталог NHGRI GWAS, курируемый ресурс ассоциаций SNP-признаков. Рез. нуклеиновых кислот. 42
Д1001–Д1006. 10.1093/nar/gkt1229 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]- West-Eberhard M. J. (2003). Пластичность развития и эволюция . Оксфорд: Издательство Оксфордского университета. [Google Scholar]
- West-Eberhard M. J. (2005). Пластичность развития и происхождение видовых различий. Проц. Натл. акад. науч. США 102 (Приложение 1) 6543–6549. 10.1073/pnas.0501844102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Wilkins A. (2014). «Набор генетических инструментов»: история жизни важной метафоры. Достижения в эволюционной биологии развития изд. Тодд Стрилман Дж. (Хобокен, Нью-Джерси: John Wiley & Sons;) 1–14. [Google Scholar]
- Уилкинс А.С. (2002). Эволюция путей развития . Сандерленд, Массачусетс: Sinauer Associates. [Академия Google]
- Сюй С.
 , Дун Г.-С., Ху С.-С., Мяо Л., Чжан С.-Л., Чжан Д.-Л. и др. (2013). Генетическая основа белых тигров. Курс. биол. 23
1031–1035. 10.1016/j.cub.2013.04.054 [PubMed] [CrossRef] [Google Scholar]
, Дун Г.-С., Ху С.-С., Мяо Л., Чжан С.-Л., Чжан Д.-Л. и др. (2013). Генетическая основа белых тигров. Курс. биол. 23
1031–1035. 10.1016/j.cub.2013.04.054 [PubMed] [CrossRef] [Google Scholar]- Чжан Дж., Вагнер Г. П. (2013). Об определении и измерении плейотропии. Тенденции Жене. 29 383–384. 10.1016/j.tig.2013.05.002 [PubMed] [CrossRef] [Google Scholar]
Статьи из Frontiers in Genetics предоставлены здесь с разрешения Frontiers Media SA
Генотип — определение и примеры
Генотип
n., Множество: Генотипы
[ˈdʒiːn.oʊ.taɪp]
Определение: генетический состав, который кодирует для чертыТаблица содержимого
9. — это генетический состав отдельной клетки или организма, который определяет или вносит свой вклад в его фенотип. Противоположные термины генотип и фенотип используются для определения характеристик или признаков организма. Генотип определяет аллели, относящиеся к одному признаку (например, Аа) или к ряду признаков (например, Аа Вb cc). Термин может быть расширен для обозначения всего набора генов организма (или таксона). На этом всестороннем уровне он несколько совпадает с термином геном, который относится ко всей ДНК в организме. Однако не вся ДНК состоит из генов. Чтобы полностью описать генотип организма, потребуется набор символов, представляющих аллели для каждого из примерно 20 000 известных генов в геноме человека.
Генотип определяет аллели, относящиеся к одному признаку (например, Аа) или к ряду признаков (например, Аа Вb cc). Термин может быть расширен для обозначения всего набора генов организма (или таксона). На этом всестороннем уровне он несколько совпадает с термином геном, который относится ко всей ДНК в организме. Однако не вся ДНК состоит из генов. Чтобы полностью описать генотип организма, потребуется набор символов, представляющих аллели для каждого из примерно 20 000 известных генов в геноме человека.Какой интересный способ учиться! Приходите и присоединяйтесь к нам в нашей дискуссии на форуме: Что является ключом к признанию кодоминирования?
Фенотип организма описывает физические или физиологические особенности организма и является следствием экспрессии генотипов. Однако генотип — не единственный фактор, определяющий фенотип индивидуума. Различные факторы окружающей среды также играют роль, и они влияют на экспрессию генов, определяя отличительный фенотип организма.

Гены, генотипы и аллели
У большинства эукариот гены представлены парами, называемыми аллелями. Парные аллели занимают одно и то же место на хромосоме (называемое локусом). Они также будут контролировать ту же черту. Термин аллель относится к варианту определенного гена. Поскольку большинство эукариот размножаются половым путем, каждый родитель вносит один из двух аллелей данного гена. Поскольку каждый родитель является продуктом разных линий организмов, случайные ошибки репликации и взаимодействие окружающей среды с ДНК привели к различным модификациям генов каждого родителя. Это различие лежит в основе термина « аллель » ( алло = другое), что подразумевает инаковость или различие.
Если признак следует простому менделевскому типу наследования, то один из аллелей будет выражен, а другой — нет. Аллель, который экспрессируется, считается доминантным аллелем, тогда как аллель, который не экспрессируется, описывается как рецессивный. В случаях, когда доминантный аллель отсутствует, будет происходить экспрессия рецессивного аллеля.

Если доминантный аллель обозначен как «А», а рецессивный аллель — «а», возможны три различных генотипа: «АА», «аа» и «Аа». Термин « гомозиготный » используется для описания пар «АА» и «аа», поскольку аллели в паре одинаковы, то есть оба доминантны или оба рецессивны. Напротив, термин « гетерозиготный » используется для описания аллельной пары «Аа». Доминантный признак будет выражен в фенотипах особей с генотипами АА или Аа, а рецессивный фенотип будет выражен у особей с генотипом аа.
Не все признаки определяются одним геном; многие гены имеют несколько аллельных вариантов, и не все пары генов имеют простое доминантно-рецессивное отношение. Кодоминирование, неполное доминирование и полигенное наследование являются примерами неменделевского типа наследования. У людей многие из наблюдаемых признаков не являются менделевскими. Рост и цвет кожи, например, обусловлены взаимодействием не только пары аллелей, но и генов в нескольких разных локусах.
Изучайте кодоминирование и неполное доминирование вместе с нами! Присоединяйтесь к нашему форуму: Что является ключом к признанию кодоминирования? Поделитесь своими мыслями!
Прогнозирование простых генотипов: квадраты Пеннета
В простых генотипах указываются аллели только одного или нескольких признаков.
Квадрат Пеннета, показывающий взаимосвязь между фенотипом и генотипом Например, генотип гена, определяющего окраску цветка гороха, представлен двумя аллелями В и В 9.0053 . «В» — доминантный аллель, тогда как «b» — рецессивный аллель. Доминантный аллель кодирует признак пурпурного цветка, тогда как рецессивный аллель кодирует признак белого цветка. См. рисунок диаграммы ниже.
Например, генотип гена, определяющего окраску цветка гороха, представлен двумя аллелями В и В 9.0053 . «В» — доминантный аллель, тогда как «b» — рецессивный аллель. Доминантный аллель кодирует признак пурпурного цветка, тогда как рецессивный аллель кодирует признак белого цветка. См. рисунок диаграммы ниже.Эта диаграмма является примером квадрата Пеннета, впервые представленного Реджинальдом Пеннеттом после повторного открытия работы Менделя. Квадрат Пеннета является важным инструментом в генетике для предсказания моделей и соотношений наследования. Этот квадрат изображает как генотип, так и фенотип потомства двух гетерозиготных (Bb) родители, оба с фиолетовыми цветками. На диаграмме представлены аллели, присутствующие в родительских гаметах и в потомстве, полученном в результате различных комбинаций этих гамет. Каждый родитель производит два вида гамет ( В и В ), которые объединяются во все возможные пары.
 Из четырех потомков два гомозиготны, один пурпурный (BB) и один белый (bb), , и два гетерозиготны (Bb), , оба экспрессируют доминантный признак пурпурный. Это дает нам фенотипическое соотношение доминантных и рецессивных фенотипов 3:1, описанное Менделем. Это также дает нам соотношение генотипов 1:2:1 9генотипы 0052 BB, Bb, и bb .
Из четырех потомков два гомозиготны, один пурпурный (BB) и один белый (bb), , и два гетерозиготны (Bb), , оба экспрессируют доминантный признак пурпурный. Это дает нам фенотипическое соотношение доминантных и рецессивных фенотипов 3:1, описанное Менделем. Это также дает нам соотношение генотипов 1:2:1 9генотипы 0052 BB, Bb, и bb .Отзыв: Мэри Энн Кларк, доктор философии
Есть вопросы по генотипу? Присоединяйтесь к нашему форуму: Что является ключом к признанию кодоминирования? Наше сообщество может помочь!
Пройди тест по биологии генотипа!
Викторина
Выберите лучший ответ.

1. Набор генов организма
Генотип
Фенотип
2. Идентифицирует аллели, связанные с одним признаком
Генотип
Фенотип
3. Физические и физиологические особенности
Генотип
фенотип
4. Гомеров. AB
аа
5. Инструмент, используемый для прогнозирования моделей и соотношений наследования
Соотношение фенотипов
Соотношение генотипов
Квадрат Пеннета
Отправьте результаты (необязательно)
Ваше имя
Отправить по электронной почте
Далее
BIO101 — От генов к признакам: как генотип влияет на фенотип раз, в том числе в 2010 году. Пожалуйста, помогите мне найти источники изображений — я предполагаю, что они взяты из учебника, которым я пользовался в то время, но я не совсем уверен.

Как вы, возможно, знаете, я преподаю БИО101 (а также Лабораторию БИО102) нетрадиционным студентам в рамках программы обучения взрослых уже около двенадцати лет. Время от времени я публично размышляю об этом в блоге (см. это, это, это, это, это, это и это несколько коротких сообщений о различных аспектах этого — от использования видео до использования классной комнаты). блог, важность открытого доступа, чтобы студенты могли читать основную литературу). Качество студентов, участвующих в этой программе, неуклонно росло с годами, но я по-прежнему сильно ограничен во времени: у меня восемь 4-часовых встреч со студентами в течение восьми недель. В этот период я должен преподавать им всю биологию, необходимую им для их ненаучных специальностей, а также оставлять достаточно времени для каждого студента, чтобы сделать презентацию (по науке об их любимых растениях и животных) и сдать два экзамена. Таким образом, я должен разобрать лекции до голых костей и надеяться, что эти голые кости и есть то, что действительно нужно знать тем, кто не занимается наукой: концепции, а не факты, отношения с остальной частью их жизни, а не отношения с другими науками.
 Таким образом, я сопровождаю свои лекции видео и обсуждениями в классе, а их домашняя работа состоит в том, чтобы найти классные видео или статьи по биологии и разместить ссылки в блоге в классе для всеобщего обозрения. Пару раз я использовал малярию как нить, связывающую все темы — от клеточной биологии до экологии, от физиологии до эволюции. Я думаю, что это сработало хорошо, но это трудно сделать. Они также пишут заключительную статью по некоторым аспектам физиологии.
Таким образом, я сопровождаю свои лекции видео и обсуждениями в классе, а их домашняя работа состоит в том, чтобы найти классные видео или статьи по биологии и разместить ссылки в блоге в классе для всеобщего обозрения. Пару раз я использовал малярию как нить, связывающую все темы — от клеточной биологии до экологии, от физиологии до эволюции. Я думаю, что это сработало хорошо, но это трудно сделать. Они также пишут заключительную статью по некоторым аспектам физиологии. Другим нововведением стало то, что администрация осознала, что большинство преподавателей работают в школе уже много лет. У нас есть опыт, и, видимо, мы знаем, что делаем. Таким образом, недавно они дали нам гораздо больше свободы в разработке собственной программы вместо того, чтобы следовать заранее определенной, до тех пор, пока конечные цели класса остаются прежними. Я не совсем уверен, когда я снова буду читать лекции BIO101 (поздней осенью, весной?), но я хочу начать переосмысливать свой класс пораньше.
 Меня также беспокоит то, что, поскольку я не провожу активных исследований в лаборатории и, следовательно, не слежу за литературой так внимательно, некоторые вещи, которым я обучаю, сейчас устарели. Не то, чтобы кто-то мог идти в ногу со всеми достижениями во всех областях биологии, которые настолько огромны, но, по крайней мере, большие обновления, которые влияют на преподавание вводных курсов, — это то, что мне нужно знать.
Меня также беспокоит то, что, поскольку я не провожу активных исследований в лаборатории и, следовательно, не слежу за литературой так внимательно, некоторые вещи, которым я обучаю, сейчас устарели. Не то, чтобы кто-то мог идти в ногу со всеми достижениями во всех областях биологии, которые настолько огромны, но, по крайней мере, большие обновления, которые влияют на преподавание вводных курсов, — это то, что мне нужно знать. Мне нужно наверстать упущенное и обновить свои конспекты лекций. И что может быть лучше, чем краудсорсинг! Итак, в течение следующих нескольких недель я повторно опубликую свои старые конспекты лекций (обратите внимание, что это всего лишь вступления — обсуждения, видео и т. д. следуйте за ними в классе) и попрошу вас проверить меня. Если я что-то понял не так или что-то устарело, дайте мне знать (но не выдвигайте только свою предпочитаемую гипотезу, если вопрос еще не решен — вместо этого дайте мне полное объяснение спора).
 Если чего-то явно не хватает, дайте мне знать. Если что-то можно сказать более приятным языком — редактируйте мои предложения. Если вам известны интересные изображения, статьи, сообщения в блогах, видео, подкасты, визуализации, анимации, игры и т. д., которые можно использовать для объяснения этих основных понятий, дайте мне знать. И в конце, как только мы проделаем это со всеми лекциями, давайте обсудим общую программу — есть ли лучший способ организовать весь этот материал для такого динамичного занятия.
Если чего-то явно не хватает, дайте мне знать. Если что-то можно сказать более приятным языком — редактируйте мои предложения. Если вам известны интересные изображения, статьи, сообщения в блогах, видео, подкасты, визуализации, анимации, игры и т. д., которые можно использовать для объяснения этих основных понятий, дайте мне знать. И в конце, как только мы проделаем это со всеми лекциями, давайте обсудим общую программу — есть ли лучший способ организовать весь этот материал для такого динамичного занятия. Сегодня я берусь за важную, но трудную задачу объяснить, почему идея «ген для» неверна, и как более сложно представить себе, как гены влияют на фенотип.
————————————————————- —
Как генотип влияет на фенотип
В новостях часто можно услышать сообщения об открытии «гена X», например, гена алкоголизма, гена гомосексуализма, гена рака молочной железы и т.
 д. к одному сопоставлению между генами и признаками.
д. к одному сопоставлению между генами и признаками.Это недоразумение связано с историческими прецедентами. Самые первые гены были обнаружены десятилетия назад с помощью довольно примитивных технологий. Таким образом, единственные гены, которые можно было обнаружить, оказывали сильное и резкое влияние на признаки. Например, небольшая мутация (изменение последовательности нуклеотидов) в гене, кодирующем РНК, кодирующую один из четырех элементов белка гемоглобина, приводит к серповидноклеточной анемии. В результате эритроциты деформируются, а способность эритроцитов переносить достаточное количество кислорода к клеткам снижается.
Из-за таких драматических последствий небольших мутаций в то время считалось, что каждый ген кодирует определенный признак. Сегодня можно измерить незначительные эффекты нескольких генов, и хорошо известно, что парадигма «один ген/один признак» в значительной степени неверна. На большинство признаков влияет множество генов, и большинство генов участвуют в развитии нескольких признаков.

Геном – это вся генетическая информация индивидуума. Каждая клетка тела содержит полный геном. Геномы (т. е. последовательности ДНК) немного различаются между особями одного и того же вида, немного больше — между геномами близкородственных видов и еще больше — между отдаленно родственными видами.
Точная последовательность ДНК человека является его генотипом. Совокупность всех наблюдаемых и измеримых черт этого индивидуума называется фенотипом.
Если бы каждое положение и каждая функция каждой клетки нашего тела были генетически предопределены, нам понадобились бы триллионы генов, чтобы определить всю эту информацию. Тем не менее, у нас есть только около 26 000 генов. Все наши гены очень похожи на эквивалентные гены шимпанзе, но очевидно, что мы сильно отличаемся от шимпанзе по анатомии, физиологии и поведению. Кроме того, у нас много общих генов с рыбами, насекомыми и даже растениями, но различия в фенотипах огромны.
Таким образом, логически следует, что метафора генома как плана построения тела неверна.
 Не то, какие у вас гены, а то, как эти гены взаимодействуют друг с другом в процессе развития, отличает вас от другого представителя того же вида, от лосося или капусты.
Не то, какие у вас гены, а то, как эти гены взаимодействуют друг с другом в процессе развития, отличает вас от другого представителя того же вида, от лосося или капусты.Но как гены взаимодействуют друг с другом? Гены кодируют белки. Некоторые белки взаимодействуют с другими белками. Некоторые белки регулируют транскрипцию или репликацию ДНК. Другие белки представляют собой ферменты, модифицирующие другие химические вещества. Однако другие белки являются структурными, т. е. входят в состав мембран и других структур.
Небольшое различие в последовательности ДНК повлияет на последовательность РНК и последовательность полученного белка, влияя на первичную, вторичную и третичную структуру этого белка. Изменения в трехмерной форме белка повлияют на его эффективность в выполнении своей функции.
Например, если два белка взаимодействуют друг с другом и для этого должны связываться друг с другом, а они связываются, потому что их формы подходят друг к другу, как замок и ключ, то изменение формы одного белка будет изменить эффективность связывания двух.
 Изменение формы обоих белков может как замедлять, так и ускорять реакцию. Изменение скорости этой одной реакции в клетке повлияет на какую-то другую реакцию в клетке, в том числе на то, как клетка реагирует на сигналы извне.
Изменение формы обоих белков может как замедлять, так и ускорять реакцию. Изменение скорости этой одной реакции в клетке повлияет на какую-то другую реакцию в клетке, в том числе на то, как клетка реагирует на сигналы извне.Таким образом, на признак влияют гены, белки, другие химические вещества внутри клетки, межклеточные взаимодействия и внешняя среда. Самое главное, поскольку черты формируются во время развития, именно взаимодействия между всеми этими игроками на всех уровнях организации во время развития определяют окончательный фенотип организма.
Значение среды видно из явления нормы реакции. Один и тот же генотип при выращивании в разных условиях приводит к разным фенотипам. Более того, разные генотипы по-разному реагируют на одни и те же изменения окружающей среды. Один генотип может дать более высокое растение на большей высоте, в то время как немного другой генотип может дать совершенно противоположный результат: дать более низкое растение на большей высоте.

Итак, если гены не кодируют признаки, а геном — это не план, как лучше всего думать о геноме и картировании генотипа/фенотипа? Я дал вам раздаточный материал (см. ниже) с четырьмя различными альтернативными метафорами, по крайней мере одна из которых, я надеюсь, будет понятной и запоминающейся для каждого ученика. Сейчас я дам вам пятую такую метафору, одну из моих собственных:
Представьте себе, что ячейка — это завод по производству самолетов. Он покупает сырье и продает готовые самолеты. Как это делается? Белки — фабричные рабочие. Некоторые из них импортируют материалы, другие занимаются продажей самолетов. Одни охраняют фабрику от воров, другие готовят и подают еду в заводской столовой.
Но наиболее важными белками этой клетки являются те, которые собирают части самолетов. Когда им нужна деталь, например, пропеллер, они идут на склад (нуклеус), проверяют Каталог деталей (ДНК) и нажимают кнопку, чтобы разместить заказ на конкретную деталь. Другие белки (управляющие складом) проникают внутрь, находят нужную деталь и отправляют ее на сборочный цех (эндоплазматический ретикулум).

Но, белковые рабочие сами роботы, собранные из деталей тут же на том же заводе, а инструкции по их сборке есть и в Каталоге деталей (ДНК) в ядре.
Дальнейшее чтение:
Как вы носите свои гены? (PDF) Ричарда Докинза.
Аналогия генома Ричарда Хартера.
Это не просто гены, это связи между ними Пол Майерс
Собственная оригинальная, космическая и эксцентричная аналогия PZ Майерса о том, как работает геном — ИЛИ — High Geekology Пола Майерса
Это больше, чем гены, это сети и системы Пола Майерса.
Ранее в этой серии:
Биология и научный метод
BIO101 – Структура клетки
BIO101 – Синтез белков: транскрипция и трансляция
BIO101: межклеточные взаимодействия
BIO101 – От одной клетки к двум: деление клеток и репликация ДНК
BIO101 – От двух клеток к множеству: дифференцировка клеток и эмбриональное развитие
Выраженные взгляды принадлежат автору(ам) и не обязательно совпадают с мнением Scientific American.

Related Posts

 гомозигота, гетерозигота). Большинство генов проявляются в фенотипе организма, но фенотип и генотип различны по следующим показателям:
гомозигота, гетерозигота). Большинство генов проявляются в фенотипе организма, но фенотип и генотип различны по следующим показателям:

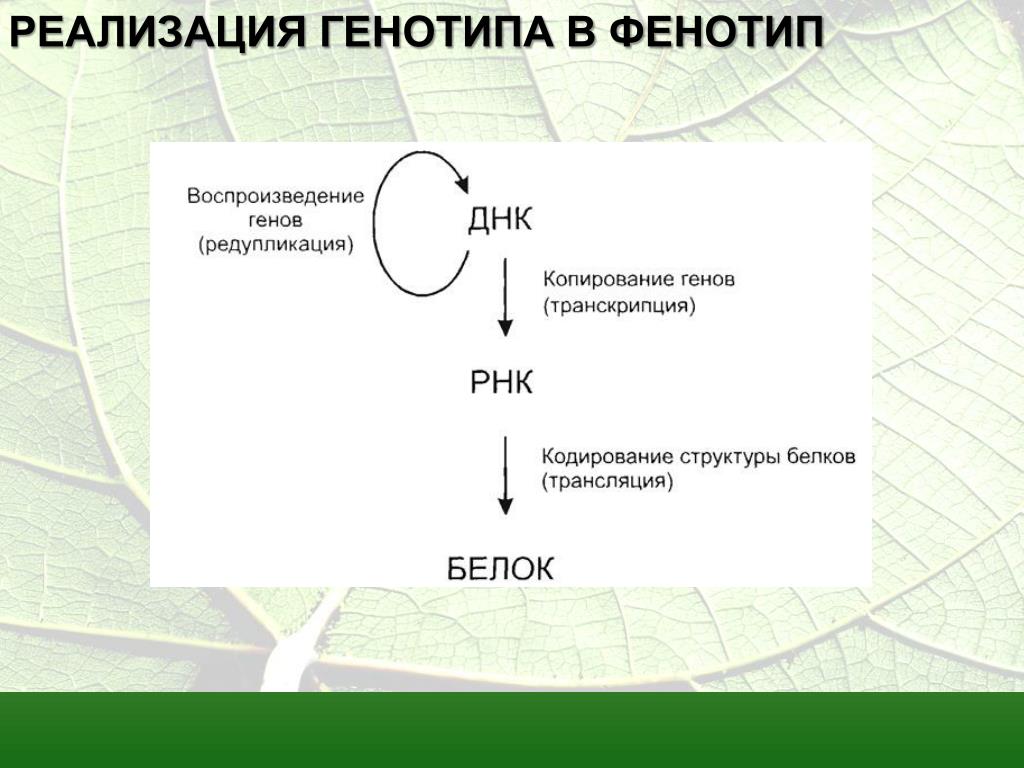
 В определении генома отдельного биологического вида необходимо учитывать, во-первых, генетические различия, связанные с полом организма, поскольку мужские и женские половые хромосомы различаются. Во-вторых, из-за громадного числа аллельных вариантов генов и сопутствующих последовательностей, которые присутствуют в генофонде больших популяций, можно говорить лишь о некоем усреднённом геноме, который сам по себе может обладать существенными отличиями от геномов отдельных особей. Размеры геномов организмов разных видов значительно отличаются друг от друга, и при этом часто не наблюдается корреляции между уровнем эволюционной сложности биологического вида и размером его генома.
В определении генома отдельного биологического вида необходимо учитывать, во-первых, генетические различия, связанные с полом организма, поскольку мужские и женские половые хромосомы различаются. Во-вторых, из-за громадного числа аллельных вариантов генов и сопутствующих последовательностей, которые присутствуют в генофонде больших популяций, можно говорить лишь о некоем усреднённом геноме, который сам по себе может обладать существенными отличиями от геномов отдельных особей. Размеры геномов организмов разных видов значительно отличаются друг от друга, и при этом часто не наблюдается корреляции между уровнем эволюционной сложности биологического вида и размером его генома.
 Разнообразие аллелей позволяет приспособиться к изменениям значительно быстрее, если соответствующие аллели уже имеются в наличии, чем если они должны появиться вследствие мутации. Тем не менее, в неизменяющейся окружающей среде меньшее число аллелей может быть более выгодным, чтобы при половом размножении не возникало слишком много неблагоприятных комбинаций.
Разнообразие аллелей позволяет приспособиться к изменениям значительно быстрее, если соответствующие аллели уже имеются в наличии, чем если они должны появиться вследствие мутации. Тем не менее, в неизменяющейся окружающей среде меньшее число аллелей может быть более выгодным, чтобы при половом размножении не возникало слишком много неблагоприятных комбинаций. Персиановский)
Персиановский) 2.014.01
2.014.01 Какое потомство F1 получится от скрещивания чистопородного черного быка с красными коровами?
Какое потомство F1 получится от скрещивания чистопородного черного быка с красными коровами?