реакция | это… Что такое реакция?
ТолкованиеПеревод
- реакция
- реа́кция
[изменение] сущ., ж., употр. сравн. часто
Морфология: (нет) чего? реа́кции, чему? реа́кции, (вижу) что? реа́кцию, чем? реа́кцией, о чём? о реа́кции; мн. что? реа́кции, (нет) чего? реа́кций, чему? реа́кциям, (вижу) что? реа́кции, чем? реа́кциями, о чём? о реа́кциях
1. Реакцией называются физиологические изменения в организме в ответ на внешнее раздражение.Биологическая, рефлекторная реакция. | Реакция вялая, живая.
2. Реакцией называются чьи-либо действия в ответ на внезапные события, неожиданные действия какого-либо другого человека.
Молниеносная реакция. | У кого-либо хорошая (плохая) реакция.
3. Реакцией называется чья-либо отзывчивость, способность к устойчивому восприятию и ответу на какую-либо информацию.Первая реакция зрителей, слушателей. | Реакция на жалобы, на отказ. | Реакция на публикацию. | Нормальная, странная реакция на что-либо. | Типичная реакция.
4. Защитной реакцией называется чьё-либо оптимальное поведение в сложной ситуации, заключающееся в том, что в организме, психике происходят процессы, которые защищают человека от нервной или физической перегрузки.
5. Реакцией называется процесс превращения веществ во что-либо или преобразования атомных ядер.
Химическая, водородная, ядерная реакция. | Реакция гидролиза. | Реакция идёт, закончилась. | В плотном ядре звезды может идти реакция превращения гелия в углерод.
6. Цепной реакцией называется последовательность взаимосвязанных химических процессов, а также последовательность необратимых действий, при которой предыдущее действие вызывает последующее.Достаточно самоустранения одного крупного банка, чтобы пошла цепная реакция банкротств.
• реакцио́нный прил.
[стремление к старому] сущ., ж., употр. нечасто
Реакцией называется стремление закрепить или восстановить в стране старые, отжившие порядки.Скрытая реакция. | Политическая реакция.
 | Николаевская реакция. | Эпоха реакции.
| Николаевская реакция. | Эпоха реакции.
Толковый словарь русского языка Дмитриева. Д. В. Дмитриев. 2003.
.
Игры ⚽ Нужна курсовая?
Синонимы:абреакция, алкилирование, алкоголиз, ацидолиз, воздействие, гелиотаксис, гидратация, гидрирование, гидролиз, гиперреакция, дегидрирование, диазореакция, макрореакция, микрореакция, ответ, отзыв, переэтерификация, преципитация, рефлекс, роэ, серореакция, сольволиз, сульфирование, теломеризация, фотодиссоциация, фотореакция, фототаксис
- рваться
- реализовать
Полезное
Реакции обмена — что это и как составить химическое уравнение?
Поможем понять и полюбить химию
Начать учиться Этот материал поможет вам узнать или вспомнить, что собой представляют реакции ионного обмена, при каких условиях они протекают и как составить уравнение такой реакции.
Что такое реакция ионного обмена
Чтобы дать определение понятию «реакция ионного обмена», разберем его на составные части:
обмен — значит, что у нас есть два сложных вещества, которые чем-то обмениваются между собой;
ионный — значит, что эти вещества обмениваются между собой ионами, то есть заряженными частицами.
Теперь соединим все вместе и получим, что реакция ионного обмена — это химическая реакция между двумя сложными веществами, которая приводит к обмену заряженными частицами (ионами), в результате чего образуются новые сложные соединения.
С определением разобрались, теперь нужно понять, есть ли какие-то условия, которые гарантируют нам протекание химической реакции. С этим нам поможет правило Бертолле.
Правило Бертолле
Реакции ионного обмена возможны и протекают до конца только в том случае, если при взаимодействии выпадает осадок, выделяется газ или образуется малодиссоциирующее вещество (вода).
А между какими соединениями протекают реакции ионного обмена? На самом деле все просто: это кислоты, гидроксиды (растворимые и нерастворимые) и соли.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Примеры реакций ионного обмена
Давайте рассмотрим примеры, которые характеризуют каждый из трех признаков протекания химической реакции:
Выпадение осадка:
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl.
Выделение газа:
Na 2CO3 + 2HCl = H2O + CO2↑ + 2NaCl.
Образование малодиссоциирующего вещества (воды):
NaOH + HCl = H2O + NaCl.
Составление уравнений обменных реакций
Химические уравнения реакций обмена можно записать:
в молекулярной форме:
2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3.

в полной ионной форме — с указанием всех существующих в растворе ионов:
2Na+ + 2Cl− + Pb2+ + 2NO3− = PbCl2↓ + 2Na+ + 2NO3−.
в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов:
Pb2+ + 2Cl− = PbCl2↓.
Перейдем к правилам записи ионных уравнений:
Записываем уравнение в молекулярном виде и обязательно расставляем коэффициенты.
Далее с помощью таблицы растворимости определяем растворимость каждого химического соединения.
Составляем полное ионное уравнение с учетом коэффициентов и не забываем указывать заряды ионов.
Важно помнить, что мы не расписываем на ионы нерастворимые соединения, воду, оксиды, все слабые электролиты, анионы кислотных остатков кислых солей слабых кислот и катионы основных солей слабых оснований, а также комплексные катионы.
Их следует оставить в молекулярной форме.
Находим одинаковые ионы в левой и правой частях полного ионного уравнения и сокращаем их.
Далее переписываем оставшихся участников ионного уравнения и получаем сокращенное ионное уравнение.
Практика
Чтобы новые знания лучше усвоились, немного попрактикуемся. Для проиллюстрированных химических реакций обмена нужно составить молекулярное, полное ионное и сокращенное ионное уравнения:
Решать задачки гораздо интереснее на интерактивной платформе с мгновенной проверкой. А опытный преподаватель тут же поможет разобраться, если ответ получился неправильным или что-то осталось непонятным. Все это ждет учеников на онлайн-курсах по химии в школе Skysmart.
Ксения Боброва
К предыдущей статье
104.4KОсновные функции белков в организме
К следующей статье
Способы получения алкенов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
химических реакций — определение, уравнения, типы, примеры с часто задаваемыми вопросами о химических реакциях.
Что такое химическая реакция?
Химическая реакция, при которой связи внутри молекул реагентов разрываются, а внутри молекул продукта образуются новые связи для образования нового вещества.
Химические реакции происходят повсюду вокруг нас, от метаболизма пищи в нашем организме до того, как солнечный свет является результатом химических реакций. Прежде чем приступить к химическим реакциям, важно знать о физических и химических изменениях.
Прежде чем приступить к химическим реакциям, важно знать о физических и химических изменениях.
Горящая свеча — лучший пример физических и химических изменений. Возьмите свечу и зажгите ее. Со временем мы можем наблюдать, как свеча превращается в воск. Если накрыть свечу банкой, она погаснет.
В демонстрации горение свечи — это химическое изменение, а превращение свечи в воск — физическое изменение. При физическом изменении в основном происходит изменение состояния вещества, но при химическом изменении чаще всего образуется новое вещество, в котором энергия либо выделяется, либо поглощается. Таким образом, можно сделать вывод, что химические изменения сопровождаются определенными физическими изменениями.
Содержание
- Основные понятия химических реакций
- Рекомендуемые видеоролики о химических реакциях
- Химические уравнения
- Типы химических уравнений
- Важные моменты, которые следует помнить
- Часто задаваемые вопросы – Часто задаваемые вопросы
Основные понятия химических реакций
- Химическая реакция — это процесс, который происходит, когда две или более молекул взаимодействуют с образованием нового продукта (продуктов).

- Соединения, которые взаимодействуют с образованием новых соединений, называются реагентами, тогда как вновь образованные соединения называются продуктами.
- Химические реакции играют неотъемлемую роль в различных отраслях промышленности, обычаях и даже в нашей повседневной жизни. Они постоянно происходят в нашем общем окружении; например, ржавление железа, керамики, брожение вина и так далее.
- В химической реакции должно происходить химическое изменение, которое обычно наблюдается с физическими изменениями, такими как осаждение, выделение тепла, изменение цвета и т. д.
- Между двумя атомами, ионами или молекулами может происходить реакция, и они образуют новую связь, и ни один атом не разрушается и не создается, а из реагентов образуется новый продукт.
- Скорость реакции зависит и зависит от таких факторов, как давление, температура, концентрация реагентов.
Рекомендуемые видео
Химические реакции и уравнения — все действия в одном GO
Химические реакции и уравнения
Химические уравнения
Из-за огромного количества химических реакций, происходящих вокруг нас, была разработана номенклатура для упрощения того, как мы выражаем химическую реакцию в форме химического уравнения. Химическое уравнение — это не что иное, как математическое утверждение, которое символизирует образование продукта из реагентов, в то же время указывая определенные условия, при которых была проведена реакция.
Химическое уравнение — это не что иное, как математическое утверждение, которое символизирует образование продукта из реагентов, в то же время указывая определенные условия, при которых была проведена реакция.
Реагенты расположены слева, а образующиеся продукты — справа. Реагенты и продукты соединены однонаправленными или двунаправленными стрелками. Например, реакция
А + В → С + D
Здесь A и B – это реагенты, которые вступают в реакцию с образованием продуктов C и D. В реальном химическом уравнении реагенты обозначаются их химической формулой. Чтобы обеспечить закон сохранения массы, химическое уравнение должно быть сбалансировано, то есть количество атомов с обеих сторон должно быть равным. Это баланс уравнения.
Рассмотрим реальную химическую реакцию между метаном (CH₄) и кислородом (O 2 ),
Здесь мы можем видеть, как число каждого атома в левой части уравновешивается в правой части, как утверждает закон сохранения массы.
Типы химических реакций
Основой различных типов реакций является образующийся продукт, происходящие изменения, участвующие реагенты и так далее. Различные типы реакций
- Реакция горения
- Реакция разложения
- Реакция нейтрализации
- Окислительно-восстановительная реакция
- Осаждение или реакция двойного вытеснения
- Реакция синтеза
1. Реакция горения
Реакция горения – это реакция горючего материала с окислителем с образованием окисленного продукта. Окислитель — это химическое вещество, которое требуется топливу для сжигания, обычно это кислород. Рассмотрим пример горения металлического магния.
\(\begin{array}{l}2 Mg + O_2 \rightarrow 2 MgO + Heat\end{array} \)
Здесь 2 атома магния реагируют с молекулой кислорода, образуя 2 молекулы соединения оксида магния, выделяя при этом некоторое количество тепла.
2. Реакция разложения
Реакция разложения — это реакция, в которой один компонент распадается на несколько продуктов. Должны быть сделаны определенные изменения в энергии в окружающей среде, такие как тепло, свет или электричество, разрушающие связи соединения. Рассмотрим пример разложения карбоната кальция с образованием CaO (негашеной извести), который является основным компонентом цемента.
Должны быть сделаны определенные изменения в энергии в окружающей среде, такие как тепло, свет или электричество, разрушающие связи соединения. Рассмотрим пример разложения карбоната кальция с образованием CaO (негашеной извести), который является основным компонентом цемента.
\(\begin{array}{l}Ca CO_3 (s) \overset{Heat}{\rightarrow} CaO(s) + CO_2 (g) \end{array} \)
Здесь соединение карбонат кальция при нагревании распадается на оксид кальция и углекислый газ.
3. Реакция нейтрализации
Реакция нейтрализации — это в основном реакция между кислотой и основанием, дающая в качестве продуктов соль и воду. Молекула воды образуется в результате комбинации OH – 9ионы 0122 и ионы H + . Общий pH продуктов, когда сильная кислота и сильное основание подвергаются реакции нейтрализации, будет равен 7. Рассмотрим пример реакции нейтрализации между соляной кислотой и гидроксидом натрия с выделением хлорида натрия (поваренной соли) и воды.
\(\begin{array}{l}H Cl + NaOH \rightarrow NaCl +H_2O\end{array} \)
Здесь кислота и основание, соляная кислота и гидроксид натрия реагируют в реакции нейтрализации с образованием хлорида натрия (поваренной соли) и воды в качестве продуктов. 9{2+}+H_2\конец{массив} \)
Здесь атом цинка реагирует с 2 ионами положительно заряженного водорода, которым передаются электроны от атома цинка, и водород становится стабильной молекулой, а ион цинка является продуктом.
5. Осаждение или реакция двойного вытеснения
Это тип реакции замещения, при которой два соединения реагируют и, следовательно, их анионы и катионы меняются местами, образуя два новых продукта. Рассмотрим на примере реакции между нитратом серебра и хлоридом натрия. Продуктами будут хлорид серебра и нитрат натрия после реакции двойного вытеснения.
\(\begin{array}{l}Ag N O_3 + Na Cl \rightarrow Ag Cl + Na N O_3\end{array} \)
Здесь нитрат серебра и хлорид натрия вступают в реакцию двойного замещения. При этом серебро заменяет натрий в хлориде натрия, а натрий соединяется с нитратом, превращаясь в нитрат натрия вместе с хлоридом серебра в качестве продукта.
При этом серебро заменяет натрий в хлориде натрия, а натрий соединяется с нитратом, превращаясь в нитрат натрия вместе с хлоридом серебра в качестве продукта.
6. Реакция синтеза
Реакция синтеза – это один из самых основных типов реакций, в которых несколько простых соединений объединяются при определенных физических условиях с образованием сложного продукта. Продукт всегда будет соединением. Рассмотрим реакцию синтеза хлорида натрия с реагентами твердый натрий и газообразный хлор.
\(\begin{array}{l}2 Na (s) + Cl_{2} (g) \rightarrow 2 NaCl (s)\end{array} \)
Здесь у нас есть 2 атома твердого натрия, реагирующие с газообразным хлором с выделением хлорида натрия, а именно. Поваренная соль как продукт.
Важные моменты, которые следует помнить
- При химическом изменении образуется новое соединение, а при физическом изменении вещество меняет свое состояние существования.
- Атомы, ионы или молекулы, вступающие в реакцию с образованием нового вещества, называются реагентами; образующиеся новые атомы или молекулы являются продуктами.

- Химическая реакция подчиняется закону сохранения массы. То есть атом не разрушается и не создается, а из реагентов образуется только новый продукт.
BYJU’S помогает учащимся, предоставляя по главам и подробные ответы на вопросы книг NCERT. Они могут сравнить свои ответы с образцами ответов, приведенными здесь — Решения NCERT для класса 10 по естественным наукам, глава 1 Химические реакции и уравнения.
Похожие видео
Химические реакции и уравнения
Как химия поможет вам выжить в одиночку на острове?
Часто задаваемые вопросы – Часто задаваемые вопросы
Q1
Что понимается под химической реакцией?
Химическая реакция — это процесс, происходящий при столкновении двух или более молекул с правильной ориентацией и силой, достаточной для образования нового продукта. В этом процессе происходит разрыв и образование связей между атомами. Соединения, которые взаимодействуют с образованием новых соединений, называются реагентами, тогда как вновь образованные соединения называются продуктами.
Q2
Что такое химическая реакция и уравнение?
Химическая реакция, при которой связи внутри молекул реагентов разрываются, а внутри молекул продукта образуются новые связи для образования нового вещества. Химическое уравнение есть не что иное, как математическое утверждение, которое символизирует образование продукта из реагентов.
Q3
Какие бывают типы химических реакций?
В зависимости от образующегося продукта различают следующие типы реакций: реакция горения, реакция разложения, реакция нейтрализации, окислительно-восстановительная реакция, реакция осаждения или реакция двойного вытеснения, реакция синтеза.
Q4
Что такое химическая реакция горения?
Реакция горения — это реакция, при которой вещество вступает в реакцию с газообразным кислородом, высвобождая энергию в виде света и тепла.
Q5
Что такое химическое уравнение?
Химическое уравнение представляет собой математическую формулировку, которая символизирует образование продукта из реагентов при определенных условиях, при которых проводилась реакция. Реагенты помещаются в левую часть уравнения, а продукты помещаются в правую часть уравнения, соединенные однонаправленными или двунаправленными стрелками.
Реагенты помещаются в левую часть уравнения, а продукты помещаются в правую часть уравнения, соединенные однонаправленными или двунаправленными стрелками.
Пример: A + B → C + D
Q6
Что такое реакция разложения?
Реакция разложения — это реакция, при которой химические соединения распадаются на более простые части.
Пример: Карбонат кальция при нагревании разлагается на оксид кальция и диоксид углерода.
CaCO 3 (т) + Тепло → CaO (т) + CO 2 (г)
Q7
Что такое реакция нейтрализации?
Реакция нейтрализации — это реакция между кислотой и основанием с образованием соли и воды.
Пример: Соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия и воды.
HCl + NaOH → NaCl + H 2 O
Q8
Что такое окислительно-восстановительная реакция?
Окислительно-восстановительный потенциал представляет собой химическую реакцию, при которой одновременно происходят окисление и восстановление. В окислительно-восстановительной реакции электроны передаются между двумя реагентами.
В окислительно-восстановительной реакции электроны передаются между двумя реагентами.
Пример: Zn + 2 H + → Zn 2+ + H 2
Q9
Что такое осаждение или реакция двойного замещения?
Осаждение или реакция двойного замещения — это разновидность реакции замещения, при которой два реагента обмениваются ионами с образованием двух новых соединений.
Пример: AB + CD → AD + CB
Q10
Что такое реакция синтеза?
Синтез — это химическая реакция, в которой несколько простых соединений объединяются в определенных физических условиях с образованием сложного продукта.
Пример: 2 Na + Cl 2 → 2 NaCl.
Обзор химических реакций
— Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 235
Химические реакции — это процессы, посредством которых химические вещества взаимодействуют с образованием новых химических веществ с другим составом.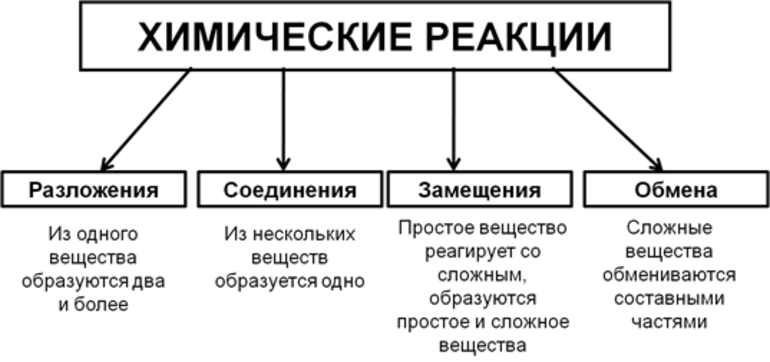 Проще говоря, химическая реакция — это процесс, в котором реагенты превращаются в продукты. То, как химические вещества реагируют, определяется химическими свойствами элемента или соединения — способами, которыми соединение или элемент претерпевают изменения в составе.
Проще говоря, химическая реакция — это процесс, в котором реагенты превращаются в продукты. То, как химические вещества реагируют, определяется химическими свойствами элемента или соединения — способами, которыми соединение или элемент претерпевают изменения в составе.
Количественное описание реакций
Химические реакции постоянно происходят в окружающем нас мире; все, от ржавчины железного забора до метаболических путей человеческой клетки, — все это примеры химических реакций. Химия — это попытка классифицировать и лучше понять эти реакции.
Рисунок \(\PageIndex{0}\): Ржавление цепи является примером химической реакции Химическая реакция обычно представлена химическим уравнением, которое представляет переход от реагентов к продуктам. В левой части уравнения представлены реагенты, а в правой — продукты. Типичная химическая реакция записывается со стехиометрическими коэффициентами, которые показывают относительные количества продуктов и реагентов, участвующих в реакции.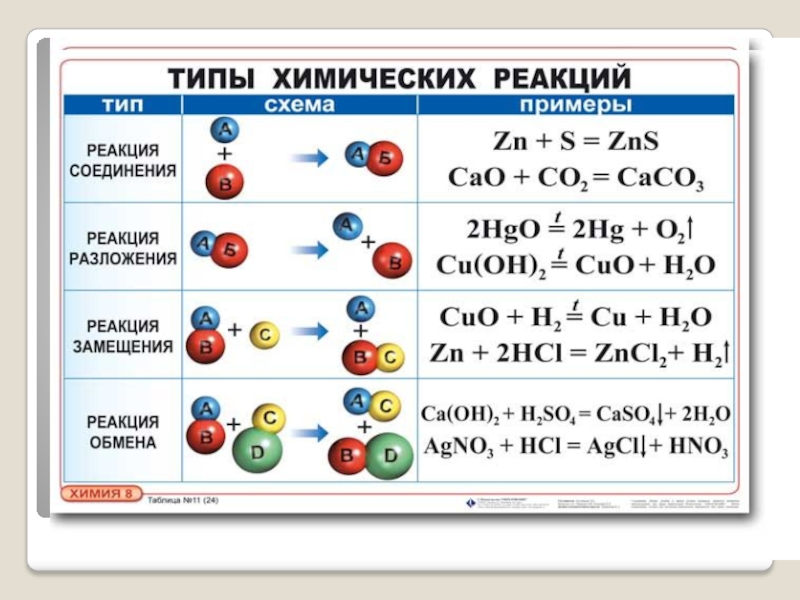 За каждым соединением следует примечание в скобках о состоянии соединения 2: (l) для жидкости, (s) для твердого тела, (g) для газа. Символ (aq) также обычно используется для обозначения водного раствора, в котором соединения растворены в воде. Реакция может иметь следующий вид:
За каждым соединением следует примечание в скобках о состоянии соединения 2: (l) для жидкости, (s) для твердого тела, (g) для газа. Символ (aq) также обычно используется для обозначения водного раствора, в котором соединения растворены в воде. Реакция может иметь следующий вид:
\[\ce{A (aq) + B (g) \rightarrow C (s) + D (l)} \nonumber \]
В приведенном выше примере \(A\) и \(B\) , известные как реагенты, реагировали с образованием \(C\) и \(D\), продуктов.
Чтобы написать точное химическое уравнение, должны произойти две вещи:
- Каждый продукт и реагент должны быть записаны с использованием его химической формулы, например, \(H_2\)
- Количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения. Перед химическими формулами используются коэффициенты, чтобы помочь сбалансировать количество атомов, например,
\[\ce{2Mg + O_2 \rightarrow 2MgO} \nonumber \]
Пример \(\PageIndex{1}\): Уравновешивающие реакции
Водород и азот реагируют вместе с образованием газообразного аммиака, запишите химическое вещество уравнение этой реакции.
Решение
Шаг 1: Запишите каждый продукт и реагент, используя его химическую формулу.
\[\ce{H_2 + N_2 \rightarrow NH_3} \nonumber \]
Шаг 2: Убедитесь, что число атомов каждого элемента одинаково в обеих частях уравнения.
\[\ce{3H_2 + N_2 \rightarrow 2NH_3} \nonumber \]
Чтобы сбалансировать это уравнение, необходимо использовать коэффициенты. Поскольку в левой части уравнения присутствуют только 2 атома азота, к \(NH_3\) необходимо добавить коэффициент 2.
Стехиометрия
Коэффициент, используемый для балансировки уравнения, называется стехиометрическим коэффициентом. Коэффициенты сообщают нам соотношение каждого элемента в химическом уравнении. Например,
\[\ce{2Mg + O_2 \rightarrow 2MgO} \nonumber \]
означает
- 2 моля MgO производится на каждые 2 моля потребляемого Mg.
- 2 моля MgO производится на каждый 1 моль потребляемого O 2 .
Когда все реагенты реакции полностью израсходованы, реакция находится в идеальных стехиометрических пропорциях. Однако часто реакция не находится в идеальных стехиометрических пропорциях, что приводит к ситуации, когда весь один реагент расходуется, но остается некоторое количество другого реагента. Реагент, который полностью израсходован, называется лимитирующим реагентом, и он определяет, сколько продуктов произведено.
Однако часто реакция не находится в идеальных стехиометрических пропорциях, что приводит к ситуации, когда весь один реагент расходуется, но остается некоторое количество другого реагента. Реагент, который полностью израсходован, называется лимитирующим реагентом, и он определяет, сколько продуктов произведено.
Пример \(\PageIndex{2}\): Ограничивающий реагент
4,00 г газообразного водорода, смешанного с 20,0 г газообразного кислорода. Сколько граммов воды образовалось?
Раствор
\[n(H_2)=\dfrac{4g}{(1,008 \times2)g/mol}=1,98mol \nonumber \]
Таким образом, теоретически требуется 0,99 моль \(O_2\)
n(O 2 )=n(H 2 )*(1моль O 2 /2моль H 2 )=0,99 моль
m(O 2 )=n(О 2 ) *(16 г/моль *2) = 31,7 г О 2
Потому что \(O_2\) имеет только 20,0 г, меньше требуемой массы. Это ограничивает.
Часто реагенты не реагируют полностью, в результате чего образуется меньшее количество продукта, чем ожидалось. Количество продукта, которое, согласно химическому уравнению, должно образоваться, называется теоретическим выходом. Количество продукта, которое образуется в ходе реакции, является фактическим выходом. Для определения процентного выхода:
Количество продукта, которое, согласно химическому уравнению, должно образоваться, называется теоретическим выходом. Количество продукта, которое образуется в ходе реакции, является фактическим выходом. Для определения процентного выхода:
Процентный выход = фактический выход/теоретический выход X 100%
Химические реакции происходят не только в воздухе, но и в растворах. В растворе растворитель — это соединение, которое растворено, а растворенное вещество — это соединение, в котором растворен растворитель. Молярность раствора — это количество молей растворителя, деленное на количество литров раствора.
\[\ Молярность=\dfrac{ \text{количество растворенного вещества (моль)}}{\text{объем раствора (л)}} \nonumber \]
\[\ M=\dfrac{n}{ V} \nonumber \]
Пример \(\PageIndex{3}\): Концентрация
100,0 г NaCl растворяют в 50,00 мл воды. Какова молярность раствора?
Раствор
а) Найдите количество растворенного вещества в молях.
100,0 г/(22,99 г/моль+35,45 г/моль) =1,711 моль
b) Перевести мл в л.
50,00 мл=0,05000 л
c) Найти молярность 005 1,711 моль/0,05000 л= 34,22 моль/л
Физические изменения во время химических реакций
Физическое изменение — это изменение физических свойств. Физические изменения обычно происходят при химических реакциях, но не изменяют природу веществ. Наиболее распространенными физическими изменениями во время реакций являются изменение цвета, запаха и выделение газа. Однако, когда происходят физические изменения, химические реакции могут не происходить.
Типы химических реакций
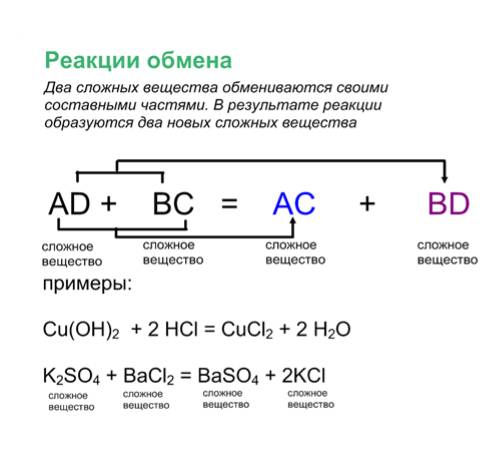
Осаждение или реакция двойного замещения
Реакция, которая происходит, когда водные растворы анионов (отрицательно заряженных ионов) и катионов (положительно заряженных ионов) объединяются с образованием нерастворимого соединения, называется осаждением. . Нерастворимое твердое вещество называют осадком, а оставшуюся жидкость называют супернатантом. См. рис. 2.1.
Рисунок \(\PageIndex{1}\)Пример из реальной жизни: белый осадок, образованный кислотным дождем на мраморной статуе:
\[CaCO_3(aq)+H_2SO_4(aq) \rightarrow CaSO_4(s)+H_2O(l)+CO_2(g) \nonumber \]
Пример \(\PageIndex{4}\): Осадки
An Примером реакции осаждения является реакция между нитратом серебра и иодидом натрия. Эта реакция представлена химическим уравнением:
Эта реакция представлена химическим уравнением:
AgNO 3 (водн.)+ NaI (водн.) → AgI (тв.) + NaNO 3 (водн.)
Поскольку все вышеуказанные соединения находятся в водных растворах, они записываются как ионы в виде:
Ag + +NO 3 — (водн.)+ Na + (водн.) + I — (водн.) → AgI (тв.) + Na + (водн.) + № 3 — (водный)
Ионы, которые появляются в обеих частях уравнения, называются ионами-спектаторами. Эти ионы не влияют на реакцию и удаляются из обеих частей уравнения, чтобы получить итоговое ионное уравнение, как написано ниже:
Ag + (водн.) + I — (водн.) → AgI (тв.)
В этой реакции твердое вещество AgI известно как осадок. Образование осадка является одним из многих индикаторов того, что химическая реакция имела место.
Кислотно-щелочная реакция или реакция нейтрализации
Реакция нейтрализации происходит при смешивании кислоты и основания. Кислота — это вещество, которое образует в растворе ионы H + , тогда как основание — это вещество, которое образует в растворе ионы OH — . Типичная кислотно-щелочная реакция приводит к образованию ионного соединения, называемого солью и водой . Типичной кислотно-щелочной реакцией является реакция между соляной кислотой и гидроксидом натрия. Эта реакция представлена уравнением:
Кислота — это вещество, которое образует в растворе ионы H + , тогда как основание — это вещество, которое образует в растворе ионы OH — . Типичная кислотно-щелочная реакция приводит к образованию ионного соединения, называемого солью и водой . Типичной кислотно-щелочной реакцией является реакция между соляной кислотой и гидроксидом натрия. Эта реакция представлена уравнением:
\[\ce{HCl (водн.) + NaOH (водн.) \rightarrow NaCl (водн.)+ H_2O (ж.)} \nonumber \]
В этой реакции \(HCl\) является кислотой, \(NaOH \) является основанием, а \(NaCl\) является солью. Пример из жизни: пищевая сода вступает в реакцию с уксусом — это реакция нейтрализации.
Видео : Реакция уксуса и пищевой соды с объяснением
Реакции понижения окисления (окислительно-восстановительной)
Аректерская реакция возникает, когда возникает количество окисления атомов, вовлеченных в реакцию. Окисление — это процесс, при котором степень окисления атома увеличивается, а восстановление — это процесс, при котором степень окисления атома уменьшается. Если степени окисления каких-либо элементов в реакции изменяются, реакция является реакцией окисления-восстановления. Атом, который подвергается окислению, называется восстановителем, а атом, который подвергается восстановлению, называется окислителем. Примером окислительно-восстановительной реакции является реакция между газообразным водородом и газообразным фтором:
Окисление — это процесс, при котором степень окисления атома увеличивается, а восстановление — это процесс, при котором степень окисления атома уменьшается. Если степени окисления каких-либо элементов в реакции изменяются, реакция является реакцией окисления-восстановления. Атом, который подвергается окислению, называется восстановителем, а атом, который подвергается восстановлению, называется окислителем. Примером окислительно-восстановительной реакции является реакция между газообразным водородом и газообразным фтором:
\[H_2 (г) + F_2 (г) \rightarrow 2HF (г) \label{redox1} \]
В этой реакции водород окисляется из степени окисления от 0 до +1 и, таким образом, является восстанавливающим агент. Фтор восстанавливается от 0 до -1 и, таким образом, является окислителем.
Рисунок \(\PageIndex{2}\): Рисунок: В окислительно-восстановительной реакции уравнения \(\ref{redox1}\) молекула \(H_2\) отдает электроны \(F_2\), что приводит к образованию двух \(HF \) молекулы Пример из жизни: поверхность разреза яблока становится коричневатой после того, как некоторое время находилась на воздухе.
Видео: Почему яблоки становятся коричневыми?
Реакция горения
Реакция горения — это тип окислительно-восстановительной реакции, во время которой топливо вступает в реакцию с окислителем, что приводит к выделению энергии в виде тепла. Такие реакции являются экзотермическими, то есть во время реакции выделяется энергия. Эндотермическая реакция – реакция с поглощением тепла. Типичная реакция горения имеет углеводород в качестве источника топлива и газообразный кислород в качестве окислителя. Продуктами такой реакции будут \(CO_2\) и \(H_2O\).
\[C_xH_yO_z+O_2 \rightarrow CO_2+H_2O \;\;\; \text{(несбалансированный)} \nonumber \]
Такой реакцией будет сжигание глюкозы в следующем уравнении
\[C_6H_{12}O_6 (s) + 6O_2 (g) \rightarrow 6CO_2 (g) + 6H_2O (g) \номер \]
Пример из жизни: взрыв; сжигание.
youtube.com/embed/UygUcMkRy_c?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>Видео : Реакции горения бывают разными. Вот набор различных примеров, каждый из которых требует кислорода, энергии активации и, конечно же, топлива 9.0495
Реакции синтеза
Реакция синтеза происходит, когда одно или несколько соединений объединяются с образованием комплексного соединения. Простейшее уравнение реакции синтеза показано ниже.
Примером такой реакции является реакция серебра с газообразным кислородом с образованием оксида серебра:
\[2Ag(т) +O_2(г) \rightarrow 2AgO(т) \номер\]
Реальная жизнь пример: газообразный водород сгорает на воздухе (вступает в реакцию с кислородом) с образованием воды:
\[2H_2(g) + O_2(g) \rightarrow 2H_2O(l) \nonumber \]
Реакции разложения
Реакция разложения противоположна реакции синтеза. В ходе реакции разложения более сложное соединение распадается на несколько более простых соединений. Классическим примером такого типа реакции является разложение перекиси водорода на кислород и газообразный водород: 3}\): молекула AB распадается на A и B
Классическим примером такого типа реакции является разложение перекиси водорода на кислород и газообразный водород: 3}\): молекула AB распадается на A и B
Реакции одиночной замены
Тип окислительно-восстановительной реакции, в которой элемент в соединении заменяется другим элементом.
Пример такой реакции:
\[Cu (s) + AgNO_3 (aq) \rightarrow Ag(s) + Cu(NO_3)_2 (aq) \nonumber \]
Это также окислительно-восстановительная реакция.
Проблемы
1) C 3 H 6 O 3 + O 2 → CO 2 (g) +H 2 90 068 О (г)
а) Какой это тип реакции?
б) Является экзотермическим или эндотермическим? Объяснять.
2) Учитывая окислительно-восстановительную реакцию:
Fe(тв) + CuSO 4 (водн.)→ FeSO 4 (водн.)+ Cu(тв)
а) Какой элемент является окислителем и какой восстановитель?
б) Как изменяются степени окисления этих соединений?
3) Учитывая уравнение:
AgNO3 (водн. ) + KBr (водн.) → AgBr (тв.) +KNO 3 (водн.)
) + KBr (водн.) → AgBr (тв.) +KNO 3 (водн.)
а) Какова результирующая ионная реакция?
б) Какие частицы являются ионами-спектаторами?
4) 2 HNO 3 (водн.) + Sr(OH) 2 (водн.) → Sr(NO 3 ) 2 (водн.) +2 H 2 O (л)
а ) Какое соединение в этой реакции является кислотой, а какое основанием?
б) Какой вид является солью?
c) Если используются 2 моля HNO3 и 1 моль Sr(OH)2, что дает 0,85 моля Sr(NO3)2, каков процентный выход (относительно молей) Sr(NO3)2?
5) Определите тип следующих реакций:
a) Al(OH) 3 (водн.) + HCl (водн.) → AlCl 3 (водн.) + H 2 O (ж)
b) MnO 2 + 4H + 90 122 + 2Cl — → Mn 2 + + 2H 2 O (л) + Cl 2 (г)
в) P 4 (т) + Cl 2 9 0068 (г) → PCl 3 (л)
г) Ca (т) + 2H 2 O (л) → Ca(OH) 2 (водн. ) + H 2 (г)
) + H 2 (г)
д) AgNO3 (водн.) + NaCl (водн. ) → AgCl (т) + NaNO 3 (водн.)
Растворы
1a) Это реакция горения
1b) Она экзотермическая, так как реакции горения выделяют тепло
2a) Cu является окислителем, а Fe является восстановителем
2b) Fe изменяется от 0 до + 2, а Cu изменяется от +2 до 0,
3а) Ag + (водн.) + Br — (водн.) → AgBr (т)
3б) Ионы-спектаторы K + и NO 3 —
4a) HNO 3 кислота и Sr(OH) 2 – основание
4b) Sr(NO 3 ) 2 – соль
4c) По стехиометрическим коэффициентам теоретический выход Sr(NO 3 ) 9 0067 2 — один моль . Фактический выход составил 0,85 моль. Следовательно, выход в процентах:
(0,85/1,0) * 100% = 85% реакция
5e) Двойная реакция замещения
Ссылки
- Петруччи, Ральф Х., Уильям С. Харвуд, Ф.
 Г. Херринг и Джеффри Д. Мадура. Общая химия. 9-е изд. Река Верхнее Седло: Prentice Education Inc, 2007, печать.
Г. Херринг и Джеффри Д. Мадура. Общая химия. 9-е изд. Река Верхнее Седло: Prentice Education Inc, 2007, печать.
Авторы и авторство
- Прия Мулей
Обзор химических реакций распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- № на стр.




 | Николаевская реакция. | Эпоха реакции.
| Николаевская реакция. | Эпоха реакции.


 Г. Херринг и Джеффри Д. Мадура. Общая химия. 9-е изд. Река Верхнее Седло: Prentice Education Inc, 2007, печать.
Г. Херринг и Джеффри Д. Мадура. Общая химия. 9-е изд. Река Верхнее Седло: Prentice Education Inc, 2007, печать.