Физиология боли
Физиология боли
В узком смысле слова боль – это неприятное ощущение, возникающее при действии сверхсильных раздражителей, вызывающих структурно-функциональные нарушения в организме. Отличия боли от других ощущений в том, что она не информирует мозг о качестве раздражителя, а указывает на то, что раздражитель является повреждающим. Другой особенностью болевой сенсорной системы является наиболее сложной и мощный ее эфферентный контроль.
Болевой
анализатор запускает в ЦНС несколько
программ ответа организма на боль.
Следовательно, боль имеет несколько
компонентов. Сенсорный компонент
боли характеризует ее как неприятное,
тягостное ощущение; аффективный компонент
– как сильную отрицательную эмоцию;
мотивационный компонент – как
отрицательную биологическую потребность,
запускающую поведение организма,
направленное на выздоровление. Моторный
компонент боли представлен различными
двигательными реакциями: от безусловных
сгибательных рефлексов до двигательных
программ антиболевого поведения.
Биологическая роль боли определяется несколькими факторами. Боль исполняет роль сигнала об угрозе или повреждении тканей организма и предупреждает их. Боль имеет познавательную функцию: человек через боль учится избегать возможных опасностей внешней среды. Эмоциональный компонент боли выполняет функцию подкрепления при образовании условных рефлексов. Боль является фактором мобилизации защитно-приспособительных реакций организма при повреждении его тканей и органов.
Выделяют два вида боли – соматическую и висцеральную. Соматическую боль подразделяют на поверхностную и глубокую Поверхностная боль может быть ранняя (быстрая, эпикрическая) и поздняя (медленная, протопатическая).
Существуют три теории боли.
1. Теория интенсивности была предложена
Э.Дарвином и А.Гольдштейнером. По этой
теории боль не является специфическим
чувством и не имеет своих специальных
рецепторов. Она возникает при действии
сверхсильных раздражителей на рецепторы
пяти известных органов чувств. В
формировании боли участвуют конвергенция
и суммация импульсов в спинном и головном
мозге.
Теория интенсивности была предложена
Э.Дарвином и А.Гольдштейнером. По этой
теории боль не является специфическим
чувством и не имеет своих специальных
рецепторов. Она возникает при действии
сверхсильных раздражителей на рецепторы
пяти известных органов чувств. В
формировании боли участвуют конвергенция
и суммация импульсов в спинном и головном
мозге.
2. Теория специфичности была сформулирована немецким физиологом М.Фреем. В соответствии с этой теорией боль является специфическим чувством, имеющим собственный рецепторный аппарат, афферентные волокна и структуры головного мозга, перерабатывающие болевую информацию. Эта теория в дальнейшем получила более полное экспериментальное и клиническое подтверждение.
3.
Современная теория боли базируется
преимущественно на теории специфичности.
Было доказано существование специфичных
болевых рецепторов. Вместе с тем в
современной теории боли использовано
положение о роли центральной суммации
и конвергенции в механизмах боли.
Наиболее крупными достижениями
современной теории боли является
разработка механизмов центрального
восприятия боли и запуска противоболевой
системы организма.
Болевые рецепторы
Болевые рецепторы являются свободными окончаниями чувствительных миелиновых нервных волокон Аδ и немиелиновых волокон С. Они найдены в коже, слизистых оболочках, надкостнице, зубах, мышцах, суставах, внутренних органах и их оболочках, сосудах. Их нет в нервной ткани головного и спинного мозга. Наибольшая их плотность имеется на границе дентина и эмали зуба.
Выделяют следующие основные типы болевых рецепторов:
1. Механоноцицепторы и механотермические ноцицепторы Аδ-волокон реагируют на сильные механические и термические раздражители, проводят быструю механическую и термическую боль, быстро адаптируются; расположены преимущественно в коже, мышцах, суставах, надкостнице; их афферентные нейроны имеют малые рецептивные поля.
2.
Полисенсорные ноцицепторы С-волокон
реагируют на механические, термические
и химические раздражители, проводят
позднюю плохо локализованную боль,
медленно адаптируются; их афферентные
нейроны имеют большие рецептивные поля.
Болевые рецепторы возбуждаются тремя видами раздражителей:
1. Механические раздражители, создающие давление более 40г/мм2 при сдавливании, растяжении, сгибании, скручивании.
2. Термические раздражители могут быть тепловыми (> 450С) и холодовыми (< 150С).
3. Химические раздражители, освобождающиеся из поврежденных клеток тканей, тучных клеток, тромбоцитов (К
Свойства
болевых рецепторов: болевые рецепторы
имеют высокий порог возбуждения, что
обеспечивает их ответ только на
чрезвычайные раздражители. Ноцицепторы
С-афферентов плохо адаптируются к
длительно действующим раздражителям.
Возможно повышение чувствительности
болевых рецепторов – снижение порога
их раздражения при многократной или
длительной стимуляции, что называется
гипералгезией.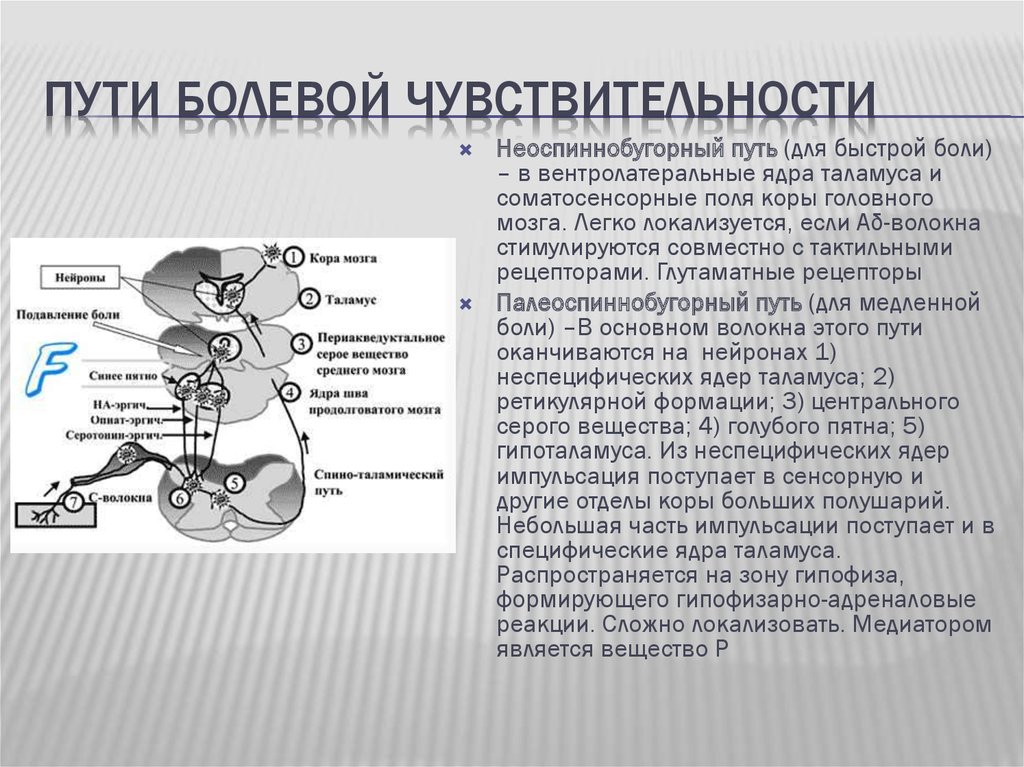 При этом ноцицепторы
способны отвечать на стимулы субпороговой
величины, а также возбуждаться
раздражителями других модальностей.
При этом ноцицепторы
способны отвечать на стимулы субпороговой
величины, а также возбуждаться
раздражителями других модальностей.
Проводящие пути болевой чувствительности
Нейроны,
воспринимающие болевую импульсацию.
От болевых рецепторов туловища, шеи и
конечностей Аδ- и С-волокна первых
чувствительных нейронов (их тела
находятся в спинальных ганглиях) идут
в составе спинномозговых нервов и входят
через задние корешки в спинной мозг,
где разветвляются в задних столбах и
образуют синаптические связи прямо или
через интернейроны со вторыми
чувствительными нейронами, длинные
аксоны которых входят в состав
спиноталамических путей. При этом они
возбуждают два вида нейронов: одни
нейроны активируются только болевыми
стимулами, другие – конвергентные
нейроны – возбуждаются также и неболевыми
стимулами. Вторые нейроны болевой
чувствительности преимущественно
входят в состав боковых спиноталамических
путей, которые и проводят большую часть
болевых импульсов. На уровне спинного
мозга аксоны этих нейронов переходят
на сторону, противоположную раздражению,
в стволе головного мозга они доходят
до таламуса и образуют синапсы на
нейронах его ядер.
Неоспиноталамический путь проводит болевые сигналы по Аδ-волокнам преимущественно в специфические сенсорные (вентральные задние) ядра таламуса, имеющие хорошую топографическую проекцию периферии тела. Кроме этого небольшая часть импульсов поступает в ретикулярную формацию ствола и далее в неспецифические ядра таламуса. Передача возбуждения в синапсах этого пути осуществляется с помощью быстродействующего медиатора глутамата. Из специфических ядер таламуса болевые сигналы передаются преимущественно в сенсорную кору больших полушарий. Эти особенности формируют основную функцию неоспиноталамического пути – проведение «быстрой» боли и восприятие ее с высокой степенью локализации.
Палеоспиноталамический
путь проводит болевые сигналы по
С-волокнам преимущественно в неспецифические
ядра таламуса прямо или после переключения
в нейронах ретикулярной формации ствола
мозга. Передача возбуждения в синапсах
этого пути происходит более медленно.
Медиатором является вещество Р. Из
неспецифических ядер импульсация
поступает в сенсорную и другие отделы
коры больших полушарий. Небольшая часть
импульсации поступает и в специфические
ядра таламуса. В основном волокна этого
пути оканчиваются на нейронах 1)
неспецифических ядер таламуса; 2)
ретикулярной формации; 3) центрального
серого вещества; 4) голубого пятна; 5)
гипоталамуса. Через палеоспиноталамический
путь проводится «поздняя», плохо
локализуемая боль, формируются
аффективно-мотивационные проявления
болевой чувствительности.
Передача возбуждения в синапсах
этого пути происходит более медленно.
Медиатором является вещество Р. Из
неспецифических ядер импульсация
поступает в сенсорную и другие отделы
коры больших полушарий. Небольшая часть
импульсации поступает и в специфические
ядра таламуса. В основном волокна этого
пути оканчиваются на нейронах 1)
неспецифических ядер таламуса; 2)
ретикулярной формации; 3) центрального
серого вещества; 4) голубого пятна; 5)
гипоталамуса. Через палеоспиноталамический
путь проводится «поздняя», плохо
локализуемая боль, формируются
аффективно-мотивационные проявления
болевой чувствительности.
Кроме этого болевая чувствительность частично проводится по другим восходящим путям: переднему спиноталамическому, тонкому и клиновидному путям.
Вышеназванные пути проводят и другие виды чувствительности: температурную и тактильную.
Роль коры больших полушарий в восприятии боли
Полноценное
чувственное восприятие боли организмом
без участия коры головного мозга
невозможно.
Первичное проекционное поле болевого анализатора находится в соматосенсорной коре задней центральной извилины. Оно обеспечивает восприятие «быстрой» боли и идентификацию места ее возникновения на теле. Для более точной идентификации локализации боли в процесс обязательно включается и нейроны моторной коры передней центральной извилины.
Вторичное
проекционное поле расположено в
соматосенсорной коре на границе
пересечения центральной борозды с
верхним краем височной доли. Нейроны
данного поля имеют двусторонние
связи с ядрами таламуса, что позволяет
этому полю избирательно фильтровать,
проходящие через таламус возбуждения
болевого характера. А это в свою очередь
позволяет данному полю вовлекаться в
процессы, связанные с извлечением из
памяти энграммы необходимого поведенческого
акта, его реализации в деятельности
эффекторов и оценки качества достигнутого
полезного результата. Двигательные
компоненты болевого поведения формируются
в совместной деятельности моторной и
премоторной коры, базальных ганглиев
и мозжечка.
Лобная кора играет важную роль в восприятии боли. Она обеспечивает самооценку боли (ее когнитивный компонент) и формирование целенаправленного болевого поведения.
Лимбическая система (поясная извилина, гиппокамп, зубчатая извилина, миндалевидный комплекс височной доли) получает болевую информацию от передних ядер таламуса и формирует эмоциональный компонент боли, запускает вегетативные, соматические и поведенческие реакции, обеспечивающие приспособительные реакции к болевому раздражителю.
Некоторые виды болевых ощущений
Существуют боли, которые названы проекционными или фантомными. Их возникновение основано на законе проекции боли: какая бы часть афферентного пути не раздражалась, боль ощущается в области рецепторов данного сенсорного пути. По современным данным в формировании данного вида болевого ощущения участвуют все отделы болевой сенсорной системы.
Существуют
также так называемые отраженные боли:
когда боль ощущается не только в
пораженном органе, но и в соответствующем
дерматоме тела. Участки поверхности
тела соответствующего дерматома, где
возникает ощущение боли, назвали зонами
Захарьина – Геда.
Возникновение отраженных болей связано
с тем, что нейроны, проводящие болевую
импульсацию от рецепторов пораженного
органа и кожи соответствующего дерматома,
конвергируют на одном и том же нейроне
спиноталамического пути. Раздражение
этого нейрона с рецепторов пораженного
органа в соответствии с законом проекции
боли приводит к тому, что боль ощущается
и в области кожных рецепторов.
Участки поверхности
тела соответствующего дерматома, где
возникает ощущение боли, назвали зонами
Захарьина – Геда.
Возникновение отраженных болей связано
с тем, что нейроны, проводящие болевую
импульсацию от рецепторов пораженного
органа и кожи соответствующего дерматома,
конвергируют на одном и том же нейроне
спиноталамического пути. Раздражение
этого нейрона с рецепторов пораженного
органа в соответствии с законом проекции
боли приводит к тому, что боль ощущается
и в области кожных рецепторов.
Антиноцицептивная система
Антиболевая система состоит из четырех уровней: спинального, стволового, гипоталамического и коркового.
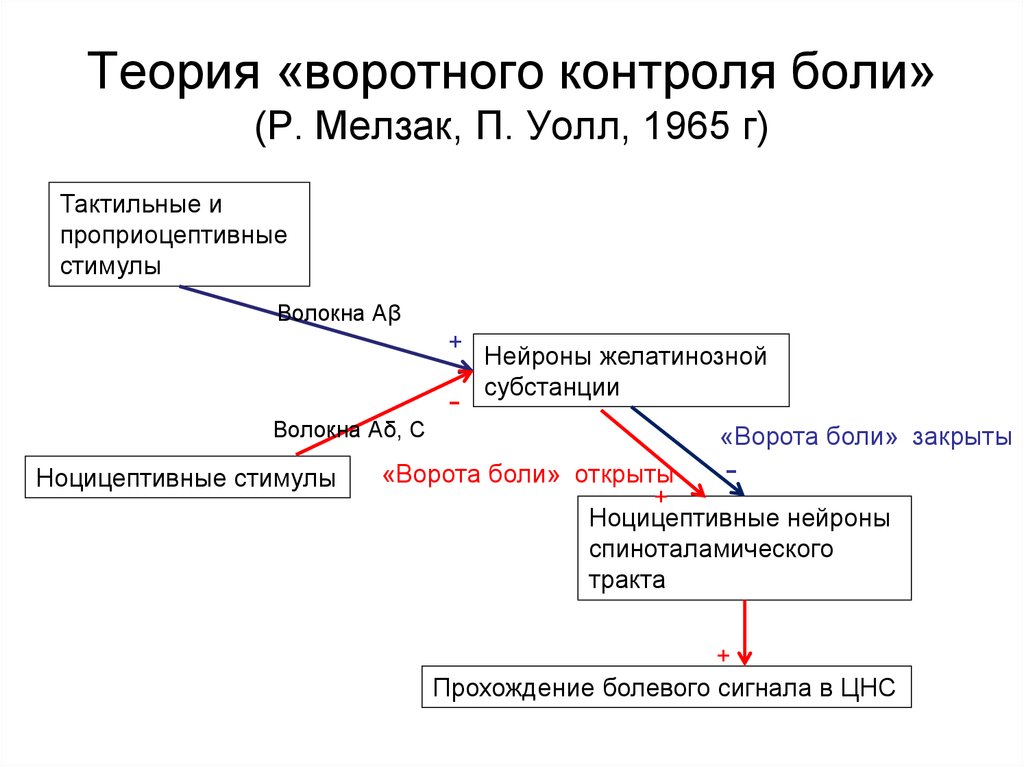
1.
Спинальный уровень антиноцицептовной
системы. Важным ее компонентом
является «воротный контроль» спинного
мозга, концепция которого имеет следующие
основные положения: передача болевых
нервных импульсов с первых нейронов на
нейроны спиноталамических путей
(вторые нейроны) в задних столбах спинного
мозга модулируется спинальным воротным
механизмом – тормозными нейронами,
расположенными в желатинозном веществе
спинного мозга. На этих нейронах
оканчиваются разветвления аксонов
различных сенсорных путей. В свою очередь
нейроны желатинозной субстанции
оказывают пресинаптическое торможение
в местах переключения первых и вторых
нейронов болевых и других сенсорных
путей. Часть нейронов являются
конвергентными: на них образуют синапсы
нейроны не только от болевых, но и от
других рецепторов. Спинальный воротный
контроль регулируется соотношением
импульсов, поступающих по афферентным
волокнам большого диаметра (неболевая
чувствительность) и малого диаметра
(болевая чувствительность). Интенсивный
поток импульсов по волокнам большого
диаметра ограничивает передачу болевых
сигналов на нейроны спиноталамических
путей (закрывает «ворота»). Напротив,
интенсивный поток болевых импульсов
по первому афферентному нейрону,
ингибируя тормозные интернейроны,
облегчает передачу болевых сигналов
на нейроны спиноталамических путей
(открывает «ворота»). Спинальный
воротный механизм находится под
постоянным влиянием нервных импульсов
структур ствола мозга, которые передаются
по нисходящим путям как на нейроны
желатинозной субстанции, так и на нейроны
спиноталамических путей.
На этих нейронах
оканчиваются разветвления аксонов
различных сенсорных путей. В свою очередь
нейроны желатинозной субстанции
оказывают пресинаптическое торможение
в местах переключения первых и вторых
нейронов болевых и других сенсорных
путей. Часть нейронов являются
конвергентными: на них образуют синапсы
нейроны не только от болевых, но и от
других рецепторов. Спинальный воротный
контроль регулируется соотношением
импульсов, поступающих по афферентным
волокнам большого диаметра (неболевая
чувствительность) и малого диаметра
(болевая чувствительность). Интенсивный
поток импульсов по волокнам большого
диаметра ограничивает передачу болевых
сигналов на нейроны спиноталамических
путей (закрывает «ворота»). Напротив,
интенсивный поток болевых импульсов
по первому афферентному нейрону,
ингибируя тормозные интернейроны,
облегчает передачу болевых сигналов
на нейроны спиноталамических путей
(открывает «ворота»). Спинальный
воротный механизм находится под
постоянным влиянием нервных импульсов
структур ствола мозга, которые передаются
по нисходящим путям как на нейроны
желатинозной субстанции, так и на нейроны
спиноталамических путей.
2. Стволой уровень антиноцицептивной системы. К стволовым структурам противоболевой системы относятся, во-первых, центральное серое вещество и ядра шва, образующие единый функциональный блок, во-вторых, крупноклеточное и парагигантоклеточное ядра ретикулярной формации и голубое пятно. Первый комплекс блокирует прохождение болевой импульсации на уровне релейных нейронов ядер задних рогов спинного мозга, а также релейных нейронов сенсорных ядер тройничного нерва, образующих восходящие пути болевой чувствительности. Второй комплекс возбуждает почти всю антиноцицептивную систему (см.рис.1).
3.
Гипоталамический уровень антиноцицептивной
системы, с одной стороны, функционирует
самостоятельно, а с другой – выступает
как настройка, контролирующая и
регулирующая антиноцицептивные механизмы
стволового уровня за счет связей
гипоталамических нейронов разной
ядерной принадлежности и разной
нейрохимической специфичности. Среди
них идентифицированы нейроны, в окончаниях
аксонов которых выделяются энкефалины,
β-эндорфин, норадреналин, дофамин
см. рис.2).
рис.2).
4. Корковый уровень антиноцицептивной системы. Объединяет и контролирует деятельность антиноцицептивных структур различного уровня соматосенсорная область коры больших полушарий. При этом наиболее важную роль в активации спинальных и стволовых структур играет вторичная сенсорная область. Ее нейроны образуют наибольшее количество волокон нисходящего контроля болевой чувствительности, направляющиеся к задним рогам спинного мозга и ядрам ствола головного мозга. Вторичная сенсорная кора видоизменяет активность стволового комплекса антиноцицептивной системы. Кроме этого соматосенсорные поля коры больших полушарий контролируют проведение афферентных болевых импульсов через таламус. Кроме таламуса, кора большого мозга регламентирует прохождение болевой импульсации в гипоталамусе, лимбической системе, ретикулярной формации, спинном мозге. Ведущая роль в обеспечении кортико-гипоталамических влияний отводится нейронам лобной коры.
Медиаторы антиноцицептивной системы
К
медиаторам противоболевой системы
относят пептиды, которые образуются в
головном мозге, аденогипофизе, мозговом
слое надпочечников, желудочно-кишечном
тракте, плаценте из неактивных
предшественников. . Сейчас к опиатным
медиаторам антиноцицептивной системы
относят: 1) ά-, β-, γ-эндорфины; 2) энкефалины;
3) динорфины. Эти медиаторы действуют
на три вида опиатных рецепторов: μ-, δ-,
κ-рецепторы. Наиболее селективным
стимулятором μ-рецепторов являются
эндорфины, δ-рецепторов – энкефалины,
а κ-рецепторов – динорфины. Плотность
μ- и κ-рецепторов высокая в коре больших
полушарий и в спинном мозгу, средняя –
в стволе головного мозга; плотность
δ-рецепторов средняя в коре больших
полушарий и спинном мозгу, малая – в
стволе мозга. Опиоидные пептиды угнетают
действие веществ, вызывающих боль, на
уровне ноцицепторов, уменьшают
возбудимость и проводимость болевой
импульсации, угнетают вызванную реакцию
нейронов, находящихся в составе цепей,
передающих болевую импульсацию. Эти
пептиды поступают к нейронам болевой
сенсорной системы с кровью и ликвором.
Выделяются опиоидные медиаторы в
синаптических окончаниях нейронов
противоболевой системы. Аналгезирующий
эффект эндорфинов высокий в головном
и спинном мозге, эффект энкефалинов
в этих структурах средний, эффект
динорфинов в головном мозге низкий,
в спинном мозге – высокий.
. Сейчас к опиатным
медиаторам антиноцицептивной системы
относят: 1) ά-, β-, γ-эндорфины; 2) энкефалины;
3) динорфины. Эти медиаторы действуют
на три вида опиатных рецепторов: μ-, δ-,
κ-рецепторы. Наиболее селективным
стимулятором μ-рецепторов являются
эндорфины, δ-рецепторов – энкефалины,
а κ-рецепторов – динорфины. Плотность
μ- и κ-рецепторов высокая в коре больших
полушарий и в спинном мозгу, средняя –
в стволе головного мозга; плотность
δ-рецепторов средняя в коре больших
полушарий и спинном мозгу, малая – в
стволе мозга. Опиоидные пептиды угнетают
действие веществ, вызывающих боль, на
уровне ноцицепторов, уменьшают
возбудимость и проводимость болевой
импульсации, угнетают вызванную реакцию
нейронов, находящихся в составе цепей,
передающих болевую импульсацию. Эти
пептиды поступают к нейронам болевой
сенсорной системы с кровью и ликвором.
Выделяются опиоидные медиаторы в
синаптических окончаниях нейронов
противоболевой системы. Аналгезирующий
эффект эндорфинов высокий в головном
и спинном мозге, эффект энкефалинов
в этих структурах средний, эффект
динорфинов в головном мозге низкий,
в спинном мозге – высокий.
Рис.1. Взаимодействие основных элементов обезболивающей системы первого уровня: ствол мозга – спиной мозг. (светлые кружки – возбуждающие нейроны, черные – тормозящие).
Рис.2. Механизм работы обезболивающей системы организма второго уровня (гипоталамус – таламус – ствол мозга) с помощью опиоидов.
Светлые кружки – возбуждающие нейроны, черные — тормозящие.
Степень выраженности болевого ощущения не определяется одной лишь силой экзогенного или эндогенного болевого воздействия. Во многом оно зависит от соотношения активностей ноцицептивного и антиноцицептивного отделов системы боли, что имеет приспособительное значение.
МЕНЮ
Физиология боли — презентация онлайн
1. ФИЗИОЛОГИЯ БОЛИ
Лекция №27Проф. Мухина И.В.
• Боль — это субъективное психоэмоциональное состояние, возникающее
на основе потребности избегания влияния
сильных или разрушающих
раздражителей и проявляющееся в
двигательных и вегетативных реакциях.

• Международная ассоциация изучения
боли квалифицирует боль как
«неприятное сенсорное и эмоциональное
состояние, связанное с предстоящим или
произошедшим повреждением тканей.”
3. Компоненты боли:
1. Сенсорно-дискриминационный — характеризует боль как ощущение, которое можетиметь разную
* интенсивность ,
* локализацию (точную — при повреждении кожи и неточную — при
заболеваниях внутренних органов)
* продолжительность,
* иррадиацию.
2. Эмоциональный — характеризует боль как отрицательную эмоцию, сопровождающуюся
* повышением мышечного тонуса и двигательными актами, направленными на
устранение причин боли (например, принятие вынужденной позы, уменьшающей
болевые ощущения),
* изменением тонуса ВНС,
* мобилизацией всех сил организма на борьбу с болью.
3. Мотивационный — мотивационное поведение, т.е. сложный комплекс поведенческих
реакций, четко направленных на достижение цели в виде устранения причин боли.

Перечисленные компоненты проявляются не всегда. Это зависит от:
* характера действующего болевого раздражителя — его силы и продолжительности;
* состояния организма — типологических особенностей ВНД и текущего эмоционального
состояния.
4. КЛАССИФИКАЦИЯ БОЛИ
В зависимости от причины, вызвавшей болевыеощущения, различают:
1. Физическую боль, связанную с
а) внешними воздействиями,
б) внутренними процессами,
в) повреждением центральных или
периферических отделов нервной системы.
2. Психогенную боль, имеющую неопределенное
начало, возникающую без видимой причины
связанную с негативным эмоциональным
состоянием или неблагоприятными социальными
факторами.
5. По продолжительности боль делят на:
а) острую (обеспечивающую мозг информацией оповреждении). Острая боль может быть первичной
(эпикритическая) и вторичной (протопатическая) своеобразной системой, напоминающей о том, что
активность поврежденного органа должна быть
ограничена и этому органу следует уделять больше
внимания.

б) хроническую, в основе которой лежат несколько
причин:
* повышение чувствительности болевых рецепторов,
* повышенная мощность болетворных агентов,
* ослабление тормозных влияний со стороны ЦНС.
6. По локализации:
1.2.
3.
4.
5.
Локальная,
Диффузная,
Иррадиирующая,
Отраженная,
Фантомная.
Боль подразделяют также на
а) физиологическую, рассматриваемую как
сигнал опасности,
б) патологическую, как отражение
«порочной» обратной связи .
8. НОЦИЦЕПТИВНАЯ СИСТЕМА
• Ноцицепция – комплекс рефлекторныхреакций.
10. Рецепторный уровень
• Теория специфичности (Шеррингтон) — предполагаетсуществование специализированных болевых
рецепторов — ноцицепторов, тогда как,
• Теория неспецифичности — болевых рецепторов не
существует, а ощущения боли возникают при сильном
раздражении любых кожных рецепторов (тактильные,
температурные).
Болевые рецепторы
(ноцицепторы) — свободные
нервные окончания,
имеющие очень низкую
возбудимость и реагирующие
только на сверхсильные
стимулы.

11. Болевые рецепторы
• * механорецепторы, реагирующие на сильныеи сверхсильные механические воздействия.
Механорецепторы являются свободными
нервными окончаниями волокон А-дельта
(Аδ),
* хеморецепторы, воспринимающие действие
определенных болетворных агентов — таких,
как брадикинин, гистамин, ионы водорода,
лейкотоксины, некротоксины, ион К+ и др.
Хеморецепторы являются свободными
нервными окончаниями С-волокон.
12. Проводниковый отдел
На уровне спинного мозга существуют «ворота», которыемогут открываться и закрываться: регулируя поток
информации о боли (гипотеза воротного контроля)
(Melzack, Wall, 1965).
Закрытию этих»ворот» способствует :
1. конкурирующее возбуждение толстых миелиновых
волокон;
2. Нисходящее влияние из высших отделов ЦНС.
Центральный контроль осуществляется на кортикальном
уровне с учетом текущего эмоционального состояния.
Таким образом, не вся болевая информация доходит до
головного мозга.
• Если возбуждение
прошло через
ворота, оно
выходит на
«систему
действия» лемнисковый
путь
переключения в
вентробазальном
комплексе
таламуса — откуда
поступает в
сенсомоторную
кору.
При сильном и длительном болевом
раздражении возбуждение,
распространяясь, охватывает РФ, ГПТ,
лимбическую систему, фронтальную кору.
14. Спиноталамический тракт
• 1.Неоспиноталамический. Быстрое проведение,моносинаптическая передача, Аδ-волокна.
Направлен к специфическим латеральным ядрам
таламуса (вентрозаднелатеральное и
вентрозаднемедиальное). Эпикритическая боль;
• 2. Палеоспиноталамический. Медленное
проведение, полисинаптическая передача, Сволокна. Направлен к неспецифическим
медиальным ядрам таламуса (медиальное,
интраламинарное ядра, срединный центр). Часть
волокон идет к РФ. Протопатическая боль.
16. Центральное звено
• Проекционные зоны: соматосенсорныезоны коры головного мозга (S1 и S2),
постцентральная извилина.
 Формирование
Формированиеболевого ощущения;
• Ассоциативные зоны лобной доли коры
формируют субъективные компоненты
боли.
17. АНТИНОЦИЦЕПТИВНАЯ СИСТЕМА
• Антиноцицептивная система – комплекспериферических и центральных нейрогуморальных механизмов , обеспечивающих
модуляцию ноцицептивной системы, и
направленный на снижение ноцицептивного
возбуждения.
• Точкой приложения противоболевых агентов
являются переключательные звенья
ноцицептивной системы — их блокирование
приводит к уменьшению проведения болевой
информации.
19. Антиноцицептивную систему образуют:
• 1) Опиатные пептиды: эндорфины и энкефалины, вырабатывающиесяв гипоталамусе, гипофизе и стволе мозга.
• 2) Отдельные структуры головного мозга: центральное серое
вещество околопроводного вещества, дорсальное и большое ядра
шва, паравентикулярное и дорсомедиальное ядра гипоталамуса,
хвостатое тело, красное ядро, мозжечок и др. При их раздражении
возникает блокада проведения болевой импульсации практически на
всех уровнях ноцицептивной системы.
 Эти тормозные влияния
Эти тормозные влиянияопосредуются серотонинэргическими механизмами.
• 3) Эмоциогенные зоны гипоталамуса и ретикулярной формации
ствола мозга: при раздражении эмоционально позитивных точек
приводит к уменьшению болевой чувствительности; при стимуляции
малыми силами тока эмоциогенно негативных точек наблюдается
повышение болевой чувствительности, а при увеличении силы
раздражителя наблюдается снижение болевой чувствительности. В
основе такого реагирования лежит катехоламинный механизм.
По механизму антиноцицептивные вещества
разделяют на:
* пептидергические – пептиды эндорфины
(дельта- эндорфин) и энкефалины
(метэнкефалины и лейэнкефалины),
концентрация которых увеличивается при
раздражении околоводопроводного серого
вещества
* катехоламинергические — адреналин
* серотонинергические — серотонин
Средний
мозг
Продолговатый
мозг
Антиноцицептивная система работает
постоянно. Её активация происходит при
нанесении болевого раздражения.
 Вместе с
Вместе сноцицептивной системой она обеспечивает
нормальную болевую чувствительность.
При нарушении баланса
ноцицептивной/антиноцицептивной систем
могут наблюдаться
• гипералгезия;
• гипоалгезия;
• аналгезия.
23. ОСНОВНЫЕ ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ
1. Воздействие на ноцицептивную систему:* блокирование путей проведения болевой
информации — проводниковая анестезия,
разрушение болевых агентов (аспирин),
* воздействие на высшие отделы мозга — создание
положительного эмоционального фона, наркоз.
2. Воздействие на антиноцицептивную систему:
* применение препаратов опия,
*игло-рефлексотерапия,
* стимуляция антиноцицептивных структур мозга
путем вживленных электродов.
СПАСИБО
ЗА ВНИМАНИЕ!
Физиология боли — Аргументы Недели
Аргументы Недели →
Общество
→ № 44(637) от 8. 11.18
13+
11.18
13+
7 ноября 2018, 20:24 Дмитрий ГРУНЮШКИН
Мы продолжаем, как и обещали, разговор с доктором БУБНОВСКИМ. Сергей Михайлович – автор кинезитерапии. Излечения методом движения, если проще.
– СЕРГЕЙ Михайлович, вы говорите: в движении жизнь. И спорт может поставить на ноги если не любого, то почти любого. Но если посмотреть на спортсменов, то подозрительно многие из них умирают ещё не старыми, а едва ли не большинство в зрелом возрасте едва ходят. Выходит, спорт не панацея?
– Но я ничего не говорю о спорте! Спорт – не показатель здоровья. Спорт – это ярмарка ресурсов организма человека, которые вычерпываются полностью за 20 лет в большом спорте, а вместе с тем вычерпывается и жизненная энергия спортсмена, рассчитанная на 100 лет. И если спортсмен не знает правил выхода из спорта (таких большинство), то, прекратив свои занятия, становится больным довольно быстро.
Спорт – это ярмарка ресурсов организма человека, которые вычерпываются полностью за 20 лет в большом спорте, а вместе с тем вычерпывается и жизненная энергия спортсмена, рассчитанная на 100 лет. И если спортсмен не знает правил выхода из спорта (таких большинство), то, прекратив свои занятия, становится больным довольно быстро.
Кинезитерапия – это не спорт, хотя основным лечебным средством в ней является не таблетка, а тренажёр. Это лечение болевых синдромов с помощью специальных тренажёров. Но, чтобы это понять, надо знать физиологию боли. Об этом я пишу в своих книгах. Парадокс в том, что таблетка ассоциируется с лечением, а тренажёр – со спортом. Но дело в том, что кинезитерапия позиционирует себя в основном как лечебная программа при заболевании опорно-двигательного аппарата. По МКБ‑10 (международная классификация болезней) заболевания ОДА классифицируются в разделе «костно-мышечная патология». К ней относятся все остеохондрозы с грыжами и протрузиями, артрозы, сколиозы, плоскостопие и другое.
К ней относятся все остеохондрозы с грыжами и протрузиями, артрозы, сколиозы, плоскостопие и другое.
Обращаю внимание на этот термин, в котором сначала звучит «костно», а затем – «мышечная». Я задаю всем врачам один вопрос – зачем человеку мышцы? Практически все отвечают – двигаться, держать кости и тому подобное. Никто не говорит, что мышцы «кормят» все суставы и органы, доставляя им питание (трофика). Это динамическая анатомия. Что за весь метаболизм (обмен веществ) отвечают мышцы (их где-то 60% тела) – это функциональная физиология. Что иммунная система во многом зависит от содружественной работы мышц – это функциональная гистология (наука о тканях).
Я назвал разделы медицинской науки, не изучаемые в практической медицине. Между тем «золотое правило» терапии звучит так: «Неиспользование скелетной мускулатуры ухудшает состояние всех органов и систем».
Для этого и есть тренажёр, помогающий сидя на полу или даже лёжа создавать движение, аналогичное подтягиванию, и на том уровне физическом, на который способен человек, – 5 или 10 кг.
Дело в том, что в основном именно мышцы пояса верхних конечностей «качают» кровь в сосуды мозга, а не таблетки. Да и миокард не справляется. Это надо понимать. Как накормить сердце кровью, а значит, кислородом, когда миокард не справляется (ишемическая болезнь сердца, то есть недостаток поступления в сердце кислорода)? А помогают сердцу мышцы нижних конечностей. И это надо понимать.
Кардиологи давно зашли в тупик со своими таблетками и перешли на хирургию. А физиологи называют эти мышцы – периферическим внутриорганным сердцем. Но для этого надо бегать (много), ходить (много) или приседать (много). А как это сделать больному, имеющему кроме ИБС остеопороз, артрозы суставов и избыточный вес? Таблетка? Смешно.
Но на тренажёре у нас эти больные и бегают, и ходят, и приседают много но, вы угадали, – лёжа или сидя на полу. А тренажёр помогает создавать условия «насоса», то есть качать мышцами кровь. Принцип: от лёгкого – к тяжёлому, от простого – к сложному. Принцип последовательности и постепенности никто не отменял, и такие лечебные восстанавливающие программы создаются под каждый сустав.
Принцип последовательности и постепенности никто не отменял, и такие лечебные восстанавливающие программы создаются под каждый сустав.
При чём здесь спорт? Как врач – я против большого спорта, но люблю смотреть на возможности организма, которые на самом деле неисчерпаемы, если пользоваться тренажёрами.
У нас есть девиз: «Правильное движение лечит, неправильное калечит». Правильное движение – это не только техника самого движения. Это программа, в которую входят и дыхание, и подбор нужного упражнения, и количество повторений и килограммов, и сочетаемость движения с болезнью. Ещё много того, что надо знать кинезитерапевту.
Одна пациентка пришла на мой диагностический семинар и выступила перед больными, сказав: «Сергей Михайлович, я занимаюсь по вашему методу уже восемь лет и могу сказать одно – это самый лучший метод лечения. В нём очень много нюансов, которые надо знать». Ей 86 лет. Я согласен, поэтому много пишу и выступаю с лекциями и семинарами, не отказываюсь и от ТВ.
Подписывайтесь на Аргументы недели: Новости | Дзен | Telegram
- БУБНОВСКИЙ Сергей Михайлович
- кинезитерапия
- сердце
- тренажеры
Новости МирТесен
Политика
Мнение
Политика
Политика
Политика
В мире
Общество
В мире
Политика
Политика
Интервью
Новости МирТесен
Политика
В мире
В мире
Общество
Культура
Политика
Политика
Политика
Политика
Современный взгляд на теорию боли.
 Методы лечения боли.
Методы лечения боли.Рекомендуем ознакомиться: План мероприятий на 2022 год
Клиника экспериментальной терапии РОНЦ им. Н.Н. Блохина РАМН с ООО «Биоконтроль»
«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии – ВИТАР»
к.б.н. Корнюшенков Е.А.
Боль – понятие клиническое и патогенетически сложное. Боль определяют как «неприятное ощущение и эмоциональное испытание, связанное с имеющимся или потенциальным повреждением тканей, либо же испытываемое в момент этого повреждения» (М. Ферранте 2001). Между местом повреждения и моментом восприятия боли лежит целая серия сложных электрохимических явлений, объединенных термином «ноцицепция». Ноцицепция включает четыре физиологических процесса:
Трансдукция – процесс, при котором повреждающее воздействие трансформируется в виде электрической активности на окончаниях чувствительных нервов.
Трансмиссия – проведение нервных импульсов по системе чувствительных нервов.
Модуляция – это процесс, при котором ноцицептивная трансмиссия модифицируется под влиянием невральных воздействий.
Перцепция – является финальным процессом, при котором трансдукция, трансмиссия и модуляция, взаимодействуя с индивидуальными физиологическими особенностями, создают конечное субъективное эмоциональное ощущение, воспринимаемое как боль.
Традиционно рассматриваются две основные теории болевого восприятия. Согласно первой, выдвинутой M. Frey, в коже имеются болевые рецепторы, от которых начинаются специфические афферентные пути к головному мозгу. Было показано, что при раздражении кожи человека с помощью металлических электродов, прикосновение которых даже не ощущалось, выявлялись «точки», пороговая стимуляция которых воспринималось как резкая нестерпимая боль. Вторая теория, предложенная Goldscheider, говорит о том, что любой сенсорный стимул, достигающий определенной интенсивности, может вызвать боль. Другими словами, не существует специфических болевых структур, а боль является результатом суммации термических, механических и других сенсорных импульсов. Названная вначале теория интенсивности, позже она стала более известна как теория «паттерна» или «суммации». Однако исследования последних лет, посвященные изучению анатомии и физиологии боли, в большой степени «примирили» эти две оппозиционных теории.
Названная вначале теория интенсивности, позже она стала более известна как теория «паттерна» или «суммации». Однако исследования последних лет, посвященные изучению анатомии и физиологии боли, в большой степени «примирили» эти две оппозиционных теории.
В настоящее время установлено, что существует два типа периферических дистальных сенсорных нейронов, наиболее активно реагирующих на ноцицептивные стимулы. Первый тип – это очень тонкие, слабомиелинизированные, так называемые С — волокна (0.4-1.1 мкм в диаметре), вторые – тонкие, миелинизированные А – дельта волокна (1-5 мкм в диаметре). Согласно современным данным, периферические рецепторы этих нейронов в большом количестве в различных тканях и органах и имеют множество концевых разветвлений с мелкими акзоплазматическими отростками, которые и являются структурами, активируемыми болевым воздействием. На основании изучения ответных характеристик этих тонких афферентов было выделено три их вида: механосенситивные, термосенситивные и полимодальные ноцицепторы.
С активацией афферентных волокон определенного типа связывают различные виды болевых ощущений: так называемую первичную – коротколатентную, хорошо локализованную и качественно детерминированную боль, и вторичную – длиннолатентную, плохо локализованную, тягостную, тупую боль. Экспериментально установлено, что «первичная» боль связана с афферентной импульсацией в А–волокнах, а «вторичная» — с С–волокнами. Однако А–дельта С-волокна не являются исключительно проводниками болевой чувствительности, они активируются также неповреждающими термическими (тепловыми, холодовыми) и механическими (прикосновение, небольшое сдавление) стимулами.
Антиноцицептивная система
В формирование финального болевого ощущения существенную роль играют антиноцицептивные системы (АС). Так же, как ноцицептивные, АС формируются на разных уровнях нервной системы. Первое звено АС представлено воротным контролем боли на уровне заднего рога спинного мозга. Усиление активности толстых миелиновых сенсорных волокон тормозит передачу ноцицептивной передачи.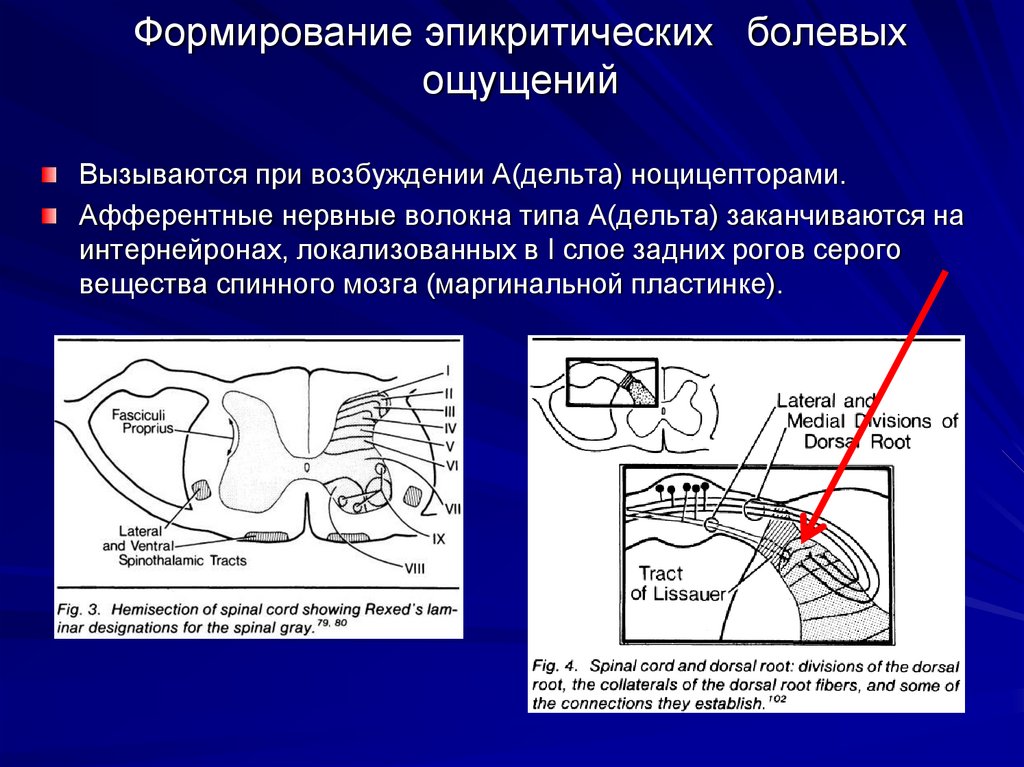 На этом основаны анальгетические эффекты чрескожной электронейростимуляциии других стимуляционных воздействий, способствующих усилению афферентации по хорошо миелинизированным толстым сенсорным волокнам. Если болепроводящие восходящие пути были известны уже достаточно давно, то нисходящие пути, контролирующие боль, изучены относительно недавно.
На этом основаны анальгетические эффекты чрескожной электронейростимуляциии других стимуляционных воздействий, способствующих усилению афферентации по хорошо миелинизированным толстым сенсорным волокнам. Если болепроводящие восходящие пути были известны уже достаточно давно, то нисходящие пути, контролирующие боль, изучены относительно недавно.
Другой АС является система нисходящих связей ядер ретикулярной формации ствола головного мозга. По некоторым данным, стимуляция ретикулярных ядер ствола в значительно большой степени, чем раздражение ядер шва, угнетает передачу ноцицептивной информации в спинном мозге.
Медиаторы АС
Существенным механизмом контроля боли являются эндогенные опиатные системы. Опиатные рецепторы обнаружены в терминальных тонких А — дельта и С – волокон, в нейронах задних рогов спинного мозга, в ретикулярных ядрах ствола головного мозга, таламусе, лимбической системе. В последнее время идентифицированы нейропептиды (эндорфины, энкефалины), обладающие специфическим морфиноподобным действием на эти рецепторы, обеспечивающие анальгетический эффект при высвобождении из депозитов и, присоединяясь к специфическим рецепторам
нейронов, вовлеченных в передачу нервных импульсов. Их высвобождение может быть стимулировано как периферическими ноцицептивными, так и исходящими, контролирующими боль системами.
Их высвобождение может быть стимулировано как периферическими ноцицептивными, так и исходящими, контролирующими боль системами.
Методы оценки болевого синдрома
В ветеринарии, как и в педиатрии это наименее изученный вопрос. Тот факт что животные и дети не могут объективно рассказать о степени боли, ее локализации заставляет клиницистов применять различные визуально-аналоговые шкалы. Как правило, они представляют собой некую оценку клинических симптомов, по которым врач может судить испытывает ли пациент болевой симптом или нет. Одна из таких шкал была представлена на рассмотрение в институте боли в Глазго (шкала M.Gilla). Она включала в себя следующие моменты: врач оценивал позу животного; звуковое выражение боли; реакцию на прикосновение к животному; общее поведение животного; внимание животного к ране (достоверность ошибки данного вида оценки составляет, по мнению авторов 10-20%).
Другим методом оценки (или дополнительным методом) могут служить данные о характере оперативного вмешательства (Таб. 1).
1).
Таблица 1. Ожидаемая степень боли, вызванная хирургической операцией.
| Ожидаемая степень боли | Тип хирургического вмешательства | Средняя продолжительность боли (в баллах) |
| Умеренная | Маленькие н/о кожи | 0.5 — 1.0 |
| Умеренно выраженная | Большие опухоли кожи, мастэктомия, рутинная стоматология | 1.5 — 3.0 |
| Выраженная | Артротомия, каудальная абдоминальная хирургия, грудино-поясничный уровень при ламинэктомии | 3.0- 4.0 |
| Средней тяжести | Травматология и ортопедия, абдоминальная хирургия, овариогистерэктомия | 3.0 – 6.0 |
| Тяжелая | Нейрохирургия головы и шей, офтальмология, ТРНСП, ринотомия, торакальная хирургия | 4.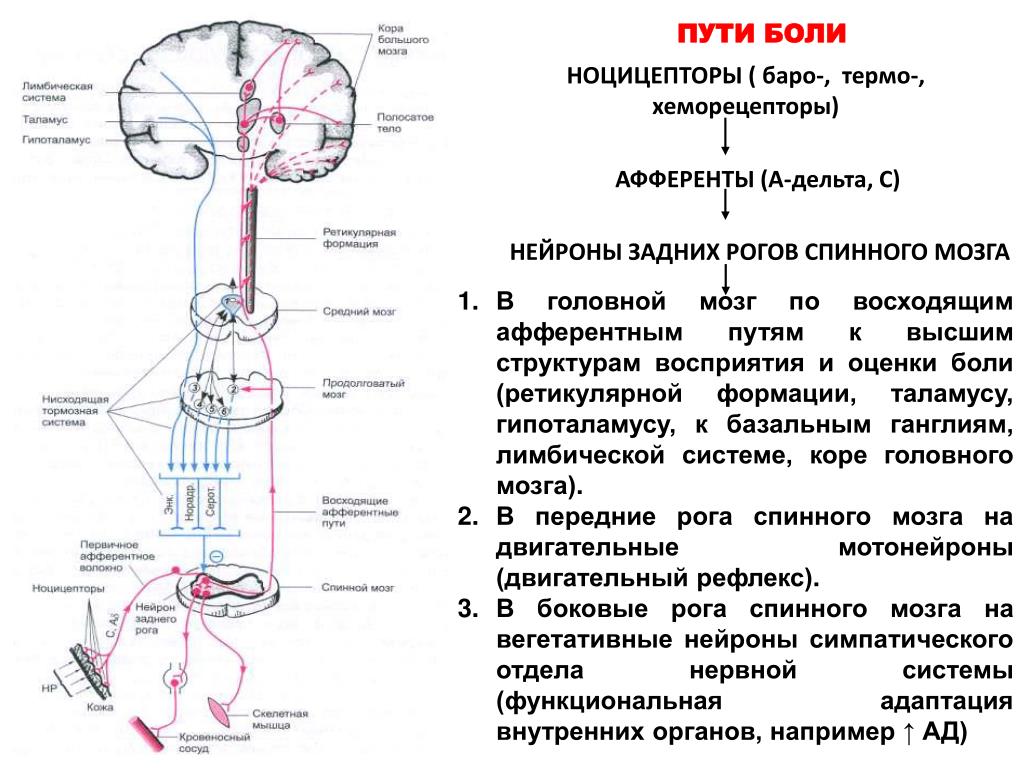 0 – 8.0 0 – 8.0 |
Методы лечения боли
К группам препаратов способных блокировать болевой синдром относятся:
- Наркотические анальгетики
- Ненаркотические анальгетики
- Нестероидные противовоспалительные препараты
- Местные анестетики
- Глюкокортикостероиды
- Спазмолитики
- Ингибиторы факторов воспаления
Мы рассмотрим лишь некоторые группы.
Наркотические анальгетики
Механизм действия наркотических анальгетиков (опиоидов) не достаточно изучен. Считается, что опиоиды способствуют образованию нейропептидов (эндорфинов, энкефалинов), которые образуют лиганд с опиоидными рецепторами тем самым ликвидируя болевой синдром.
По своей активности на опиоидные рецепторы наркотические анальгетики классифицируются на полные агонисты (морфин, фентанил, промедол), частичные агонисты или агонист-антагонисты (буторфанол, трамадол, налбуфин), и полные антагонисты (налаксон).
Ненаркотические анальгетики
К данной группе препаратов широко используемых в ветеринарии относятся анальгетики-антиперетики (анальгин) и нестероидные противовоспалительные препараты (НПВП). Как правило, лечение данной группой препаратов используется при лечении слабовыраженного болевого синдрома или в случаях хронического болевого синдрома (НПВП при остеоартрозах).
Как правило, лечение данной группой препаратов используется при лечении слабовыраженного болевого синдрома или в случаях хронического болевого синдрома (НПВП при остеоартрозах).
Местные анестетики
Достаточно часто используются в качестве средств для регионарного введения, а также в режиме постоянной контролируемой инфузии (CR – Infusion). Наиболее часто используют такие препараты как лидокаин 2%, 10%, бупивакаин 0.5% и ропивакаин 0.75%. Особенность проявляется при использовании местных анестетиков у кошек. Кошки наиболее подвержены токсическим явлениям. Они проявляются у них беспокойством, гиперсаливацией, седацией, рвотой. Поэтому методику внутривенного применения постоянной контролируемой инфузии у этого вида животных стараются не применять.
ФИЗИОЛОГИЯ БОЛИ — презентация на Slide-Share.ru 🎓
1
Первый слайд презентации: ФИЗИОЛОГИЯ БОЛИ
Лекция №32 Лечебный факультет 2018
Изображение слайда
2
Слайд 2
Боль — это субъективное психо-эмоциональное состояние, возникающее на основе потребности избегания влияния сильных или разрушающих раздражителей и проявляющееся в двигательных и вегетативных реакциях. Международная ассоциация изучения боли квалифицирует боль как «неприятное сенсорное и эмоциональное состояние, связанное с предстоящим или произошедшим повреждением тканей.”
Международная ассоциация изучения боли квалифицирует боль как «неприятное сенсорное и эмоциональное состояние, связанное с предстоящим или произошедшим повреждением тканей.”
Изображение слайда
3
Слайд 3: Компоненты боли:
1. Сенсорно-дискриминационный — характеризует боль как ощущение, которое может иметь разную * интенсивность, * локализацию (точную — при повреждении кожи и неточную — при заболеваниях внутренних органов) * продолжительность, * иррадиацию.
Изображение слайда
4
Слайд 4
2. Эмоциональный — характеризует боль как отрицательную эмоцию, сопровождающуюся
* повышением мышечного тонуса и двигательными актами, направленными на устранение причин боли (например, принятие вынужденной позы, уменьшающей болевые ощущения),
* изменением тонуса ВНС,
* мобилизацией всех сил организма на борьбу с болью.
Изображение слайда
5
Слайд 5
3. Мотивационный — мотивационное поведение, т.е. сложный комплекс поведенческих реакций, четко направленных на достижение цели в виде устранения причин боли. Перечисленные компоненты проявляются не всегда. Это зависит от: * характера действующего болевого раздражителя — его силы и продолжительности; * состояния организма — типологических особенностей ВНД и текущего эмоционального состояния.
Изображение слайда
6
Слайд 6: КЛАССИФИКАЦИЯ БОЛИ
В зависимости от причины, вызвавшей болевые ощущения, различают:
1. Физическую боль, связанную с
а) внешними воздействиями,
б) внутренними процессами,
в) повреждением центральных или периферических отделов нервной системы. 2. Психогенную боль, имеющую неопределенное начало, возникающую без видимой причины связанную с негативным эмоциональным состоянием или неблагоприятными социальными факторами.
2. Психогенную боль, имеющую неопределенное начало, возникающую без видимой причины связанную с негативным эмоциональным состоянием или неблагоприятными социальными факторами.
Изображение слайда
7
Слайд 7: По продолжительности боль делят на:
а) острую (обеспечивающую мозг информацией о повреждении). Острая боль может быть 1. Первичной ( эпикритическая ) и 2. Вторичной ( протопатическая ) — своеобразной системой, напоминающей о том, что активность поврежденного органа должна быть ограничена и этому органу следует уделять больше внимания. б) хроническую, в основе которой лежат несколько причин: * повышение чувствительности болевых рецепторов, * повышенная мощность болетворных агентов, * ослабление тормозных влияний со стороны ЦНС.
Изображение слайда
8
Слайд 8: По локализации :
Локальная,
Диффузная,
Иррадиирующая,
Отраженная,
Фантомная.
Изображение слайда
9
Слайд 9
Боль подразделяют также на а) физиологическую, рассматриваемую как сигнал опасности, б) патологическую, как отражение «порочной» обратной связи.
Изображение слайда
10
Слайд 10: НОЦИЦЕПТИВНАЯ СИСТЕМА
Изображение слайда
11
Слайд 11
Ноцицепция – комплекс рефлекторных реакций на сильный (болевой) раздражитель.
Изображение слайда
12
Слайд 12: Рецепторный уровень
Теория специфичности (Шеррингтон) — предполагает существование специализированных болевых рецепторов — ноцицепторов, тогда как,
Теория неспецифичности ( Зевеке А.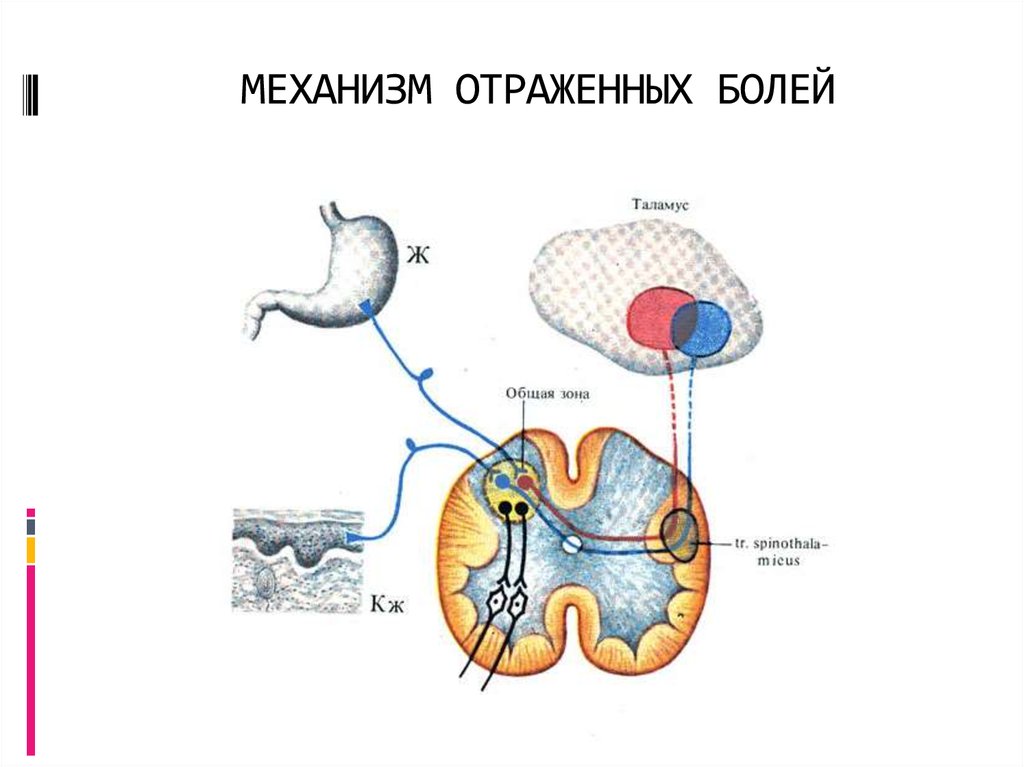 В.) — болевых рецепторов не существует, а ощущения боли возникают при сильном раздражении любых кожных рецепторов (тактильные, температурные).
Болевые рецепторы ( ноцицепторы ) — свободные нервные окончания, имеющие очень низкую возбудимость и реагирующие только на сверхсильные стимулы.
В.) — болевых рецепторов не существует, а ощущения боли возникают при сильном раздражении любых кожных рецепторов (тактильные, температурные).
Болевые рецепторы ( ноцицепторы ) — свободные нервные окончания, имеющие очень низкую возбудимость и реагирующие только на сверхсильные стимулы.
Изображение слайда
13
Слайд 13: Болевые рецепторы
механорецепторы, реагирующие на сильные и сверхсильные механические воздействия. Механорецепторы являются свободными нервными окончаниями волокон А-дельта (А δ ), хеморецепторы, воспринимающие действие определенных болетворных агентов ( алгогенов )- таких, как брадикинин, гистамин, ионы водорода, лейкотоксины, некротоксины, ион К + и др. Хеморецепторы являются свободными нервными окончаниями С-волокон.
Изображение слайда
14
Слайд 14: Проводниковый отдел
На уровне спинного мозга существуют «ворота», которые могут открываться и закрываться: регулируя поток информации о боли ( гипотеза воротного контроля ) ( Melzack, Wall, 1965). Закрытию этих»ворот» способствует :
конкурирующее возбуждение толстых миелиновых волокон;
Нисходящее влияние из высших отделов ЦНС.
Центральный контроль осуществляется на кортикальном уровне с учетом текущего эмоционального состояния.
Не вся болевая информация доходит до головного мозга
Закрытию этих»ворот» способствует :
конкурирующее возбуждение толстых миелиновых волокон;
Нисходящее влияние из высших отделов ЦНС.
Центральный контроль осуществляется на кортикальном уровне с учетом текущего эмоционального состояния.
Не вся болевая информация доходит до головного мозга
Изображение слайда
15
Слайд 15: Теория входного контроля ( Р.Мелзак, П.Волл )
Механизм работает на уровне спинного мозга
Изображение слайда
16
Слайд 16
Если возбуждение прошло через ворота, оно выходит на «систему действия» — лемнисковый путь переключения в вентробазальном комплексе таламуса — откуда поступает в сенсомоторную кору.
При сильном и длительном болевом раздражении возбуждение, распространяясь, охватывает РФ, ГПТ, лимбическую систему, фронтальную кору.
Изображение слайда
17
Слайд 17: Спиноталамический тракт
1.Неоспиноталамический. Быстрое проведение, моносинаптическая передача, А δ -волокна. Направлен к специфическим латеральным ядрам таламуса ( вентрозаднелатеральное и вентрозаднемедиальное ). Эпикритическая боль ; 2. Палеоспиноталамический. Медленное проведение, полисинаптическая передача, С-волокна. Направлен к неспецифическим медиальным ядрам таламуса (медиальное, интраламинарное ядра, срединный центр). Часть волокон идет к РФ. Протопатическая боль.
Изображение слайда
18
Слайд 18
Изображение слайда
19
Слайд 19: Центральное звено
Проекционные зоны : соматосенсорные зоны коры головного мозга ( S1 и S2 ), постцентральная извилина. Формирование болевого ощущения;
Ассоциативные зоны лобной доли коры формируют субъективные компоненты боли (образ).
Формирование болевого ощущения;
Ассоциативные зоны лобной доли коры формируют субъективные компоненты боли (образ).
Изображение слайда
20
Слайд 20: АНТИНОЦИЦЕПТИВНАЯ СИСТЕМА
Изображение слайда
21
Слайд 21
Антиноцицептивная система – комплекс периферических и центральных нейро-гуморальных механизмов, обеспечивающих модуляцию ноцицептивной системы, и направленный на снижение ноцицептивного возбуждения. Точкой приложения противоболевых агентов являются переключательные звенья ноцицептивной системы — их блокирование приводит к уменьшению проведения болевой информации.
Изображение слайда
22
Слайд 22: Антиноцицептивную систему образуют:
1) Опиатные пептиды : эндорфины и энкефалины, вырабатывающиеся в гипоталамусе, гипофизе и стволе мозга. 2) Отдельные структуры головного мозга : центральное серое вещество околопроводного вещества, дорсальное и большое ядра шва, паравентикулярное и дорсомедиальное ядра гипоталамуса, хвостатое тело, красное ядро, мозжечок и др. При их раздражении возникает блокада проведения болевой импульсации практически на всех уровнях ноцицептивной системы. Эти тормозные влияния опосредуются серотонинэргическими механизмами.
3) Эмоциогенные зоны гипоталамуса и ретикулярной формации ствола мозга :
раздражение эмоционально позитивных точек приводит к уменьшению болевой чувствительности;
раздражение эмоционально негативных точек наблюдается повышение болевой чувствительности, а при увеличении силы раздражителя наблюдается снижение болевой чувствительности. В основе такого реагирования лежит катехоламинный механизм.
2) Отдельные структуры головного мозга : центральное серое вещество околопроводного вещества, дорсальное и большое ядра шва, паравентикулярное и дорсомедиальное ядра гипоталамуса, хвостатое тело, красное ядро, мозжечок и др. При их раздражении возникает блокада проведения болевой импульсации практически на всех уровнях ноцицептивной системы. Эти тормозные влияния опосредуются серотонинэргическими механизмами.
3) Эмоциогенные зоны гипоталамуса и ретикулярной формации ствола мозга :
раздражение эмоционально позитивных точек приводит к уменьшению болевой чувствительности;
раздражение эмоционально негативных точек наблюдается повышение болевой чувствительности, а при увеличении силы раздражителя наблюдается снижение болевой чувствительности. В основе такого реагирования лежит катехоламинный механизм.
Изображение слайда
23
Слайд 23: По механизму антиноцицептивные вещества разделяют на:
пептидергические – пептиды эндорфины (дельта- эндорфин) и энкефалины ( метэнкефалины и лейэнкефалины ), концентрация которых увеличивается при раздражении околоводопроводного серого вещества катехоламинергические — адреналин серотонинергические — серотонин
Изображение слайда
24
Слайд 24
Продолговатый мозг Средний мозг
Изображение слайда
25
Слайд 25
Антиноцицептивная система работает постоянно. Её активация происходит при нанесении болевого раздражения. Вместе с ноцицептивной системой она обеспечивает нормальную болевую чувствительность.
При нарушении баланса ноцицептивной / антиноцицептивной систем могут наблюдаться
гипералгезия ;
гипоалгезия ;
аналгезия.
Её активация происходит при нанесении болевого раздражения. Вместе с ноцицептивной системой она обеспечивает нормальную болевую чувствительность.
При нарушении баланса ноцицептивной / антиноцицептивной систем могут наблюдаться
гипералгезия ;
гипоалгезия ;
аналгезия.
Изображение слайда
26
Слайд 26: ОСНОВНЫЕ ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ
1. Воздействие на ноцицептивную систему : * блокирование путей проведения болевой информации — проводниковая анестезия, разрушение болевых агентов (аспирин), * воздействие на высшие отделы мозга — создание положительного эмоционального фона, наркоз. 2. Воздействие на антиноцицептивную систему: * применение препаратов опия, * игло -рефлексотерапия, * стимуляция антиноцицептивных структур мозга путем вживленных электродов
Изображение слайда
27
Последний слайд презентации: ФИЗИОЛОГИЯ БОЛИ
СПАСИБО ЗА ВНИМАНИЕ!
Изображение слайда
Физиология боли — Справочник — 2022
Физиология боли реферат
В узком смысле слова боль – это неприятное ощущение, возникающее при действии сверхсильных раздражителей, вызывающих структурно-функциональные нарушения в организме. Отличия боли от других ощущений в том, что она не информирует мозг о качестве раздражителя, а указывает на то, что раздражитель является повреждающим. Другой особенностью болевой сенсорной системы является наиболее сложной и мощный ее эфферентный контроль.
Отличия боли от других ощущений в том, что она не информирует мозг о качестве раздражителя, а указывает на то, что раздражитель является повреждающим. Другой особенностью болевой сенсорной системы является наиболее сложной и мощный ее эфферентный контроль.
Болевой анализатор запускает в ЦНС несколько программ ответа организма на боль. Следовательно, боль имеет несколько компонентов. Сенсорный компонент боли характеризует ее как неприятное, тягостное ощущение; аффективный компонент – как сильную отрицательную эмоцию; мотивационный компонент – как отрицательную биологическую потребность, запускающую поведение организма, направленное на выздоровление. Моторный компонент боли представлен различными двигательными реакциями: от безусловных сгибательных рефлексов до двигательных программ антиболевого поведения. Вегетативный компонент характеризует нарушение функций внутренних органов и обмена веществ при хронических болях. Когнитивный компонент связан с самооценкой боли, боль при этом выступает как страдание. При деятельности других систем эти компоненты слабо выражены.
При деятельности других систем эти компоненты слабо выражены.
Биологическая роль боли определяется несколькими факторами. Боль исполняет роль сигнала об угрозе или повреждении тканей организма и предупреждает их. Боль имеет познавательную функцию: человек через боль учится избегать возможных опасностей внешней среды. Эмоциональный компонент боли выполняет функцию подкрепления при образовании условных рефлексов. Боль является фактором мобилизации защитно-приспособительных реакций организма при повреждении его тканей и органов.
Выделяют два вида боли – соматическую и висцеральную. Соматическую боль подразделяют на поверхностную и глубокую Поверхностная боль может быть ранняя (быстрая, эпикрическая) и поздняя (медленная, протопатическая).
Существуют три теории боли.
1. Теория интенсивности была предложена Э. Дарвином и А. Гольдштейнером. По этой теории боль не является специфическим чувством и не имеет своих специальных рецепторов. Она возникает при действии сверхсильных раздражителей на рецепторы пяти известных органов чувств. В формировании боли участвуют конвергенция и суммация импульсов в спинном и головном мозге.
В формировании боли участвуют конвергенция и суммация импульсов в спинном и головном мозге.
2. Теория специфичности была сформулирована немецким физиологом М. Фреем. В соответствии с этой теорией боль является специфическим чувством, имеющим собственный рецепторный аппарат, афферентные волокна и структуры головного мозга, перерабатывающие болевую информацию. Эта теория в дальнейшем получила более полное экспериментальное и клиническое подтверждение.
3. Современная теория боли базируется преимущественно на теории специфичности. Было доказано существование специфичных болевых рецепторов. Вместе с тем в современной теории боли использовано положение о роли центральной суммации и конвергенции в механизмах боли. Наиболее крупными достижениями современной теории боли является разработка механизмов центрального восприятия боли и запуска противоболевой системы организма.
Болевые рецепторы являются свободными окончаниями чувствительных миелиновых нервных волокон Аδ и немиелиновых волокон С. Они найдены в коже, слизистых оболочках, надкостнице, зубах, мышцах, суставах, внутренних органах и их оболочках, сосудах. Их нет в нервной ткани головного и спинного мозга. Наибольшая их плотность имеется на границе дентина и эмали зуба.
Они найдены в коже, слизистых оболочках, надкостнице, зубах, мышцах, суставах, внутренних органах и их оболочках, сосудах. Их нет в нервной ткани головного и спинного мозга. Наибольшая их плотность имеется на границе дентина и эмали зуба.
Выделяют следующие основные типы болевых рецепторов:
1. Механоноцицепторы и механотермические ноцицепторы Аδ-волокон реагируют на сильные механические и термические раздражители, проводят быструю механическую и термическую боль, быстро адаптируются; расположены преимущественно в коже, мышцах, суставах, надкостнице; их афферентные нейроны имеют малые рецептивные поля.
2. Полисенсорные ноцицепторы С-волокон реагируют на механические, термические и химические раздражители, проводят позднюю плохо локализованную боль, медленно адаптируются; их афферентные нейроны имеют большие рецептивные поля.
Болевые рецепторы возбуждаются тремя видами раздражителей:
1. Механические раздражители, создающие давление более 40г/мм 2 при сдавливании, растяжении, сгибании, скручивании.
2. Термические раздражители могут быть тепловыми (> 45 0 С) и холодовыми (
3. Химические раздражители, освобождающиеся из поврежденных клеток тканей, тучных клеток, тромбоцитов (К + , Н + , серотонин, ацетилхолин, гистамин), плазмы крови (брадикинин, каллидин) и окончаний ноцицептивных нейронов (вещество Р). Одни из них возбуждают ноцицепторы (К + , серотонин, гистамин, брадикинин, АДФ), другие сенсибилизируют их.
Свойства болевых рецепторов: болевые рецепторы имеют высокий порог возбуждения, что обеспечивает их ответ только на чрезвычайные раздражители. Ноцицепторы С-афферентов плохо адаптируются к длительно действующим раздражителям. Возможно повышение чувствительности болевых рецепторов – снижение порога их раздражения при многократной или длительной стимуляции, что называется гипералгезией. При этом ноцицепторы способны отвечать на стимулы субпороговой величины, а также возбуждаться раздражителями других модальностей.
Проводящие пути болевой чувствительности
Нейроны, воспринимающие болевую импульсацию. От болевых рецепторов туловища, шеи и конечностей Аδ — и С-волокна первых чувствительных нейронов (их тела находятся в спинальных ганглиях) идут в составе спинномозговых нервов и входят через задние корешки в спинной мозг, где разветвляются в задних столбах и образуют синаптические связи прямо или через интернейроны со вторыми чувствительными нейронами, длинные аксоны которых входят в состав спиноталамических путей. При этом они возбуждают два вида нейронов: одни нейроны активируются только болевыми стимулами, другие – конвергентные нейроны – возбуждаются также и неболевыми стимулами. Вторые нейроны болевой чувствительности преимущественно входят в состав боковых спиноталамических путей, которые и проводят большую часть болевых импульсов. На уровне спинного мозга аксоны этих нейронов переходят на сторону, противоположную раздражению, в стволе головного мозга они доходят до таламуса и образуют синапсы на нейронах его ядер. Часть болевой импульсации первых афферентных нейронов переключаются через интернейроны на мотонейроны мышц-сгибателей и участвуют в формировании защитных болевых рефлексов.
От болевых рецепторов туловища, шеи и конечностей Аδ — и С-волокна первых чувствительных нейронов (их тела находятся в спинальных ганглиях) идут в составе спинномозговых нервов и входят через задние корешки в спинной мозг, где разветвляются в задних столбах и образуют синаптические связи прямо или через интернейроны со вторыми чувствительными нейронами, длинные аксоны которых входят в состав спиноталамических путей. При этом они возбуждают два вида нейронов: одни нейроны активируются только болевыми стимулами, другие – конвергентные нейроны – возбуждаются также и неболевыми стимулами. Вторые нейроны болевой чувствительности преимущественно входят в состав боковых спиноталамических путей, которые и проводят большую часть болевых импульсов. На уровне спинного мозга аксоны этих нейронов переходят на сторону, противоположную раздражению, в стволе головного мозга они доходят до таламуса и образуют синапсы на нейронах его ядер. Часть болевой импульсации первых афферентных нейронов переключаются через интернейроны на мотонейроны мышц-сгибателей и участвуют в формировании защитных болевых рефлексов. В боковом спиноталамическом пути выделяют эволюционно более молодой неоспиноталамический путь и древний палеоспиноталамический путь.
В боковом спиноталамическом пути выделяют эволюционно более молодой неоспиноталамический путь и древний палеоспиноталамический путь.
Неоспиноталамический путь проводит болевые сигналы по Аδ-волокнам преимущественно в специфические сенсорные (вентральные задние) ядра таламуса, имеющие хорошую топографическую проекцию периферии тела. Кроме этого небольшая часть импульсов поступает в ретикулярную формацию ствола и далее в неспецифические ядра таламуса. Передача возбуждения в синапсах этого пути осуществляется с помощью быстродействующего медиатора глутамата. Из специфических ядер таламуса болевые сигналы передаются преимущественно в сенсорную кору больших полушарий. Эти особенности формируют основную функцию неоспиноталамического пути – проведение «быстрой» боли и восприятие ее с высокой степенью локализации.
Палеоспиноталамический путь проводит болевые сигналы по С-волокнам преимущественно в неспецифические ядра таламуса прямо или после переключения в нейронах ретикулярной формации ствола мозга. Передача возбуждения в синапсах этого пути происходит более медленно. Медиатором является вещество Р. Из неспецифических ядер импульсация поступает в сенсорную и другие отделы коры больших полушарий. Небольшая часть импульсации поступает и в специфические ядра таламуса. В основном волокна этого пути оканчиваются на нейронах 1) неспецифических ядер таламуса; 2) ретикулярной формации; 3) центрального серого вещества; 4) голубого пятна; 5) гипоталамуса. Через палеоспиноталамический путь проводится «поздняя», плохо локализуемая боль, формируются аффективно-мотивационные проявления болевой чувствительности.
Передача возбуждения в синапсах этого пути происходит более медленно. Медиатором является вещество Р. Из неспецифических ядер импульсация поступает в сенсорную и другие отделы коры больших полушарий. Небольшая часть импульсации поступает и в специфические ядра таламуса. В основном волокна этого пути оканчиваются на нейронах 1) неспецифических ядер таламуса; 2) ретикулярной формации; 3) центрального серого вещества; 4) голубого пятна; 5) гипоталамуса. Через палеоспиноталамический путь проводится «поздняя», плохо локализуемая боль, формируются аффективно-мотивационные проявления болевой чувствительности.
Кроме этого болевая чувствительность частично проводится по другим восходящим путям: переднему спиноталамическому, тонкому и клиновидному путям.
Вышеназванные пути проводят и другие виды чувствительности: температурную и тактильную.
Роль коры больших полушарий в восприятии боли
Полноценное чувственное восприятие боли организмом без участия коры головного мозга невозможно.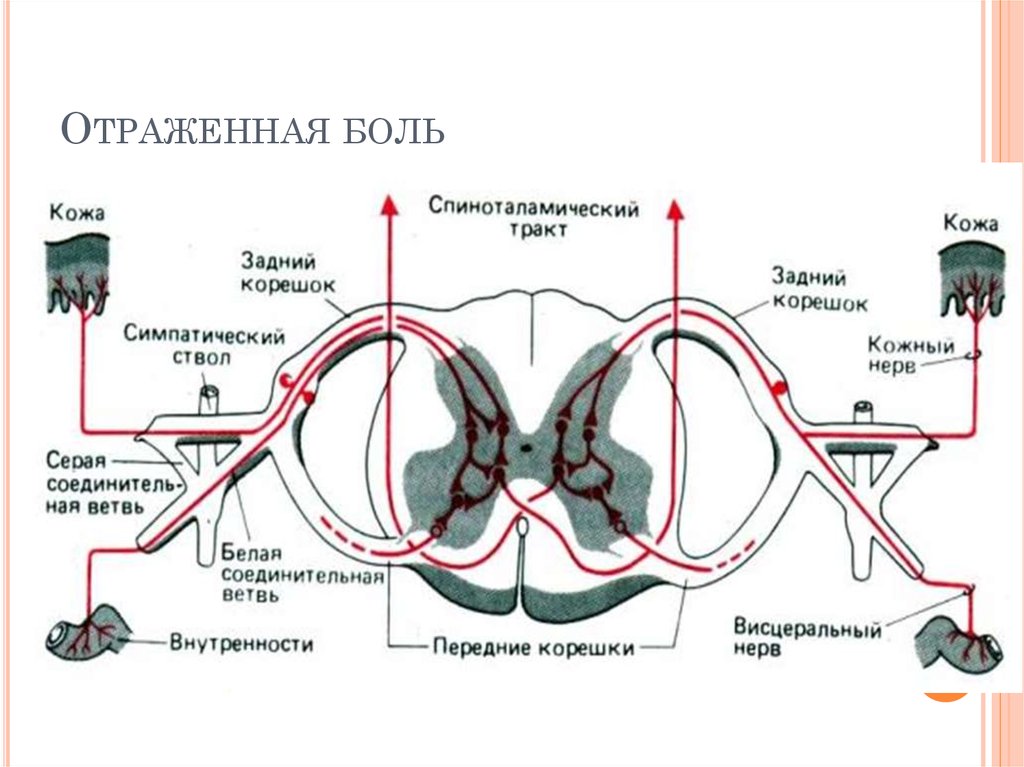
Первичное проекционное поле болевого анализатора находится в соматосенсорной коре задней центральной извилины. Оно обеспечивает восприятие «быстрой» боли и идентификацию места ее возникновения на теле. Для более точной идентификации локализации боли в процесс обязательно включается и нейроны моторной коры передней центральной извилины.
Вторичное проекционное поле расположено в соматосенсорной коре на границе пересечения центральной борозды с верхним краем височной доли. Нейроны данного поля имеют двусторонние связи с ядрами таламуса, что позволяет этому полю избирательно фильтровать, проходящие через таламус возбуждения болевого характера. А это в свою очередь позволяет данному полю вовлекаться в процессы, связанные с извлечением из памяти энграммы необходимого поведенческого акта, его реализации в деятельности эффекторов и оценки качества достигнутого полезного результата. Двигательные компоненты болевого поведения формируются в совместной деятельности моторной и премоторной коры, базальных ганглиев и мозжечка.
Лобная кора играет важную роль в восприятии боли. Она обеспечивает самооценку боли (ее когнитивный компонент) и формирование целенаправленного болевого поведения.
Лимбическая система (поясная извилина, гиппокамп, зубчатая извилина, миндалевидный комплекс височной доли) получает болевую информацию от передних ядер таламуса и формирует эмоциональный компонент боли, запускает вегетативные, соматические и поведенческие реакции, обеспечивающие приспособительные реакции к болевому раздражителю.
Некоторые виды болевых ощущений
Существуют боли, которые названы Проекционными или Фантомными. Их возникновение основано на законе проекции боли: какая бы часть афферентного пути не раздражалась, боль ощущается в области рецепторов данного сенсорного пути. По современным данным в формировании данного вида болевого ощущения участвуют все отделы болевой сенсорной системы.
Существуют также так называемые Отраженные боли: когда боль ощущается не только в пораженном органе, но и в соответствующем дерматоме тела. Участки поверхности тела соответствующего дерматома, где возникает ощущение боли, назвали Зонами Захарьина – Геда. Возникновение отраженных болей связано с тем, что нейроны, проводящие болевую импульсацию от рецепторов пораженного органа и кожи соответствующего дерматома, конвергируют на одном и том же нейроне спиноталамического пути. Раздражение этого нейрона с рецепторов пораженного органа в соответствии с законом проекции боли приводит к тому, что боль ощущается и в области кожных рецепторов.
Участки поверхности тела соответствующего дерматома, где возникает ощущение боли, назвали Зонами Захарьина – Геда. Возникновение отраженных болей связано с тем, что нейроны, проводящие болевую импульсацию от рецепторов пораженного органа и кожи соответствующего дерматома, конвергируют на одном и том же нейроне спиноталамического пути. Раздражение этого нейрона с рецепторов пораженного органа в соответствии с законом проекции боли приводит к тому, что боль ощущается и в области кожных рецепторов.
Антиболевая система состоит из четырех уровней: спинального, стволового, гипоталамического и коркового.
1. Спинальный уровень антиноцицептовной системы. Важным ее компонентом является «воротный контроль» спинного мозга, концепция которого имеет следующие основные положения: передача болевых нервных импульсов с первых нейронов на нейроны спиноталамических путей (вторые нейроны) в задних столбах спинного мозга модулируется спинальным воротным механизмом – тормозными нейронами, расположенными в желатинозном веществе спинного мозга. На этих нейронах оканчиваются разветвления аксонов различных сенсорных путей. В свою очередь нейроны желатинозной субстанции оказывают пресинаптическое торможение в местах переключения первых и вторых нейронов болевых и других сенсорных путей. Часть нейронов являются конвергентными: на них образуют синапсы нейроны не только от болевых, но и от других рецепторов. Спинальный воротный контроль регулируется соотношением импульсов, поступающих по афферентным волокнам большого диаметра (неболевая чувствительность) и малого диаметра (болевая чувствительность). Интенсивный поток импульсов по волокнам большого диаметра ограничивает передачу болевых сигналов на нейроны спиноталамических путей (закрывает «ворота»). Напротив, интенсивный поток болевых импульсов по первому афферентному нейрону, ингибируя тормозные интернейроны, облегчает передачу болевых сигналов на нейроны спиноталамических путей (открывает «ворота»). Спинальный воротный механизм находится под постоянным влиянием нервных импульсов структур ствола мозга, которые передаются по нисходящим путям как на нейроны желатинозной субстанции, так и на нейроны спиноталамических путей.
На этих нейронах оканчиваются разветвления аксонов различных сенсорных путей. В свою очередь нейроны желатинозной субстанции оказывают пресинаптическое торможение в местах переключения первых и вторых нейронов болевых и других сенсорных путей. Часть нейронов являются конвергентными: на них образуют синапсы нейроны не только от болевых, но и от других рецепторов. Спинальный воротный контроль регулируется соотношением импульсов, поступающих по афферентным волокнам большого диаметра (неболевая чувствительность) и малого диаметра (болевая чувствительность). Интенсивный поток импульсов по волокнам большого диаметра ограничивает передачу болевых сигналов на нейроны спиноталамических путей (закрывает «ворота»). Напротив, интенсивный поток болевых импульсов по первому афферентному нейрону, ингибируя тормозные интернейроны, облегчает передачу болевых сигналов на нейроны спиноталамических путей (открывает «ворота»). Спинальный воротный механизм находится под постоянным влиянием нервных импульсов структур ствола мозга, которые передаются по нисходящим путям как на нейроны желатинозной субстанции, так и на нейроны спиноталамических путей.
2. Стволой уровень антиноцицептивной системы. К стволовым структурам противоболевой системы относятся, во-первых, центральное серое вещество и ядра шва, образующие единый функциональный блок, во-вторых, крупноклеточное и парагигантоклеточное ядра ретикулярной формации и голубое пятно. Первый комплекс блокирует прохождение болевой импульсации на уровне релейных нейронов ядер задних рогов спинного мозга, а также релейных нейронов сенсорных ядер тройничного нерва, образующих восходящие пути болевой чувствительности. Второй комплекс возбуждает почти всю антиноцицептивную систему (см. рис.1).
3. Гипоталамический уровень антиноцицептивной системы, с одной стороны, функционирует самостоятельно, а с другой – выступает как настройка, контролирующая и регулирующая антиноцицептивные механизмы стволового уровня за счет связей гипоталамических нейронов разной ядерной принадлежности и разной нейрохимической специфичности. Среди них идентифицированы нейроны, в окончаниях аксонов которых выделяются энкефалины, β-эндорфин, норадреналин, дофамин см. рис.2).
рис.2).
4. Корковый уровень антиноцицептивной системы. Объединяет и контролирует деятельность антиноцицептивных структур различного уровня соматосенсорная область коры больших полушарий. При этом наиболее важную роль в активации Спинальных и стволовых структур играет вторичная сенсорная область. Ее нейроны образуют наибольшее количество волокон нисходящего контроля болевой чувствительности, направляющиеся к задним рогам спинного мозга и ядрам ствола головного мозга. Вторичная сенсорная кора видоизменяет активность стволового комплекса антиноцицептивной системы. Кроме этого соматосенсорные поля коры больших полушарий контролируют проведение афферентных болевых импульсов через таламус. Кроме таламуса, кора большого мозга регламентирует прохождение болевой импульсации в гипоталамусе, лимбической системе, ретикулярной формации, спинном мозге. Ведущая роль в обеспечении кортико-гипоталамических влияний отводится нейронам лобной коры.
Медиаторы антиноцицептивной системы
К медиаторам противоболевой системы относят пептиды, которые образуются в головном мозге, аденогипофизе, мозговом слое надпочечников, желудочно-кишечном тракте, плаценте из неактивных предшественников. . Сейчас к опиатным медиаторам антиноцицептивной системы относят: 1) ά-, β-, γ-эндорфины; 2) энкефалины; 3) динорфины. Эти медиаторы действуют на три вида опиатных рецепторов: μ-, δ-, κ-рецепторы. Наиболее селективным стимулятором μ-рецепторов являются эндорфины, δ-рецепторов – энкефалины, а κ-рецепторов – динорфины. Плотность μ — и κ-рецепторов высокая в коре больших полушарий и в спинном мозгу, средняя – в стволе головного мозга; плотность δ-рецепторов средняя в коре больших полушарий и спинном мозгу, малая – в стволе мозга. Опиоидные пептиды угнетают действие веществ, вызывающих боль, на уровне ноцицепторов, уменьшают возбудимость и проводимость болевой импульсации, угнетают вызванную реакцию нейронов, находящихся в составе цепей, передающих болевую импульсацию. Эти пептиды поступают к нейронам болевой сенсорной системы с кровью и ликвором. Выделяются опиоидные медиаторы в синаптических окончаниях нейронов противоболевой системы. Аналгезирующий эффект эндорфинов высокий в головном и спинном мозге, эффект энкефалинов в этих структурах средний, эффект динорфинов в головном мозге низкий, в спинном мозге – высокий.
. Сейчас к опиатным медиаторам антиноцицептивной системы относят: 1) ά-, β-, γ-эндорфины; 2) энкефалины; 3) динорфины. Эти медиаторы действуют на три вида опиатных рецепторов: μ-, δ-, κ-рецепторы. Наиболее селективным стимулятором μ-рецепторов являются эндорфины, δ-рецепторов – энкефалины, а κ-рецепторов – динорфины. Плотность μ — и κ-рецепторов высокая в коре больших полушарий и в спинном мозгу, средняя – в стволе головного мозга; плотность δ-рецепторов средняя в коре больших полушарий и спинном мозгу, малая – в стволе мозга. Опиоидные пептиды угнетают действие веществ, вызывающих боль, на уровне ноцицепторов, уменьшают возбудимость и проводимость болевой импульсации, угнетают вызванную реакцию нейронов, находящихся в составе цепей, передающих болевую импульсацию. Эти пептиды поступают к нейронам болевой сенсорной системы с кровью и ликвором. Выделяются опиоидные медиаторы в синаптических окончаниях нейронов противоболевой системы. Аналгезирующий эффект эндорфинов высокий в головном и спинном мозге, эффект энкефалинов в этих структурах средний, эффект динорфинов в головном мозге низкий, в спинном мозге – высокий.
Рис.1. Взаимодействие основных элементов обезболивающей системы первого уровня: ствол мозга – спиной мозг. (светлые кружки – возбуждающие нейроны, черные – тормозящие).
Рис.2. Механизм работы обезболивающей системы организма второго уровня (гипоталамус – таламус – ствол мозга) с помощью опиоидов.
Светлые кружки – возбуждающие нейроны, черные — тормозящие.
Степень выраженности болевого ощущения не определяется одной лишь силой экзогенного или эндогенного болевого воздействия. Во многом оно зависит от соотношения активностей ноцицептивного и антиноцицептивного отделов системы боли, что имеет приспособительное значение.
Существуют три теории боли.
Studfile. net
06.04.2018 9:14:11
2018-04-06 09:14:11
Источники:
Https://studfile. net/preview/1818525/
Боль | Рефераты KM. RU » /> » /> .keyword { color: red; }
Физиология боли реферат
Боль – неприятное ощущение или страдание, вызванное раздражением особых нервных окончаний в повреждаемых либо уже поврежденных тканях организма. По-видимому, биологическое значение боли состоит в том, что она служит настораживающим сигналом и заставляет снизить физическую активность при травме или в течение болезни, что облегчает процесс выздоровления.
По-видимому, биологическое значение боли состоит в том, что она служит настораживающим сигналом и заставляет снизить физическую активность при травме или в течение болезни, что облегчает процесс выздоровления.
Болевые сигналы передаются нервной системой так же, как информация о прикосновении, надавливании или нагревании. Бльшая часть чувствительных нервов в коже и других тканях тела снабжена специальными рецепторными структурами, покрывающими их окончания, в то время как у нервов, передающих сигналы повреждения, окончания свободны. Чувствительность, основанная на передаче нервного раздражения, вызванного повреждением, называется ноцицептивной (от лат. noceo – повреждаю и receptivus – восприимчивый).
Повреждение тканей возбуждает сигналы в нервных волокнах двух типов. К первому относится группа толстых волокон, которые быстро проводят возбуждение (хотя и не так быстро, как волокна, несущие сигналы о прикосновении и надавливания), ко второму – группа тонких волокон, передающих возбуждение относительно медленно. Различие функций этих двух типов волокон легко выявляется, например, при травме пальца ноги. Вначале ощущается внезапная острая боль. Это первое болевое ощущение, передаваемое толстыми волокнами, достигая сознания, предупреждает о повреждении. Когда первая волна боли спадает, начинается вторая, передающаяся по тонким нервным волокнам. Эта глухая, нечетко локализованная, постоянная боль должна, по-видимому, напоминать организму о повреждении и о том, что необходимо позаботиться о безопасности и защите поврежденной ступни.
Различие функций этих двух типов волокон легко выявляется, например, при травме пальца ноги. Вначале ощущается внезапная острая боль. Это первое болевое ощущение, передаваемое толстыми волокнами, достигая сознания, предупреждает о повреждении. Когда первая волна боли спадает, начинается вторая, передающаяся по тонким нервным волокнам. Эта глухая, нечетко локализованная, постоянная боль должна, по-видимому, напоминать организму о повреждении и о том, что необходимо позаботиться о безопасности и защите поврежденной ступни.
По нервным волокнам двух типов ноцицептивное возбуждение поступает в спинной мозг и через него в головной. Раньше предполагали, что спинной мозг всего лишь система для передачи информации от нервных окончаний, расположенных в тканях организма, в головной мозг; теперь известно, что ему свойственны и другие функции, в частности контроль болевых ощущений. Спинной мозг подобен телефонному кабелю, заполненному многочисленными проводами. Пучки нервных волокон выполняют ту же функцию – передают информацию. Бльшая часть пучков, по-видимому, несет сигналы от различных частей тела в переключающий мозговой центр – таламус. Сенсорная информация сортируется в таламусе, который связан с другими частями головного мозга, в том числе с корой, где происходит осмысление поступающих сигналов.
Бльшая часть пучков, по-видимому, несет сигналы от различных частей тела в переключающий мозговой центр – таламус. Сенсорная информация сортируется в таламусе, который связан с другими частями головного мозга, в том числе с корой, где происходит осмысление поступающих сигналов.
В спинном мозгу, кроме восходящих, имеются также нисходящие пути, по которым идут нервные импульсы из головного мозга. Основная часть нисходящих путей проводит двигательные импульсы, но с помощью некоторых из них головной мозг контролирует объем и тип информации, поступающей от чувствительных нервных окончаний, расположенных в различных частях тела. По этим путям проводятся сигналы, подавляющие передачу болевых импульсов в синапсах, т. е. местах соединения периферических чувствительных нервов (идущих из очага повреждения) с нервными волокнами, восходящими по спинному мозгу в головной.
Гипофиз, расположенный в глубине головного мозга и ответственный за гормональный баланс организма, вырабатывает вещества, играющие важную роль в контроле восприятия боли. Это т. н. эндорфины, по структуре напоминающие морфин и другие опиаты. Эндорфины связываются с определенными рецепторами клеток головного мозга, подходя к ним как ключ к замку. С теми же рецепторами могут связываться и лекарственные соединения, структурно сходные с морфином. При связывании молекулы опиата или эндорфина с рецептором происходит активация определенных мозговых структур, и сигналы, посылаемые обратно в спинной мозг, тормозят болевые импульсы, поступающие по периферическим чувствительным нервам.
Это т. н. эндорфины, по структуре напоминающие морфин и другие опиаты. Эндорфины связываются с определенными рецепторами клеток головного мозга, подходя к ним как ключ к замку. С теми же рецепторами могут связываться и лекарственные соединения, структурно сходные с морфином. При связывании молекулы опиата или эндорфина с рецептором происходит активация определенных мозговых структур, и сигналы, посылаемые обратно в спинной мозг, тормозят болевые импульсы, поступающие по периферическим чувствительным нервам.
Действие системы контроля болевых ощущений часто наблюдается у спортсменов, получивших травму во время игры, или у солдат, раненных в бою. В этих случаях даже значительное повреждение может не осознаваться пострадавшим.
Встречаются люди с врожденной неспособностью ощущать боль. Лишенные охранительной функции боли, они уже в детстве страдают от серьезных травм и переломов. Многие из них преждевременно погибают от заболеваний типа аппендицита, так как не ощущают болевых симптомов и не обращаются своевременно за медицинской помощью.
Когда болевые импульсы, возникшие в нервных окончаниях, достигают высших мозговых центров, они воспринимаются почти так же, как и другие формы информации, т. е. сенсорные импульсы от отдаленных нервных окончаний интегрируются с воспоминаниями, ожиданиями, эмоциями и мыслями, что обеспечивает полноту восприятия. Представление о боли как о простом сигнале тревоги, звучащем в мозгу, кажется верным только на первый взгляд. Современная точка зрения гораздо сложнее. В осознании интенсивности боли неизмеримо большее значение, чем степень физического повреждения, имеют эмоциональные аспекты травмы. Целостное восприятие боли зависит от эмоционального состояния и мыслительного процесса, координированных с идущими из очага повреждения болевыми сигналами.
Как выяснилось, порог болевой чувствительности не имеет значительных возрастных различий, однако лабораторный анализ выявляет целый набор небольших вариаций в характере ответов на болевые раздражения. Отмечены также половые различия в переносимости боли. Мужчины в общем несколько лучше женщин переносят боль, вопреки расхожим представлениям, имеющим в виду родовые муки. В целом, однако, судить трудно, поскольку внешнее выражение боли часто обусловлено воспитанием. Кроме того, между пожилыми и молодыми, так же как и между мужчинами и женщинами, существуют различия в выражении реакций на боль даже при сходном воспитании.
Мужчины в общем несколько лучше женщин переносят боль, вопреки расхожим представлениям, имеющим в виду родовые муки. В целом, однако, судить трудно, поскольку внешнее выражение боли часто обусловлено воспитанием. Кроме того, между пожилыми и молодыми, так же как и между мужчинами и женщинами, существуют различия в выражении реакций на боль даже при сходном воспитании.
Отмечается значительное различие внешнего выражения боли у людей, принадлежащих к разным культурам. Европейцы, населяющие Средиземноморье, например, гораздо эмоциональнее и драматичнее реагируют на болевые раздражения, чем жители Северной Европы. Скандинавы, в противоположность южноевропейским народам, переносят боль стоически.
В первобытных культурах наиболее важные ритуалы сопряжены с добровольным нанесением себе повреждений. Как правило, внешнее выражение боли при этом отсутствует. Например, у австралийских аборигенов юноши, по традиции, отмечают совершеннолетие особым ритуалом, включающим обрезание, нанесение многочисленных порезов на кожу груди и удаление двух зубов (центральных резцов верхней челюсти). От посвящаемого в мужчины юноши требуется полное отсутствие какой-либо реакции на боль. Антропологи могут привести множество таких примеров. Вероятно, человек, подвергаемый ритуальному увечью, на самом деле испытывает меньшую боль, однако скорее всего он просто подавляет внешние выражения страдания. В проявлении стоицизма при первобытных обрядах могут играть роль и эндорфины.
От посвящаемого в мужчины юноши требуется полное отсутствие какой-либо реакции на боль. Антропологи могут привести множество таких примеров. Вероятно, человек, подвергаемый ритуальному увечью, на самом деле испытывает меньшую боль, однако скорее всего он просто подавляет внешние выражения страдания. В проявлении стоицизма при первобытных обрядах могут играть роль и эндорфины.
Врачи, изучающие проблемы боли, обычно выделяют две ее разновидности – острую и хроническую. Острая боль возникает в ответ на внезапную травму или начало заболевания. Хроническая сохраняется длительный период времени и не поддается обычному медикаментозному лечению, эффективному при острой боли. Многие клиницисты относят к хронической только ту боль, которая длится более полугода и не снимается терапией.
Острая боль. Внезапное повреждение тканей вызывает не только передачу болевого возбуждения по соответствующим периферическим нервам в головной мозг, но и множество других реакций, в т. ч. непроизвольное сокращение (спазм) скелетной мускулатуры и кровеносных сосудов, изменения дыхания, частоты сердечных сокращений, объема сердечного выброса, кровяного давления и функций ряда органов брюшной полости. Как правило, острая боль вызывает эмоциональную реакцию, например испуг, и изменение положения тела, например быстрое отдергивание поврежденной конечности.
Как правило, острая боль вызывает эмоциональную реакцию, например испуг, и изменение положения тела, например быстрое отдергивание поврежденной конечности.
Большинство эффектов острого болевого приступа можно преодолеть введением лекарственных средств, которые временно выключают передачу болевых сигналов по нервам (блокада нервов), либо применением наркотических или иных сильнодействующих препаратов, влияющих на мозг, а также аспирина или других противовоспалительных средств. Все чаще для обезболивания используются немедикаментозные методы; наиболее известный прием – отвлекающее раздражение, обычно посредством электроиглоукалывания или чрескожной электронейростимуляции. Электроиглоукалывание – это подача электрических импульсов в ткани через тонкие стальные иглы, погруженные в толщу кожи и обычно проникающие в нижележащие мышцы. Импульсы с частотой 2–3 в секунду должны быть достаточно сильными, чтобы вызывать подергивание мышц. При чрескожной электронейростимуляции на кожу накладывают большие увлажненные электроды и подают электрический ток с частотой обычно выше 100 импульсов в секунду, варьирующий от очень слабого до достаточно сильного. Оба способа обезболивания основаны на смешении болевых сигналов, поступающих в головной мозг из разных участков тела. Кроме того, можно предполагать, что приглушение боли происходит в результате высвобождения эндорфинов.
Оба способа обезболивания основаны на смешении болевых сигналов, поступающих в головной мозг из разных участков тела. Кроме того, можно предполагать, что приглушение боли происходит в результате высвобождения эндорфинов.
Психологические приемы лечения боли, например с помощью гипноза, имеют особую ценность в случаях, когда требуется устранить страх, сопутствующий острым болевым приступам, и помочь пациенту отвлечься от болезненных ощущений. Существенную помощь больному может оказать обучение тому, как изменить восприятие боли. Такого рода занятия проводятся с беременными женщинами; в результате нормальные роды у них, как правило, протекают лишь со слабой болью или вовсе без нее. По-видимому, эта психологическая профилактика помогает пациентам максимально мобилизовать против боли естественные ресурсы, в том числе высвобождение эндорфинов.
Хроническая боль. Воздействие боли на человека имеет эмоциональные, физические, экономические и социальные последствия как для него самого, так и для его семьи и общества в целом. У многих страдающих хроническими болями страх, сопровождающий острый болевой приступ, сменяется подавленностью и ипохондрией, сосредоточенностью исключительно на своих ощущениях и функционировании собственного организма. Нарушается нормальный ритм сна, больные иногда полностью теряют интерес к социальной активности; боль становится доминирующим переживанием в их жизни.
У многих страдающих хроническими болями страх, сопровождающий острый болевой приступ, сменяется подавленностью и ипохондрией, сосредоточенностью исключительно на своих ощущениях и функционировании собственного организма. Нарушается нормальный ритм сна, больные иногда полностью теряют интерес к социальной активности; боль становится доминирующим переживанием в их жизни.
К хроническим болевым синдромам относят поясничные боли, рецидивирующие и постоянные головные боли, боли в костях и суставах, а также в области живота. Причинами постоянных болей могут быть артрит, воспаление или травма нервов, определенные формы рака, недостаток снабжения тканей кислородом, очаговый воспалительный процесс в любом органе, заболевания кровеносных сосудов, повреждение костной ткани, функциональные нарушения определенных отделов нервной системы, а также другие формы патологии. Многим больным удается помочь избавиться от боли, особенно если она лишь симптом основного заболевания, излечение которого устраняет и боль. К сожалению, при неизлечимых заболеваниях врач может только контролировать болевые симптомы с помощью анальгетиков (средств, притупляющих боль). В ряде случаев хронической боли не удается даже поставить диагноз. Бывают случаи, когда боль продолжается годами без видимых причин после вылеченной травмы или давно прошедшего заболевания. Такие состояния лечить чрезвычайно трудно. Боль может быть одним из симптомов депрессии, излечение которой устраняет жалобы пациента на болевые ощущения.
К сожалению, при неизлечимых заболеваниях врач может только контролировать болевые симптомы с помощью анальгетиков (средств, притупляющих боль). В ряде случаев хронической боли не удается даже поставить диагноз. Бывают случаи, когда боль продолжается годами без видимых причин после вылеченной травмы или давно прошедшего заболевания. Такие состояния лечить чрезвычайно трудно. Боль может быть одним из симптомов депрессии, излечение которой устраняет жалобы пациента на болевые ощущения.
К сожалению, при неизлечимых заболеваниях врач может только контролировать болевые симптомы с помощью анальгетиков средств, притупляющих боль.
Www. km. ru
28.07.2020 18:05:49
2020-07-28 18:05:49
Источники:
Https://www. km. ru/referats/AFA2F5A0FD0D46E69AAD98B4EF532CF2
Физиология боли — Реферат » /> » /> .keyword { color: red; }
Физиология боли реферат
Боль формируется как ответная реакция организма на разрушающие его раздражители. Формирование чувства боли является приспособительным свойством, способствующим выживанию и выработанным в процессе эволюции живых существ. Болевое возбуждение имеет прежде всего сигнальное значение, предупреждающие о нарушении двух жизненно важных констант организма: целостности защитных покровных оболочек, обеспечивающих постоянство внутренней среды, и определённого уровня окислительных процессов тканей, обеспечивающих их нормальную жизнедеятельность.
Формирование чувства боли является приспособительным свойством, способствующим выживанию и выработанным в процессе эволюции живых существ. Болевое возбуждение имеет прежде всего сигнальное значение, предупреждающие о нарушении двух жизненно важных констант организма: целостности защитных покровных оболочек, обеспечивающих постоянство внутренней среды, и определённого уровня окислительных процессов тканей, обеспечивающих их нормальную жизнедеятельность.
Защитное свойство боли как сигнала опасности может проявляться только тогда, когда она возникает в ответ на действие именно вредоносного раздражителя. Именно поэтому в эволюции был выработан и генетически закреплён определённый биологически целесообразный порог болевой чувствительности, обеспечивающий возникновение болевого ощущения в ответ только на вредоносные раздражители.
Если бы боль нас не предостерегала, уже при самых обыденных действиях мы часто наносили бы себе повреждения и вскоре стали бы калеками.
Существует нескольно определений боли:
Боль (от лат. dolor) – это неприятное ощущение, возникающее при действии сверхсильных раздражителей, вызывающих структурно-функциональные изменения в организме. В этом смысле боль является конечным продуктом деятельности болевой сенсорной системы. Известно много попыток точно и кратко охарактеризовать боль.
dolor) – это неприятное ощущение, возникающее при действии сверхсильных раздражителей, вызывающих структурно-функциональные изменения в организме. В этом смысле боль является конечным продуктом деятельности болевой сенсорной системы. Известно много попыток точно и кратко охарактеризовать боль.
Боль – неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения». (Журнал «Pain» 1976 г.)
По этому определению боль, как правило, нечто большее, чем чистое ощущение, поскольку обычно сопровождается неприятным переживанием.
Имеются и другие определения боли: «психофизиологическое состояние», «своеобразное психическое состояние», «неприятное сенсорное или эмоциональное состояние», «мотивационно-функциональное состояние» и т. д. Различие понятий о боли, вероятно, связаны с тем, что она запускает в ЦНС несколько программ ответа организма на боль и, следовательно, имеет несколько компонентов.
Соматическая боль. Если она возникает в коже, её называют поверхностной; если в мышцах, костях, суставах или соединительной ткани – глубокой.
Поверхностная боль, вызываемая уколом кожи булавкой, представляет собой «яркое» по характеру, легко локализуемое ощущение, которое с прекращением стимуляции быстро угасает. За этой ранней болью часто следует поздняя с латентным периодом 0,5-1,0 с. Поздняя боль по характеру ноющая, её труднее локализовать, и она медленнее угасает. Глубокая боль. Боль в скелетных мышцах, костях, суставах и соединительной ткани называют глубокой. Её примеры – острые, подострые и хронические боли в суставах, одни из самых обычных у человека. Глубокая боль тупая, как правило трудно локализуемая, и имеет тенденцию к распространению болевых ощущений в окружающие ткани.
Висцеральная боль. Висцеральную боль можно вызвать, например, быстрым сильным растяжением полых органов брюшной полости (мочевого пузыря).Спазмы или сильные сокращения внутренних органов тоже болезненны, особенно когда связаны с неправильным кровообращением (ишемией).
Кроме места возникновения важный момент описания боли – её продолжительность.
Острая боль (например, от ожога кожи) обычно ограничена поврежденной областью; мы точно знаем, где она возникла, и её сила прямо зависит от интенсивности стимуляции. Такая боль указывает на грозящее или уже происшедшее повреждение ткани и поэтому обладает четкой сигнальной и предупреждающей функцией. После устранения повреждения она быстро исчезает. Острая боль определяется как краткая по времени проявления боль с легко идентифицируемой причиной. Острая боль — это предупреждение организму о существующей в данный момент опасности органического повреждения или заболевания. Часто стойкая и острая боль сопровождается также ноющей болью. Острая боль обычно концентрируется в определённом участке перед тем, как она каким-то образом распространится шире. Этот тип боли обычно хорошо поддаётся излечению.
Острая боль например, от ожога кожи обычно ограничена поврежденной областью; мы точно знаем, где она возникла, и её сила прямо зависит от интенсивности стимуляции.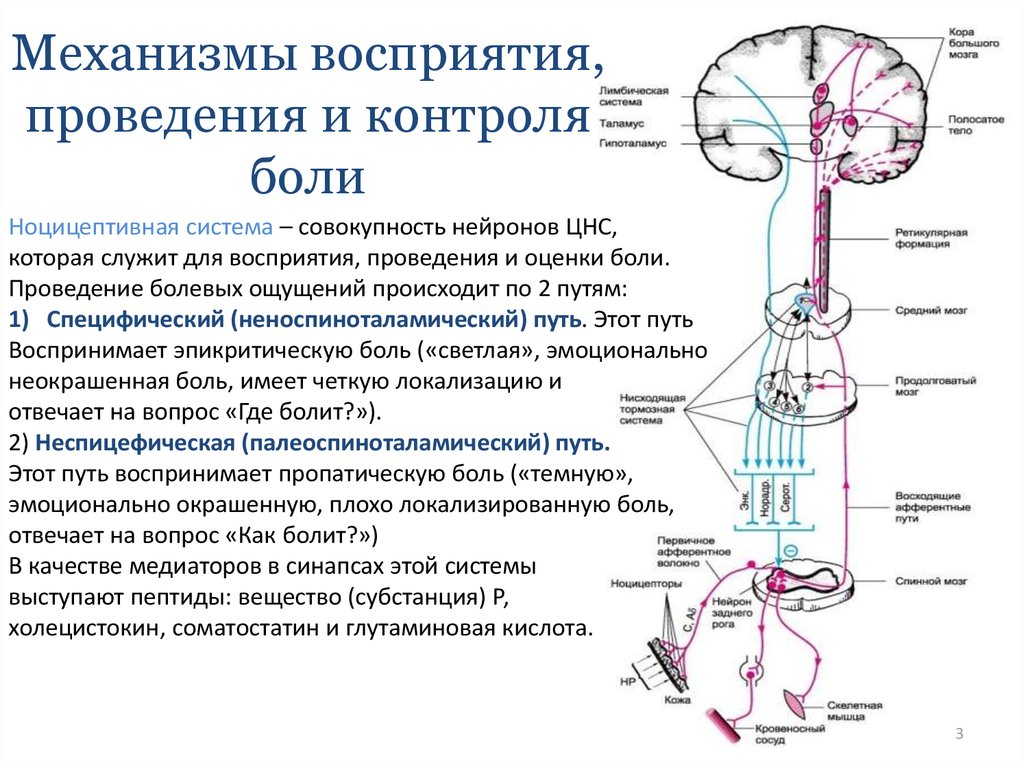
Ru. essays. club
25.03.2020 0:05:57
2020-03-25 00:05:57
Источники:
Https://ru. essays. club/%D0%95%D1%81%D1%82%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5-%D0%BD%D0%B0%D1%83%D0%BA%D0%B8/%D0%91%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F/%D0%A4%D0%B8%D0%B7%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F-%D0%B1%D0%BE%D0%BB%D0%B8-4389.html
4. Физиология боли
Боль играет важную роль в выживании всех животных. Он действует как сигнал, предупреждающий нас о потенциальном повреждении тканей, и приводит к широкому спектру действий для предотвращения или ограничения дальнейшего повреждения.
Физиологически боль возникает, когда сенсорные нервные окончания, называемые ноцицепторами (также называемыми болевыми рецепторами), вступают в контакт с болезненным или вредным раздражителем. Возникающий в результате нервный импульс проходит от окончания сенсорного нерва к спинному мозгу, где импульс быстро направляется в головной мозг через нервные пути в спинном мозге и стволе головного мозга. Мозг обрабатывает болевые ощущения и быстро реагирует двигательной реакцией, пытаясь прекратить действие, вызывающее боль.
Мозг обрабатывает болевые ощущения и быстро реагирует двигательной реакцией, пытаясь прекратить действие, вызывающее боль.
Ноцицептивные пути
Классический ноцицептивный путь включает три типа нейронов:
- Первичные сенсорные нейроны в периферической нервной системе, которые проводят болевые ощущения от периферии к дорсальному корешку спинного мозга
- Вторичные сенсорные нейроны в спинном мозге или стволе головного мозга, которые передают болевые ощущения в таламус
- Третичные сенсорные нейроны , которые передают болевые ощущения от таламуса в соматосенсорные области коры головного мозга.
Сенсорные нервы, входящие в спинной мозг
Срез поясничного позвонка, показывающий сенсорные нервы (желтым цветом, с выпуклостью), входящие в дорсальную часть спинного мозга. Иллюстрация предоставлена 3DScience.com. Используется с разрешения.
Существует два основных класса нервных волокон, связанных с передачей боли:
- Немиелинизированные С-волокна
- Миелиновые А-дельта-волокна
Направления спиноталамического и спиноретикулярного трактов в головном мозге
Таламус является местом назначения спиноталамического тракта — сенсорного пути, ответственного за обработку боли, температуры и грубого прикосновения. Ретикулярная формация ствола мозга, которая образует диффузное центральное ядро в стволе мозга, является местом назначения спиноретикулярного тракта. Источник: 3DScience.com. Используется с разрешения.
Ретикулярная формация ствола мозга, которая образует диффузное центральное ядро в стволе мозга, является местом назначения спиноретикулярного тракта. Источник: 3DScience.com. Используется с разрешения.
Волокна С маленькие и медленно проводят импульсы. Они реагируют на термические, механические и химические раздражители и вызывают ощущение тупой, диффузной, ноющей, жгучей и замедленной боли. А-дельта-волокна, которые миелинизированы и, таким образом, быстро проводят импульсы, реагируют на механическое раздражение (давление) и вызывают ощущение острой, локализованной, быстрой боли.
Одним из наиболее важных центральных болевых путей является спиноталамический тракт , который берет начало в спинном мозге и распространяется к таламусу. Этот спинной тракт передает сенсорную информацию, связанную с болью, температурой и грубым прикосновением.
Другим важным путем является спиноретикулярный тракт , который участвует в обработке ноцицептивных сигналов. Спиноретикулярный тракт похож на спиноталамический тракт тем, что возбуждается сходными чувствительными волокнами. Однако спиноретикулярные нейроны не поднимаются к таламусу, а заканчиваются в стволе мозга.
Спиноретикулярный тракт похож на спиноталамический тракт тем, что возбуждается сходными чувствительными волокнами. Однако спиноретикулярные нейроны не поднимаются к таламусу, а заканчиваются в стволе мозга.
Механизмы боли
Боль может быть вызвана механическим, химическим, воспалительным или термическим механизмом. Боль механического происхождения может быть вызвана острой травмой, повреждением или перенапряжением. Он может быть постоянным, переменным или прерывистым по своей природе и зависит от движения и положения.
Боль химического или воспалительного происхождения связана с артритом и другими воспалительными заболеваниями. Часто она постоянна, но реагирует на правильное положение, терапию, отдых и легкие движения. Лекарства обычно являются частью схемы лечения химической или воспалительной боли.
Боль термического происхождения возникает в результате перегрева или переохлаждения.
Если острая боль достаточно интенсивна, она может вызвать общесистемные реакции: повышенная бдительность; сосредоточенное внимание; подавление питания, сна и размножения; повышение тонуса сосудов, дыхания и уровня сахара в крови. Если боль сохраняется или становится хронической, она может даже изменить работу центральной нервной системы.
Если боль сохраняется или становится хронической, она может даже изменить работу центральной нервной системы.
Использование нейровизуализации для понимания боли
Наше понимание того, как мозг изменяется в ответ на хроническую боль, фармакологические или другие терапевтические вмешательства, значительно улучшилось благодаря методам нейровизуализации. До появления этих методов живой мозг был практически невидим для клиницистов и исследователей. Развитие компьютерной томографии (КТ) и, вскоре после этого, магнитно-резонансной томографии (МРТ) позволило исследователям заглянуть в живой мозг и получить некоторое представление о частях мозга, на которые влияют определенные виды боли. Развитие позитронно-эмиссионной томографии (ПЭТ) впервые позволило исследователям исследовать активность нейронов во всем мозге (Casey, 2015).
Функциональная магнитно-резонансная томография (фМРТ), позитронно-эмиссионная томография (ПЭТ), магнитоэнцефалография (МЭГ) и электроэнцефалография кожи головы (ЭЭГ) использовались для изучения нервных основ боли. Другие меры, основанные на магнитном резонансе, такие как диффузионно-тензорная визуализация, спектроскопия и объемная визуализация, используются для оценки связанных с болью изменений в проводке, химии и структуре мозга; это поможет лучше понять нейробиологию боли, особенно хронической боли (Lee & Tracey, 2013).
Другие меры, основанные на магнитном резонансе, такие как диффузионно-тензорная визуализация, спектроскопия и объемная визуализация, используются для оценки связанных с болью изменений в проводке, химии и структуре мозга; это поможет лучше понять нейробиологию боли, особенно хронической боли (Lee & Tracey, 2013).
В результате теперь мы знаем, что болевые ощущения более сложны, чем считалось ранее, и затрагивают различные области мозга. Методы визуализации позволили нам понять, что боль возникает в результате активации ряда областей мозга, таких как миндалевидное тело, островок или передняя поясная кора. Мы узнаем, что боль является результатом сложных взаимодействий между иммунной, нервной (как ЦНС, так и вегетативной нервной системой) и эндокринной системами (Zouikr et al., 2016).
В исследовании пациентов с хронической болью в пояснице нейровизуализация показала значительные различия в функциях мозга. По сравнению со здоровыми людьми из контрольной группы у пациентов с хронической болью в пояснице наблюдалась активация в областях мозга, связанных с болью, во время введения экспериментальной боли, различия в активации во время эмоциональных задач по принятию решений и изменения в определенных областях мозга во время простой задачи на визуальное внимание (Kong et al. ., 2013).
., 2013).
В других исследованиях визуализации сообщалось о структурных изменениях в головном мозге пациентов с хронической болью в пояснице. Одно исследование показало, что у этих пациентов объем неокортикального серого вещества был на 5-11% меньше, чем у контрольной группы, и что уменьшение объема было связано с продолжительностью боли. Эти исследования показывают, что хроническая боль в пояснице также связана со структурными патологическими изменениями в головном мозге (Kong et al., 2013).
Нейровизуализационные исследования также используются для прогнозирования того, какие пациенты могут перейти от острой боли к хронической. Используя МРТ у людей с острой болью в пояснице, исследователи из Медицинской школы Фейнберга Северо-Западного университета обнаружили аномалии в белом веществе в областях мозга, связанных с обработкой боли и эмоций. Через год участников исследования снова просканировали, и у тех, у кого была постоянная боль, были обнаружены те же аномалии, которые были обнаружены в начале травмы. У пациентов с продолжающейся болью в пояснице эти аномалии могут указывать на то, у каких пациентов разовьется хроническая боль в пояснице (Paul, 2013).
У пациентов с продолжающейся болью в пояснице эти аномалии могут указывать на то, у каких пациентов разовьется хроническая боль в пояснице (Paul, 2013).
У пациентов с хронической болью ряд исследовательских групп сообщили о значительных изменениях в обработке боли на функциональном уровне, включая аллодинию* (раздражитель, обычно не болезненный, воспринимается как болезненный), функциональную пластичность и изменения основных процессов в головной мозг и ствол мозга. Изменения в нейротрансмиттерах также были зарегистрированы у пациентов с хронической болью с помощью магнитно-резонансной спектроскопии. Такие подходы применялись при мигрени, болях в спине и травмах спинного мозга. Этот подход можно использовать для определения нейронных и аксональных маркеров, включая специфические метаболиты, такие как глутамат, аспартат, глицин и ГАМК (Borsook et al., 2007).
*Аллодиния является клиническим признаком невропатий, комплексного регионарного болевого синдрома, постгерпетической невралгии, мигрени и фибромиалгии.
На макроскопическом уровне в ряде исследований показаны изменения объема в областях головного мозга у пациентов с хронической нейропатической болью, комплексным регионарным болевым синдромом и фибромиалгией. Это понимание сыграло ключевую роль в изменении нашего подхода и взглядов на хроническую боль, поскольку эти изменения указывают на то, что хроническая боль может быть нейродегенеративным заболеванием. На микроскопическом уровне при боли и стрессе наблюдались изменения плотности дендритных шипиков или изменения количества нейронов. Такие изменения также имеют значение для развития сопутствующих заболеваний, таких как депрессия (Borsook et al., 2007).
Сенсибилизация
Мы можем стать чувствительными к боли. Сенсибилизация — это нейрофизиологический термин, описывающий повышенную реактивность ноцицептивных нейронов (болевые пути становятся более чувствительными). Это может включать снижение порога активации ноцицепторов и увеличение частоты возбуждения всех раздражителей (IASP, 2012). Гипералгезия (чрезмерная реакция на стимулы) и аллодиния (см. выше) являются клиническими маркерами, используемыми для выявления наличия сенсибилизации (Zouikr et al., 2016).
Гипералгезия (чрезмерная реакция на стимулы) и аллодиния (см. выше) являются клиническими маркерами, используемыми для выявления наличия сенсибилизации (Zouikr et al., 2016).
При сенсибилизации раздражители, которые обычно не вызывают боли, такие как легкое прикосновение простыни к коже, могут вызывать сильную боль. Сенсибилизация также может вызывать чувствительность и болезненность, особенно при поражении глубоких тканей, таких как суставы и полые внутренние органы.
Существует два типа сенсибилизации: периферическая и центральная. Периферическая сенсибилизация возникает в ответ на выброс воспалительных молекул, таких как гистамин, простагландины и провоспалительные цитокины. Эти вещества сенсибилизируют (повышают возбудимость) ноцицепторов, создавая среду «воспалительного супа», которая повышает болевую чувствительность за счет снижения порога активации ноцицепторов (Zouikr et al., 2016). В нормальных условиях периферическая гиперчувствительность возвращается к норме, когда стихает воспаление или удаляется источник повреждения (Kyranou & Puntillo, 2012).
При центральной сенсибилизации ноцицептивно-специфические нейроны могут прогрессивно усиливать свою реакцию на повторяющиеся неболевые стимулы, развивать спонтанную активность и увеличивать площадь тела, пораженную болью. Гипералгезия центральной сенсибилизации обычно развивается как часть продолжающейся патологии (т. е. повреждения периферических или центральных нервных волокон, рака, ревматоидного артрита) и считается неадекватной (Kyranou & Puntillo, 2012).
Физиологические эффекты невыносимой боли
Непреодолимая боль является стрессором, который может привести к физиологическим изменениям и отрицательному влиянию на эндокринную, сердечно-сосудистую, желудочно-кишечную и иммунную системы. Эндокринная система реагирует на непреодолимую боль выбросом избыточного количества гормонов, что в конечном итоге приводит к катаболизму углеводов, белков и жиров, плохому использованию глюкозы и другим вредным последствиям. Эта реакция в сочетании с воспалительными процессами может привести к потере веса, тахикардии, учащению дыхания, лихорадке, шоку и смерти.
Сердечно-сосудистая система реагирует на стресс от непрекращающейся боли активацией симпатической нервной системы. Например, после хирургической процедуры это может включать гиперкоагуляцию и увеличение частоты сердечных сокращений, артериального давления, сердечной нагрузки и потребности в кислороде. Поскольку реакция на стресс вызывает усиление активности симпатической нервной системы, повышается секреция кишечника и тонус гладкомышечных сфинктеров, опорожнение желудка и перистальтика кишечника снижаются. Эта реакция может вызвать временное нарушение функции желудочно-кишечного тракта и увеличить риск кишечной непроходимости. Для уменьшения этих эффектов и предотвращения тромбоэмболических осложнений может потребоваться агрессивный контроль боли.
Непреодолимая боль может быть особенно вредной для пациентов с метастатическим раком. Стресс и боль могут подавлять иммунную функцию, включая естественные клетки-киллеры, которые играют роль в предотвращении роста опухоли и контроле метастазирования.
Назад Далее
Физиология, боль — StatPearls — NCBI Bookshelf
Цзятонг (Стивен) Чен; Патрисия Ф. Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Информация об авторе
Последнее обновление: 26 июля 2021 г.
Введение
Боль, вероятно, является наиболее распространенной симптоматической жалобой в медицине; понимание его патофизиологии имеет решающее значение для его интерпретации у пациентов.
Стоит различать термины ноцицепция и боль. Ноцицепция относится к обнаружению вредных раздражителей ноцицепторами с последующей трансдукцией и передачей сенсорной нервной информации с периферии в мозг. Для сравнения, боль относится к продукту обработки высших мозговых центров; это влечет за собой фактические неприятные эмоциональные и сенсорные переживания, порожденные нервными сигналами. Таким образом, сообщения о боли являются не просто прямым результатом ноцицепции, они включают взаимодействие с многочисленными входными данными (внимание, аффективные измерения, вегетативные переменные, иммунные переменные и т. д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
Клеточный
Когда термические, механические или химические раздражители достигают пагубной интенсивности, свидетельствующей о травме, они обнаруживаются ноцицепторами, представляющими собой субпопуляцию периферических нервных волокон, обнаруженных в коже, суставах, внутренних органах, костях и мышцах.[ 3]
Поврежденная ткань высвобождает и производит многочисленные факторы, которые, в свою очередь, активируют нервные окончания. Эти факторы включают, среди прочего, глобулин, протеинкиназы, арахидоновую кислоту, гистамин, фактор роста нервов (NGF), вещество P (SP), пептид, родственный гену кальцитонина (CGRP). Эти факторы стимулируют каналы преобразователя, основным примером которых являются каналы переходного рецепторного потенциала (TRP) [3]. Каналы TRP функционируют аналогично потенциалзависимым калиевым каналам или каналам, управляемым нуклеотидами, и, таким образом, помогают инициировать рецепторные потенциалы, следовательно, индуцируя потенциал действия в нервных волокнах.
Два основных класса ноцицепторов включают миелинизированные (А-дельта) афференты среднего диаметра, которые передают острую, хорошо локализованную быструю боль, и немиелинизированные С-волокна малого диаметра, которые передают плохо локализованную, медленную боль.[3][4] ][5]
На основании электрофизиологических исследований А-дельта-ноцицепторы могут быть дополнительно подразделены на классы А-дельта типа I и типа II. Ноцицепторы А-дельта типа I функционируют, реагируя на механические и химические раздражители, но обычно обнаруживают тепло только при более высоких порогах (более 50°С). Напротив, ноцицепторы А-дельта типа II обладают гораздо большей чувствительностью к теплу, но обладают очень высоким механическим порогом. Таким образом, в ситуациях прямых механических раздражителей (например, укол булавкой) первыми провоцируются А-дельта-ноцицепторы типа I, тогда как в случаях острого вредного тепла, вероятно, сначала активируются А-дельта-ноцицепторы типа II.[3] [4] [5]
Подобно А-дельта-ноцицепторам, большинство немиелинизированных С-волокон являются полимодальными и, таким образом, реагируют как на механические, так и на термические раздражители. Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Разработка
Из-за явных ограничений прямого измерения боли у плода, выяснение временной шкалы развития восприятия боли зависит от вторичных измерений. Во время внутриутробного развития ноцицептивные процессы (сенсорные рецепторы и синапсы спинного мозга) развиваются раньше, чем таламокортикальные пути, необходимые для сознательного восприятия боли. Свободные нервные окончания начинают развиваться примерно на седьмой неделе беременности, в период, когда ламинарная структура таламуса или коры еще не созрела. Гистологические исследования плодов человека показывают, что таламические проекции в корковую пластинку обычно развиваются в возрасте от 23 до 30 недель беременности [6]. Типичные реакции гормонального стресса на боль наблюдаются у плодов около 18 недель беременности, в то время как гемодинамические реакции головного мозга и поведенческие реакции на ноцицептивные стимулы совпадают к 26 неделе беременности. Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Вовлеченные системы органов
Хотя в этой статье отмечается, что ноцицепторы присутствуют во внутренних органах, коже, суставах, костях и мышцах, важным соображением является то, что ноцицепторы не обнаружены в ЦНС; это объяснение того, почему краниотомия в сознании возможна и безболезненна для пациента.
Также необходимо понимать, что конкретные сенсорные модальности, ведущие к ноцицепции, различаются в зависимости от типа ткани: экзогенные аллергены)
Болезненные раздражители в суставах обычно возникают в результате механического стресса (например, чрезмерная нагрузка на сустав) и химического воспаления
Во внутренних органах: механическое растяжение, растяжение, а также химические раздражители обычно вызывают ноцицептивные сигналы
В мышцах наиболее распространены тяжелые механические нагрузки (например, тупая сила, чрезмерное растяжение) и химические модальности
Ноцицептивная передача сигнала в мозг вызывает восприятие боли. Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Функция
Нервные механизмы боли и ноцицепции выполняют адаптивную функцию, сводя к минимуму повреждение тканей от окружающей среды. Важно отметить, что существует несколько операционных категорий болевого поведения. Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Механизм
Под действием многочисленных медиаторов воспаления (как описано ранее в этой статье) в месте повреждения выделяется «воспалительный суп», стимулирующий активацию ноцицепторов. Афферентные ноцицепторы с периферии передают повреждающие сигналы к проекционным нейронам, расположенным в дорсальных рогах спинного мозга. Клетки в заднем роге располагаются слоями физиологически обособленных отделов, называемых пластинками. В зависимости от типа синапса в пластинках, образованных ноцицептивным волокном, подмножество этих проекционных нейронов будет передавать информацию в соматосенсорную кору через таламус, которая предоставляет информацию о пространственных характеристиках и интенсивности болевого стимула. 4][5]
4][5]
Учитывая различие между болью и ноцицепцией, важно также учитывать различные нервные пути, участвующие в аффективном, корковом компоненте переживания боли. Этому процессу способствуют проекционные нейроны, которые задействуют поясную и островковую кору через связи с парабрахиальным ядром ствола мозга, а также с миндалевидным телом, и считается восходящим путем, который инициирует сознательное восприятие боли. Восходящая информация может также побудить нейроны рострального вентрального продолговатого мозга и периакведуктального серого среднего мозга задействовать нисходящие системы обратной связи, которые регулируют выход из спинного мозга и, таким образом, модулируют болевые ощущения. Это происходит за счет высвобождения гормонов и химических веществ (например, эндогенных опиоидов, ГАМК, глицина), которые могут обладать обезболивающими свойствами для ограничения болевых ощущений. И наоборот, такие вещества, как вещество Р, глутамат и аспартат, могут воздействовать на спинной мозг, вызывая восприятие боли. [3][4][5]
[3][4][5]
Локальная стимуляция А-дельта и А-бета также служит для модулирования передачи болевой информации посредством возбуждения интернейронов. Эти интернейроны оказывают тормозящее влияние на нейроны проекции заднего рога, которые передают сигналы в переднебоковую систему. Это основной механизм растирания раны с целью притупить острую боль.[12]
В основе восприятия боли лежит ряд психологических процессов. Ориентация внимания на болезненное ощущение и его источник может способствовать усилению болезненного переживания. Например, обнаружено, что пациенты с соматической озабоченностью и ипохондрией чрезмерно обращают внимание на телесные ощущения, усиливая их в виде боли. Точно так же другие факторы, такие как когнитивная оценка значения ощущения, эмоциональные и психофизиологические реакции, ожидания и навыки преодоления, могут служить обратной связью, влияющей на восприятие боли.[13]
Связанные исследования
Сложная, многогранная и субъективная природа боли делает ее довольно сложной для клинического измерения. За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
В настоящее время инструменты, упомянутые выше, используются в основном в исследовательских целях, хотя предлагаются новые экспериментальные измерения боли, например, нейровизуализация в качестве объективного измерения.[17]
Клиническое значение
Характеристики боли у пациента указывают на ее патогенез. Таким образом, краткое объяснение классов боли полезно с клинической точки зрения, чтобы помочь в управлении болью как симптомом и возможной диагностикой основного состояния.
Острая боль : В месте местного повреждения ткани активация ноцицептивных преобразователей способствует возникновению этой формы боли. Местная травматическая среда может дополнительно изменить характеристики ноцицепторов, центральных связей и вегетативной нервной системы.[1][2][3][4]
Хроническая боль : Постоянная боль часто связана с состояниями (например, сахарным диабетом, артритом и ростом опухоли), которые усиливают хроническое воспаление тканей или изменение свойств периферических нервов (нейропатические). Учитывая непрекращающийся характер хронической боли, ожидается, что внешние факторы, такие как стресс, эмоции и окружающая среда, могут оказывать суммарный эффект на поврежденную ткань, усиливая интенсивность и постоянство боли. [1-4]
Соматическая боль : Эта форма боли может быть острой или хронической и активируется ноцицепторами в кожных или глубоких тканях. В случае кожной соматической боли, например, при порезе кожи, она описывается как острая или жгучая и хорошо локализована.
 В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]Висцеральная боль : Эта боль возникает в основном во внутренних органах и глубоких соматических структурах (например, боль в желудочно-кишечном тракте). Висцеральная боль, не имеющая четкой локализации, переносится по С-волокнам из глубоких структур в спинной мозг.[16]
Нейропатическая : Эта постоянная боль часто является следствием повреждения этих нервных волокон, что приводит к усилению спонтанного возбуждения или изменению их проводимости или нейромедиаторных свойств.[17]
Аллодиния : Боль, вызванная обычно безвредным раздражителем, называется аллодинией. Хотя механизм до конца не ясен, считается, что он потенциально возникает из-за 1) сенсибилизации кожи, приводящей к снижению порога молчащих ноцицепторов, или 2) повреждения периферических нейронов, вызывающего структурные изменения, приводящие к перенаправлению сенсорно-чувствительных волокон и формированию синапсов.
 в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]Гипералгезия : Возникает, когда вредные раздражители вызывают преувеличенную болевую реакцию. Механизмы аналогичны предложенным в случае аллодинии, когда пациенты демонстрируют усиление боли или гипералгезию, а также длительное сохранение боли.[3]
Отраженная боль : При восприятии боли в месте, отличном от места болевого раздражителя, это называется отраженной болью. Классический пример отраженной боли включает боль в шее, плечах и спине после инфаркта миокарда. В настоящее время нет единого мнения относительно истинных механизмов отраженной боли, и существует несколько теорий. Отраженная боль может быть висцеральной или соматической, причем первая описывает боль от органа, а вторая описывает боль от глубоких тканей, таких как мышцы или суставы. В Рухе 1961 конвергентно-проекционная теория, где афферентные висцеральные сенсорные болевые волокна и соматические волокна входят в одни и те же спинномозговые ганглии задних корешков спинного мозга, заставляя ЦНС ошибочно интерпретировать боль как возникающую где-то на стенке тела, а не во внутренних органах.
 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Контрольные вопросы
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Раффаэли В., Арнаудо Э. Боль как болезнь: обзор. Джей Боль Рез. 2017;10:2003-2008. [Бесплатная статья PMC: PMC5573040] [PubMed: 28860855]
- 2.
Loeser JD, Melzack R. Боль: обзор. Ланцет. 1999 мая 08; 353 (9164): 1607-9. [PubMed: 10334273]
- 3.
Basbaum AI, Bautista DM, Scherrer G, Julius D.
 Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]- 4.
Венкатачалам К., Монтелл К. Каналы ГТО. Анну Рев Биохим. 2007;76:387-417. [Бесплатная статья PMC: PMC4196875] [PubMed: 17579562]
- 5.
Бессон Дж. М. Нейробиология боли. Ланцет. 1999 мая 08;353(9164):1610-5. [PubMed: 10334274]
- 6.
Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Боль у плода: систематический междисциплинарный обзор доказательств. ДЖАМА. 2005 г., 24 августа; 294(8):947-54. [PubMed: 16118385]
- 7.
Гловер В., Фиск Н.М. Боль плода: последствия для исследований и практики. Br J Obstet Gynaecol. 1999 г., сен; 106 (9): 881-6. [PubMed: 10492096]
- 8.
Anand KJ, Hickey PR. Боль и ее последствия у новорожденного и плода человека. N Engl J Med. 1987 19 ноября; 317(21):1321-9. [PubMed: 3317037]
- 9.

Гарланд ЭЛ. Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012 сен; 39 (3): 561-71. [Бесплатная статья PMC: PMC3438523] [PubMed: 22958566]
- 10.
Моррисон И., Перини И., Данхэм Дж. Аспекты и механизмы адаптивного болевого поведения: прогнозирующая регуляция и действие. Передний шум нейронов. 2013 28 ноября; 7:755. [Бесплатная статья PMC: PMC3842910] [PubMed: 24348358]
- 11.
Кук Д.Ф., Грациано М.С. Оборонительные движения, вызываемые струей воздуха у обезьян. J Нейрофизиол. 2003 ноябрь; 90 (5): 3317-29. [PubMed: 12801896]
- 12.
Braz J, Solorzano C, Wang X, Basbaum AI. Передача сообщений о боли и зуде: современный взгляд на цепи спинного мозга, которые генерируют контроль ворот. Нейрон. 2014 07 мая; 82 (3): 522-36. [Бесплатная статья PMC: PMC4492533] [PubMed: 24811377]
- 13.
Хансен Г.Р., Стрельцер Дж.
 Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]
Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]- 14.
Янгер Дж., МакКью Р., Макки С. Исходы боли: краткий обзор инструментов и методов. Curr Pain Headache Rep. 2009 Feb;13(1):39-43. [Бесплатная статья PMC: PMC28] [PubMed: 170]
- 15.
Farrar JT, Berlin JA, Strom BL. Клинически важные изменения в показателях исхода острой боли: проверочное исследование. J Управление симптомами боли. 2003 г., май; 25(5):406-11. [В паблике: 12727037]
- 16.
Сикандар С., Дикенсон А.Х. Висцеральная боль: входы и выходы, взлеты и падения. Curr Opin Support Palliat Care. 2012 март;6(1):17-26. [Бесплатная статья PMC: PMC3272481] [PubMed: 22246042]
- 17.
Кэмпбелл Дж. Н., Мейер Р.А. Механизмы нейропатической боли. Нейрон. 2006 05 октября; 52 (1): 77-92. [Бесплатная статья PMC: PMC1810425] [PubMed: 17015228]
- 18.
Арендт-Нильсен Л.
 , Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]
, Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]- 19.
Цинь С., Чендлер М.Дж., Миллер К.Е., Форман Р.Д. Ответы и афферентные пути поверхностных и более глубоких клеток c(1)-c(2) спинного мозга на интраперикардиальные алгогенные химические вещества у крыс. J Нейрофизиол. 2001 г., апрель; 85 (4): 1522-32. [PubMed: 11287476]
- 20.
Богдук Н. Об определениях и физиологии боли в спине, отраженной и корешковой боли. Боль. 2009 15 декабря; 147 (1-3): 17-9. [PubMed: 19762151]
- 21.
Гебхарт Г.Ф., Билефельдт К. Физиология висцеральной боли. сост. физиол. 2016 15 сентября; 6 (4): 1609-1633. [PubMed: 27783853]
- 22.
Форман Р.Д., Гарретт К.М., Блэр Р.В. Механизмы сердечной боли. сост. физиол. 2015 Апрель;5(2):929-60. [PubMed: 25880519]
Физиология, боль — StatPearls — Книжная полка NCBI
Цзятонг (Стивен) Чен; Патрисия Ф. Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Информация об авторе
Последнее обновление: 26 июля 2021 г.
Введение
Боль, вероятно, является наиболее распространенной симптоматической жалобой в медицине; понимание его патофизиологии имеет решающее значение для его интерпретации у пациентов.
Стоит различать термины ноцицепция и боль. Ноцицепция относится к обнаружению вредных раздражителей ноцицепторами с последующей трансдукцией и передачей сенсорной нервной информации с периферии в мозг. Для сравнения, боль относится к продукту обработки высших мозговых центров; это влечет за собой фактические неприятные эмоциональные и сенсорные переживания, порожденные нервными сигналами. Таким образом, сообщения о боли являются не просто прямым результатом ноцицепции, они включают взаимодействие с многочисленными входными данными (внимание, аффективные измерения, вегетативные переменные, иммунные переменные и т. д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
Клеточный
Когда термические, механические или химические раздражители достигают пагубной интенсивности, свидетельствующей о травме, они обнаруживаются ноцицепторами, представляющими собой субпопуляцию периферических нервных волокон, обнаруженных в коже, суставах, внутренних органах, костях и мышцах.[ 3]
Поврежденная ткань высвобождает и производит многочисленные факторы, которые, в свою очередь, активируют нервные окончания. Эти факторы включают, среди прочего, глобулин, протеинкиназы, арахидоновую кислоту, гистамин, фактор роста нервов (NGF), вещество P (SP), пептид, родственный гену кальцитонина (CGRP). Эти факторы стимулируют каналы преобразователя, основным примером которых являются каналы переходного рецепторного потенциала (TRP) [3]. Каналы TRP функционируют аналогично потенциалзависимым калиевым каналам или каналам, управляемым нуклеотидами, и, таким образом, помогают инициировать рецепторные потенциалы, следовательно, индуцируя потенциал действия в нервных волокнах.
Два основных класса ноцицепторов включают миелинизированные (А-дельта) афференты среднего диаметра, которые передают острую, хорошо локализованную быструю боль, и немиелинизированные С-волокна малого диаметра, которые передают плохо локализованную, медленную боль.[3][4] ][5]
На основании электрофизиологических исследований А-дельта-ноцицепторы могут быть дополнительно подразделены на классы А-дельта типа I и типа II. Ноцицепторы А-дельта типа I функционируют, реагируя на механические и химические раздражители, но обычно обнаруживают тепло только при более высоких порогах (более 50°С). Напротив, ноцицепторы А-дельта типа II обладают гораздо большей чувствительностью к теплу, но обладают очень высоким механическим порогом. Таким образом, в ситуациях прямых механических раздражителей (например, укол булавкой) первыми провоцируются А-дельта-ноцицепторы типа I, тогда как в случаях острого вредного тепла, вероятно, сначала активируются А-дельта-ноцицепторы типа II.[3] [4] [5]
Подобно А-дельта-ноцицепторам, большинство немиелинизированных С-волокон являются полимодальными и, таким образом, реагируют как на механические, так и на термические раздражители. Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Разработка
Из-за явных ограничений прямого измерения боли у плода, выяснение временной шкалы развития восприятия боли зависит от вторичных измерений. Во время внутриутробного развития ноцицептивные процессы (сенсорные рецепторы и синапсы спинного мозга) развиваются раньше, чем таламокортикальные пути, необходимые для сознательного восприятия боли. Свободные нервные окончания начинают развиваться примерно на седьмой неделе беременности, в период, когда ламинарная структура таламуса или коры еще не созрела. Гистологические исследования плодов человека показывают, что таламические проекции в корковую пластинку обычно развиваются в возрасте от 23 до 30 недель беременности [6]. Типичные реакции гормонального стресса на боль наблюдаются у плодов около 18 недель беременности, в то время как гемодинамические реакции головного мозга и поведенческие реакции на ноцицептивные стимулы совпадают к 26 неделе беременности.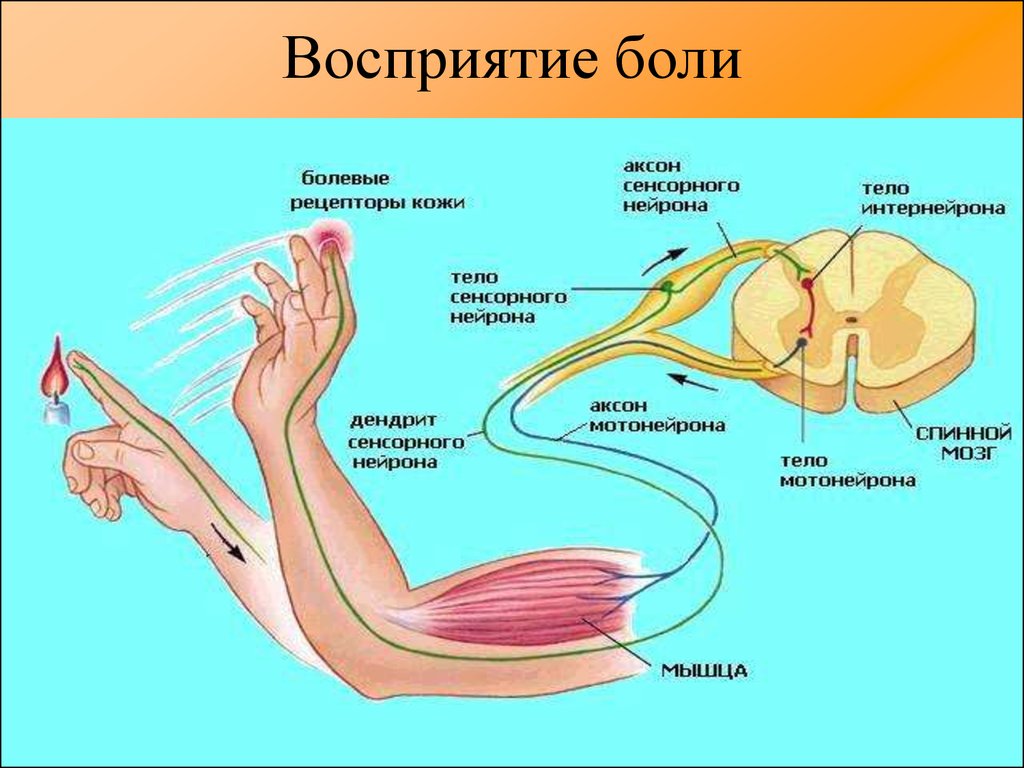 Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Вовлеченные системы органов
Хотя в этой статье отмечается, что ноцицепторы присутствуют во внутренних органах, коже, суставах, костях и мышцах, важным соображением является то, что ноцицепторы не обнаружены в ЦНС; это объяснение того, почему краниотомия в сознании возможна и безболезненна для пациента.
Также необходимо понимать, что конкретные сенсорные модальности, ведущие к ноцицепции, различаются в зависимости от типа ткани: экзогенные аллергены)
Болезненные раздражители в суставах обычно возникают в результате механического стресса (например, чрезмерная нагрузка на сустав) и химического воспаления
Во внутренних органах: механическое растяжение, растяжение, а также химические раздражители обычно вызывают ноцицептивные сигналы
В мышцах наиболее распространены тяжелые механические нагрузки (например, тупая сила, чрезмерное растяжение) и химические модальности
Ноцицептивная передача сигнала в мозг вызывает восприятие боли.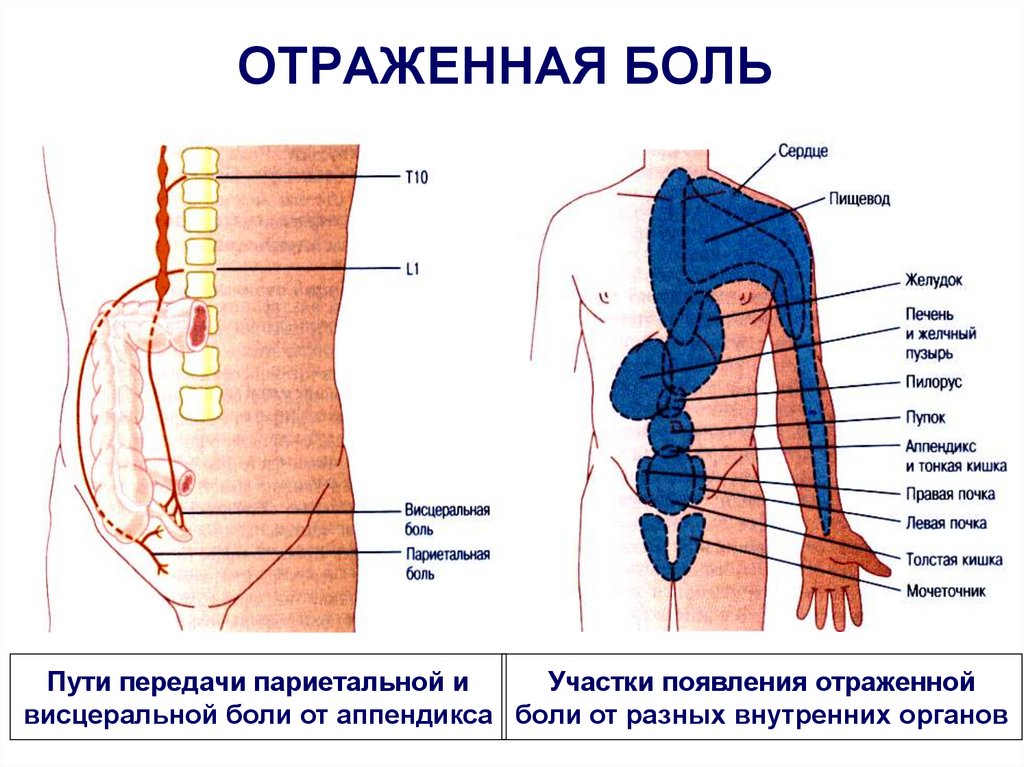 Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Функция
Нервные механизмы боли и ноцицепции выполняют адаптивную функцию, сводя к минимуму повреждение тканей от окружающей среды. Важно отметить, что существует несколько операционных категорий болевого поведения. Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Механизм
Под действием многочисленных медиаторов воспаления (как описано ранее в этой статье) в месте повреждения выделяется «воспалительный суп», стимулирующий активацию ноцицепторов. Афферентные ноцицепторы с периферии передают повреждающие сигналы к проекционным нейронам, расположенным в дорсальных рогах спинного мозга. Клетки в заднем роге располагаются слоями физиологически обособленных отделов, называемых пластинками. В зависимости от типа синапса в пластинках, образованных ноцицептивным волокном, подмножество этих проекционных нейронов будет передавать информацию в соматосенсорную кору через таламус, которая предоставляет информацию о пространственных характеристиках и интенсивности болевого стимула. 4][5]
4][5]
Учитывая различие между болью и ноцицепцией, важно также учитывать различные нервные пути, участвующие в аффективном, корковом компоненте переживания боли. Этому процессу способствуют проекционные нейроны, которые задействуют поясную и островковую кору через связи с парабрахиальным ядром ствола мозга, а также с миндалевидным телом, и считается восходящим путем, который инициирует сознательное восприятие боли. Восходящая информация может также побудить нейроны рострального вентрального продолговатого мозга и периакведуктального серого среднего мозга задействовать нисходящие системы обратной связи, которые регулируют выход из спинного мозга и, таким образом, модулируют болевые ощущения. Это происходит за счет высвобождения гормонов и химических веществ (например, эндогенных опиоидов, ГАМК, глицина), которые могут обладать обезболивающими свойствами для ограничения болевых ощущений. И наоборот, такие вещества, как вещество Р, глутамат и аспартат, могут воздействовать на спинной мозг, вызывая восприятие боли. [3][4][5]
[3][4][5]
Локальная стимуляция А-дельта и А-бета также служит для модулирования передачи болевой информации посредством возбуждения интернейронов. Эти интернейроны оказывают тормозящее влияние на нейроны проекции заднего рога, которые передают сигналы в переднебоковую систему. Это основной механизм растирания раны с целью притупить острую боль.[12]
В основе восприятия боли лежит ряд психологических процессов. Ориентация внимания на болезненное ощущение и его источник может способствовать усилению болезненного переживания. Например, обнаружено, что пациенты с соматической озабоченностью и ипохондрией чрезмерно обращают внимание на телесные ощущения, усиливая их в виде боли. Точно так же другие факторы, такие как когнитивная оценка значения ощущения, эмоциональные и психофизиологические реакции, ожидания и навыки преодоления, могут служить обратной связью, влияющей на восприятие боли.[13]
Связанные исследования
Сложная, многогранная и субъективная природа боли делает ее довольно сложной для клинического измерения. За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
В настоящее время инструменты, упомянутые выше, используются в основном в исследовательских целях, хотя предлагаются новые экспериментальные измерения боли, например, нейровизуализация в качестве объективного измерения.[17]
Клиническое значение
Характеристики боли у пациента указывают на ее патогенез. Таким образом, краткое объяснение классов боли полезно с клинической точки зрения, чтобы помочь в управлении болью как симптомом и возможной диагностикой основного состояния.
Острая боль : В месте местного повреждения ткани активация ноцицептивных преобразователей способствует возникновению этой формы боли. Местная травматическая среда может дополнительно изменить характеристики ноцицепторов, центральных связей и вегетативной нервной системы.[1][2][3][4]
Хроническая боль : Постоянная боль часто связана с состояниями (например, сахарным диабетом, артритом и ростом опухоли), которые усиливают хроническое воспаление тканей или изменение свойств периферических нервов (нейропатические). Учитывая непрекращающийся характер хронической боли, ожидается, что внешние факторы, такие как стресс, эмоции и окружающая среда, могут оказывать суммарный эффект на поврежденную ткань, усиливая интенсивность и постоянство боли. [1-4]
Соматическая боль : Эта форма боли может быть острой или хронической и активируется ноцицепторами в кожных или глубоких тканях. В случае кожной соматической боли, например, при порезе кожи, она описывается как острая или жгучая и хорошо локализована.
 В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]Висцеральная боль : Эта боль возникает в основном во внутренних органах и глубоких соматических структурах (например, боль в желудочно-кишечном тракте). Висцеральная боль, не имеющая четкой локализации, переносится по С-волокнам из глубоких структур в спинной мозг.[16]
Нейропатическая : Эта постоянная боль часто является следствием повреждения этих нервных волокон, что приводит к усилению спонтанного возбуждения или изменению их проводимости или нейромедиаторных свойств.[17]
Аллодиния : Боль, вызванная обычно безвредным раздражителем, называется аллодинией. Хотя механизм до конца не ясен, считается, что он потенциально возникает из-за 1) сенсибилизации кожи, приводящей к снижению порога молчащих ноцицепторов, или 2) повреждения периферических нейронов, вызывающего структурные изменения, приводящие к перенаправлению сенсорно-чувствительных волокон и формированию синапсов.
 в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]Гипералгезия : Возникает, когда вредные раздражители вызывают преувеличенную болевую реакцию. Механизмы аналогичны предложенным в случае аллодинии, когда пациенты демонстрируют усиление боли или гипералгезию, а также длительное сохранение боли.[3]
Отраженная боль : При восприятии боли в месте, отличном от места болевого раздражителя, это называется отраженной болью. Классический пример отраженной боли включает боль в шее, плечах и спине после инфаркта миокарда. В настоящее время нет единого мнения относительно истинных механизмов отраженной боли, и существует несколько теорий. Отраженная боль может быть висцеральной или соматической, причем первая описывает боль от органа, а вторая описывает боль от глубоких тканей, таких как мышцы или суставы. В Рухе 1961 конвергентно-проекционная теория, где афферентные висцеральные сенсорные болевые волокна и соматические волокна входят в одни и те же спинномозговые ганглии задних корешков спинного мозга, заставляя ЦНС ошибочно интерпретировать боль как возникающую где-то на стенке тела, а не во внутренних органах.
 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Контрольные вопросы
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Раффаэли В., Арнаудо Э. Боль как болезнь: обзор. Джей Боль Рез. 2017;10:2003-2008. [Бесплатная статья PMC: PMC5573040] [PubMed: 28860855]
- 2.
Loeser JD, Melzack R. Боль: обзор. Ланцет. 1999 мая 08; 353 (9164): 1607-9. [PubMed: 10334273]
- 3.
Basbaum AI, Bautista DM, Scherrer G, Julius D.
 Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]- 4.
Венкатачалам К., Монтелл К. Каналы ГТО. Анну Рев Биохим. 2007;76:387-417. [Бесплатная статья PMC: PMC4196875] [PubMed: 17579562]
- 5.
Бессон Дж. М. Нейробиология боли. Ланцет. 1999 мая 08;353(9164):1610-5. [PubMed: 10334274]
- 6.
Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Боль у плода: систематический междисциплинарный обзор доказательств. ДЖАМА. 2005 г., 24 августа; 294(8):947-54. [PubMed: 16118385]
- 7.
Гловер В., Фиск Н.М. Боль плода: последствия для исследований и практики. Br J Obstet Gynaecol. 1999 г., сен; 106 (9): 881-6. [PubMed: 10492096]
- 8.
Anand KJ, Hickey PR. Боль и ее последствия у новорожденного и плода человека. N Engl J Med. 1987 19 ноября; 317(21):1321-9. [PubMed: 3317037]
- 9.

Гарланд ЭЛ. Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012 сен; 39 (3): 561-71. [Бесплатная статья PMC: PMC3438523] [PubMed: 22958566]
- 10.
Моррисон И., Перини И., Данхэм Дж. Аспекты и механизмы адаптивного болевого поведения: прогнозирующая регуляция и действие. Передний шум нейронов. 2013 28 ноября; 7:755. [Бесплатная статья PMC: PMC3842910] [PubMed: 24348358]
- 11.
Кук Д.Ф., Грациано М.С. Оборонительные движения, вызываемые струей воздуха у обезьян. J Нейрофизиол. 2003 ноябрь; 90 (5): 3317-29. [PubMed: 12801896]
- 12.
Braz J, Solorzano C, Wang X, Basbaum AI. Передача сообщений о боли и зуде: современный взгляд на цепи спинного мозга, которые генерируют контроль ворот. Нейрон. 2014 07 мая; 82 (3): 522-36. [Бесплатная статья PMC: PMC4492533] [PubMed: 24811377]
- 13.
Хансен Г.Р., Стрельцер Дж.
 Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]
Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]- 14.
Янгер Дж., МакКью Р., Макки С. Исходы боли: краткий обзор инструментов и методов. Curr Pain Headache Rep. 2009 Feb;13(1):39-43. [Бесплатная статья PMC: PMC28] [PubMed: 170]
- 15.
Farrar JT, Berlin JA, Strom BL. Клинически важные изменения в показателях исхода острой боли: проверочное исследование. J Управление симптомами боли. 2003 г., май; 25(5):406-11. [В паблике: 12727037]
- 16.
Сикандар С., Дикенсон А.Х. Висцеральная боль: входы и выходы, взлеты и падения. Curr Opin Support Palliat Care. 2012 март;6(1):17-26. [Бесплатная статья PMC: PMC3272481] [PubMed: 22246042]
- 17.
Кэмпбелл Дж. Н., Мейер Р.А. Механизмы нейропатической боли. Нейрон. 2006 05 октября; 52 (1): 77-92. [Бесплатная статья PMC: PMC1810425] [PubMed: 17015228]
- 18.
Арендт-Нильсен Л.
 , Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]
, Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]- 19.
Цинь С., Чендлер М.Дж., Миллер К.Е., Форман Р.Д. Ответы и афферентные пути поверхностных и более глубоких клеток c(1)-c(2) спинного мозга на интраперикардиальные алгогенные химические вещества у крыс. J Нейрофизиол. 2001 г., апрель; 85 (4): 1522-32. [PubMed: 11287476]
- 20.
Богдук Н. Об определениях и физиологии боли в спине, отраженной и корешковой боли. Боль. 2009 15 декабря; 147 (1-3): 17-9. [PubMed: 19762151]
- 21.
Гебхарт Г.Ф., Билефельдт К. Физиология висцеральной боли. сост. физиол. 2016 15 сентября; 6 (4): 1609-1633. [PubMed: 27783853]
- 22.
Форман Р.Д., Гарретт К.М., Блэр Р.В. Механизмы сердечной боли. сост. физиол. 2015 Апрель;5(2):929-60. [PubMed: 25880519]
Физиология, боль — StatPearls — Книжная полка NCBI
Цзятонг (Стивен) Чен; Патрисия Ф. Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Информация об авторе
Последнее обновление: 26 июля 2021 г.
Введение
Боль, вероятно, является наиболее распространенной симптоматической жалобой в медицине; понимание его патофизиологии имеет решающее значение для его интерпретации у пациентов.
Стоит различать термины ноцицепция и боль. Ноцицепция относится к обнаружению вредных раздражителей ноцицепторами с последующей трансдукцией и передачей сенсорной нервной информации с периферии в мозг. Для сравнения, боль относится к продукту обработки высших мозговых центров; это влечет за собой фактические неприятные эмоциональные и сенсорные переживания, порожденные нервными сигналами. Таким образом, сообщения о боли являются не просто прямым результатом ноцицепции, они включают взаимодействие с многочисленными входными данными (внимание, аффективные измерения, вегетативные переменные, иммунные переменные и т. д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
Клеточный
Когда термические, механические или химические раздражители достигают пагубной интенсивности, свидетельствующей о травме, они обнаруживаются ноцицепторами, представляющими собой субпопуляцию периферических нервных волокон, обнаруженных в коже, суставах, внутренних органах, костях и мышцах.[ 3]
Поврежденная ткань высвобождает и производит многочисленные факторы, которые, в свою очередь, активируют нервные окончания. Эти факторы включают, среди прочего, глобулин, протеинкиназы, арахидоновую кислоту, гистамин, фактор роста нервов (NGF), вещество P (SP), пептид, родственный гену кальцитонина (CGRP). Эти факторы стимулируют каналы преобразователя, основным примером которых являются каналы переходного рецепторного потенциала (TRP) [3]. Каналы TRP функционируют аналогично потенциалзависимым калиевым каналам или каналам, управляемым нуклеотидами, и, таким образом, помогают инициировать рецепторные потенциалы, следовательно, индуцируя потенциал действия в нервных волокнах.
Два основных класса ноцицепторов включают миелинизированные (А-дельта) афференты среднего диаметра, которые передают острую, хорошо локализованную быструю боль, и немиелинизированные С-волокна малого диаметра, которые передают плохо локализованную, медленную боль.[3][4] ][5]
На основании электрофизиологических исследований А-дельта-ноцицепторы могут быть дополнительно подразделены на классы А-дельта типа I и типа II. Ноцицепторы А-дельта типа I функционируют, реагируя на механические и химические раздражители, но обычно обнаруживают тепло только при более высоких порогах (более 50°С). Напротив, ноцицепторы А-дельта типа II обладают гораздо большей чувствительностью к теплу, но обладают очень высоким механическим порогом. Таким образом, в ситуациях прямых механических раздражителей (например, укол булавкой) первыми провоцируются А-дельта-ноцицепторы типа I, тогда как в случаях острого вредного тепла, вероятно, сначала активируются А-дельта-ноцицепторы типа II.[3] [4] [5]
Подобно А-дельта-ноцицепторам, большинство немиелинизированных С-волокон являются полимодальными и, таким образом, реагируют как на механические, так и на термические раздражители. Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Разработка
Из-за явных ограничений прямого измерения боли у плода, выяснение временной шкалы развития восприятия боли зависит от вторичных измерений. Во время внутриутробного развития ноцицептивные процессы (сенсорные рецепторы и синапсы спинного мозга) развиваются раньше, чем таламокортикальные пути, необходимые для сознательного восприятия боли. Свободные нервные окончания начинают развиваться примерно на седьмой неделе беременности, в период, когда ламинарная структура таламуса или коры еще не созрела. Гистологические исследования плодов человека показывают, что таламические проекции в корковую пластинку обычно развиваются в возрасте от 23 до 30 недель беременности [6]. Типичные реакции гормонального стресса на боль наблюдаются у плодов около 18 недель беременности, в то время как гемодинамические реакции головного мозга и поведенческие реакции на ноцицептивные стимулы совпадают к 26 неделе беременности. Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Вовлеченные системы органов
Хотя в этой статье отмечается, что ноцицепторы присутствуют во внутренних органах, коже, суставах, костях и мышцах, важным соображением является то, что ноцицепторы не обнаружены в ЦНС; это объяснение того, почему краниотомия в сознании возможна и безболезненна для пациента.
Также необходимо понимать, что конкретные сенсорные модальности, ведущие к ноцицепции, различаются в зависимости от типа ткани: экзогенные аллергены)
Болезненные раздражители в суставах обычно возникают в результате механического стресса (например, чрезмерная нагрузка на сустав) и химического воспаления
Во внутренних органах: механическое растяжение, растяжение, а также химические раздражители обычно вызывают ноцицептивные сигналы
В мышцах наиболее распространены тяжелые механические нагрузки (например, тупая сила, чрезмерное растяжение) и химические модальности
Ноцицептивная передача сигнала в мозг вызывает восприятие боли. Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Функция
Нервные механизмы боли и ноцицепции выполняют адаптивную функцию, сводя к минимуму повреждение тканей от окружающей среды. Важно отметить, что существует несколько операционных категорий болевого поведения. Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Механизм
Под действием многочисленных медиаторов воспаления (как описано ранее в этой статье) в месте повреждения выделяется «воспалительный суп», стимулирующий активацию ноцицепторов. Афферентные ноцицепторы с периферии передают повреждающие сигналы к проекционным нейронам, расположенным в дорсальных рогах спинного мозга. Клетки в заднем роге располагаются слоями физиологически обособленных отделов, называемых пластинками. В зависимости от типа синапса в пластинках, образованных ноцицептивным волокном, подмножество этих проекционных нейронов будет передавать информацию в соматосенсорную кору через таламус, которая предоставляет информацию о пространственных характеристиках и интенсивности болевого стимула. 4][5]
4][5]
Учитывая различие между болью и ноцицепцией, важно также учитывать различные нервные пути, участвующие в аффективном, корковом компоненте переживания боли. Этому процессу способствуют проекционные нейроны, которые задействуют поясную и островковую кору через связи с парабрахиальным ядром ствола мозга, а также с миндалевидным телом, и считается восходящим путем, который инициирует сознательное восприятие боли. Восходящая информация может также побудить нейроны рострального вентрального продолговатого мозга и периакведуктального серого среднего мозга задействовать нисходящие системы обратной связи, которые регулируют выход из спинного мозга и, таким образом, модулируют болевые ощущения. Это происходит за счет высвобождения гормонов и химических веществ (например, эндогенных опиоидов, ГАМК, глицина), которые могут обладать обезболивающими свойствами для ограничения болевых ощущений. И наоборот, такие вещества, как вещество Р, глутамат и аспартат, могут воздействовать на спинной мозг, вызывая восприятие боли. [3][4][5]
[3][4][5]
Локальная стимуляция А-дельта и А-бета также служит для модулирования передачи болевой информации посредством возбуждения интернейронов. Эти интернейроны оказывают тормозящее влияние на нейроны проекции заднего рога, которые передают сигналы в переднебоковую систему. Это основной механизм растирания раны с целью притупить острую боль.[12]
В основе восприятия боли лежит ряд психологических процессов. Ориентация внимания на болезненное ощущение и его источник может способствовать усилению болезненного переживания. Например, обнаружено, что пациенты с соматической озабоченностью и ипохондрией чрезмерно обращают внимание на телесные ощущения, усиливая их в виде боли. Точно так же другие факторы, такие как когнитивная оценка значения ощущения, эмоциональные и психофизиологические реакции, ожидания и навыки преодоления, могут служить обратной связью, влияющей на восприятие боли.[13]
Связанные исследования
Сложная, многогранная и субъективная природа боли делает ее довольно сложной для клинического измерения. За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
В настоящее время инструменты, упомянутые выше, используются в основном в исследовательских целях, хотя предлагаются новые экспериментальные измерения боли, например, нейровизуализация в качестве объективного измерения.[17]
Клиническое значение
Характеристики боли у пациента указывают на ее патогенез. Таким образом, краткое объяснение классов боли полезно с клинической точки зрения, чтобы помочь в управлении болью как симптомом и возможной диагностикой основного состояния.
Острая боль : В месте местного повреждения ткани активация ноцицептивных преобразователей способствует возникновению этой формы боли. Местная травматическая среда может дополнительно изменить характеристики ноцицепторов, центральных связей и вегетативной нервной системы.[1][2][3][4]
Хроническая боль : Постоянная боль часто связана с состояниями (например, сахарным диабетом, артритом и ростом опухоли), которые усиливают хроническое воспаление тканей или изменение свойств периферических нервов (нейропатические). Учитывая непрекращающийся характер хронической боли, ожидается, что внешние факторы, такие как стресс, эмоции и окружающая среда, могут оказывать суммарный эффект на поврежденную ткань, усиливая интенсивность и постоянство боли. [1-4]
Соматическая боль : Эта форма боли может быть острой или хронической и активируется ноцицепторами в кожных или глубоких тканях. В случае кожной соматической боли, например, при порезе кожи, она описывается как острая или жгучая и хорошо локализована.
 В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]Висцеральная боль : Эта боль возникает в основном во внутренних органах и глубоких соматических структурах (например, боль в желудочно-кишечном тракте). Висцеральная боль, не имеющая четкой локализации, переносится по С-волокнам из глубоких структур в спинной мозг.[16]
Нейропатическая : Эта постоянная боль часто является следствием повреждения этих нервных волокон, что приводит к усилению спонтанного возбуждения или изменению их проводимости или нейромедиаторных свойств.[17]
Аллодиния : Боль, вызванная обычно безвредным раздражителем, называется аллодинией. Хотя механизм до конца не ясен, считается, что он потенциально возникает из-за 1) сенсибилизации кожи, приводящей к снижению порога молчащих ноцицепторов, или 2) повреждения периферических нейронов, вызывающего структурные изменения, приводящие к перенаправлению сенсорно-чувствительных волокон и формированию синапсов.
 в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]Гипералгезия : Возникает, когда вредные раздражители вызывают преувеличенную болевую реакцию. Механизмы аналогичны предложенным в случае аллодинии, когда пациенты демонстрируют усиление боли или гипералгезию, а также длительное сохранение боли.[3]
Отраженная боль : При восприятии боли в месте, отличном от места болевого раздражителя, это называется отраженной болью. Классический пример отраженной боли включает боль в шее, плечах и спине после инфаркта миокарда. В настоящее время нет единого мнения относительно истинных механизмов отраженной боли, и существует несколько теорий. Отраженная боль может быть висцеральной или соматической, причем первая описывает боль от органа, а вторая описывает боль от глубоких тканей, таких как мышцы или суставы. В Рухе 1961 конвергентно-проекционная теория, где афферентные висцеральные сенсорные болевые волокна и соматические волокна входят в одни и те же спинномозговые ганглии задних корешков спинного мозга, заставляя ЦНС ошибочно интерпретировать боль как возникающую где-то на стенке тела, а не во внутренних органах.
 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Контрольные вопросы
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Раффаэли В., Арнаудо Э. Боль как болезнь: обзор. Джей Боль Рез. 2017;10:2003-2008. [Бесплатная статья PMC: PMC5573040] [PubMed: 28860855]
- 2.
Loeser JD, Melzack R. Боль: обзор. Ланцет. 1999 мая 08; 353 (9164): 1607-9. [PubMed: 10334273]
- 3.
Basbaum AI, Bautista DM, Scherrer G, Julius D.
 Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]- 4.
Венкатачалам К., Монтелл К. Каналы ГТО. Анну Рев Биохим. 2007;76:387-417. [Бесплатная статья PMC: PMC4196875] [PubMed: 17579562]
- 5.
Бессон Дж. М. Нейробиология боли. Ланцет. 1999 мая 08;353(9164):1610-5. [PubMed: 10334274]
- 6.
Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Боль у плода: систематический междисциплинарный обзор доказательств. ДЖАМА. 2005 г., 24 августа; 294(8):947-54. [PubMed: 16118385]
- 7.
Гловер В., Фиск Н.М. Боль плода: последствия для исследований и практики. Br J Obstet Gynaecol. 1999 г., сен; 106 (9): 881-6. [PubMed: 10492096]
- 8.
Anand KJ, Hickey PR. Боль и ее последствия у новорожденного и плода человека. N Engl J Med. 1987 19 ноября; 317(21):1321-9. [PubMed: 3317037]
- 9.

Гарланд ЭЛ. Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012 сен; 39 (3): 561-71. [Бесплатная статья PMC: PMC3438523] [PubMed: 22958566]
- 10.
Моррисон И., Перини И., Данхэм Дж. Аспекты и механизмы адаптивного болевого поведения: прогнозирующая регуляция и действие. Передний шум нейронов. 2013 28 ноября; 7:755. [Бесплатная статья PMC: PMC3842910] [PubMed: 24348358]
- 11.
Кук Д.Ф., Грациано М.С. Оборонительные движения, вызываемые струей воздуха у обезьян. J Нейрофизиол. 2003 ноябрь; 90 (5): 3317-29. [PubMed: 12801896]
- 12.
Braz J, Solorzano C, Wang X, Basbaum AI. Передача сообщений о боли и зуде: современный взгляд на цепи спинного мозга, которые генерируют контроль ворот. Нейрон. 2014 07 мая; 82 (3): 522-36. [Бесплатная статья PMC: PMC4492533] [PubMed: 24811377]
- 13.
Хансен Г.Р., Стрельцер Дж.
 Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]
Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]- 14.
Янгер Дж., МакКью Р., Макки С. Исходы боли: краткий обзор инструментов и методов. Curr Pain Headache Rep. 2009 Feb;13(1):39-43. [Бесплатная статья PMC: PMC28] [PubMed: 170]
- 15.
Farrar JT, Berlin JA, Strom BL. Клинически важные изменения в показателях исхода острой боли: проверочное исследование. J Управление симптомами боли. 2003 г., май; 25(5):406-11. [В паблике: 12727037]
- 16.
Сикандар С., Дикенсон А.Х. Висцеральная боль: входы и выходы, взлеты и падения. Curr Opin Support Palliat Care. 2012 март;6(1):17-26. [Бесплатная статья PMC: PMC3272481] [PubMed: 22246042]
- 17.
Кэмпбелл Дж. Н., Мейер Р.А. Механизмы нейропатической боли. Нейрон. 2006 05 октября; 52 (1): 77-92. [Бесплатная статья PMC: PMC1810425] [PubMed: 17015228]
- 18.
Арендт-Нильсен Л.
 , Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]
, Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]- 19.
Цинь С., Чендлер М.Дж., Миллер К.Е., Форман Р.Д. Ответы и афферентные пути поверхностных и более глубоких клеток c(1)-c(2) спинного мозга на интраперикардиальные алгогенные химические вещества у крыс. J Нейрофизиол. 2001 г., апрель; 85 (4): 1522-32. [PubMed: 11287476]
- 20.
Богдук Н. Об определениях и физиологии боли в спине, отраженной и корешковой боли. Боль. 2009 15 декабря; 147 (1-3): 17-9. [PubMed: 19762151]
- 21.
Гебхарт Г.Ф., Билефельдт К. Физиология висцеральной боли. сост. физиол. 2016 15 сентября; 6 (4): 1609-1633. [PubMed: 27783853]
- 22.
Форман Р.Д., Гарретт К.М., Блэр Р.В. Механизмы сердечной боли. сост. физиол. 2015 Апрель;5(2):929-60. [PubMed: 25880519]
Физиология, боль — StatPearls — Книжная полка NCBI
Цзятонг (Стивен) Чен; Патрисия Ф. Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Информация об авторе
Последнее обновление: 26 июля 2021 г.
Введение
Боль, вероятно, является наиболее распространенной симптоматической жалобой в медицине; понимание его патофизиологии имеет решающее значение для его интерпретации у пациентов.
Стоит различать термины ноцицепция и боль. Ноцицепция относится к обнаружению вредных раздражителей ноцицепторами с последующей трансдукцией и передачей сенсорной нервной информации с периферии в мозг. Для сравнения, боль относится к продукту обработки высших мозговых центров; это влечет за собой фактические неприятные эмоциональные и сенсорные переживания, порожденные нервными сигналами. Таким образом, сообщения о боли являются не просто прямым результатом ноцицепции, они включают взаимодействие с многочисленными входными данными (внимание, аффективные измерения, вегетативные переменные, иммунные переменные и т. д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
Клеточный
Когда термические, механические или химические раздражители достигают пагубной интенсивности, свидетельствующей о травме, они обнаруживаются ноцицепторами, представляющими собой субпопуляцию периферических нервных волокон, обнаруженных в коже, суставах, внутренних органах, костях и мышцах.[ 3]
Поврежденная ткань высвобождает и производит многочисленные факторы, которые, в свою очередь, активируют нервные окончания. Эти факторы включают, среди прочего, глобулин, протеинкиназы, арахидоновую кислоту, гистамин, фактор роста нервов (NGF), вещество P (SP), пептид, родственный гену кальцитонина (CGRP). Эти факторы стимулируют каналы преобразователя, основным примером которых являются каналы переходного рецепторного потенциала (TRP) [3]. Каналы TRP функционируют аналогично потенциалзависимым калиевым каналам или каналам, управляемым нуклеотидами, и, таким образом, помогают инициировать рецепторные потенциалы, следовательно, индуцируя потенциал действия в нервных волокнах.
Два основных класса ноцицепторов включают миелинизированные (А-дельта) афференты среднего диаметра, которые передают острую, хорошо локализованную быструю боль, и немиелинизированные С-волокна малого диаметра, которые передают плохо локализованную, медленную боль.[3][4] ][5]
На основании электрофизиологических исследований А-дельта-ноцицепторы могут быть дополнительно подразделены на классы А-дельта типа I и типа II. Ноцицепторы А-дельта типа I функционируют, реагируя на механические и химические раздражители, но обычно обнаруживают тепло только при более высоких порогах (более 50°С). Напротив, ноцицепторы А-дельта типа II обладают гораздо большей чувствительностью к теплу, но обладают очень высоким механическим порогом. Таким образом, в ситуациях прямых механических раздражителей (например, укол булавкой) первыми провоцируются А-дельта-ноцицепторы типа I, тогда как в случаях острого вредного тепла, вероятно, сначала активируются А-дельта-ноцицепторы типа II.[3] [4] [5]
Подобно А-дельта-ноцицепторам, большинство немиелинизированных С-волокон являются полимодальными и, таким образом, реагируют как на механические, так и на термические раздражители. Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Разработка
Из-за явных ограничений прямого измерения боли у плода, выяснение временной шкалы развития восприятия боли зависит от вторичных измерений. Во время внутриутробного развития ноцицептивные процессы (сенсорные рецепторы и синапсы спинного мозга) развиваются раньше, чем таламокортикальные пути, необходимые для сознательного восприятия боли. Свободные нервные окончания начинают развиваться примерно на седьмой неделе беременности, в период, когда ламинарная структура таламуса или коры еще не созрела. Гистологические исследования плодов человека показывают, что таламические проекции в корковую пластинку обычно развиваются в возрасте от 23 до 30 недель беременности [6]. Типичные реакции гормонального стресса на боль наблюдаются у плодов около 18 недель беременности, в то время как гемодинамические реакции головного мозга и поведенческие реакции на ноцицептивные стимулы совпадают к 26 неделе беременности. Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Вовлеченные системы органов
Хотя в этой статье отмечается, что ноцицепторы присутствуют во внутренних органах, коже, суставах, костях и мышцах, важным соображением является то, что ноцицепторы не обнаружены в ЦНС; это объяснение того, почему краниотомия в сознании возможна и безболезненна для пациента.
Также необходимо понимать, что конкретные сенсорные модальности, ведущие к ноцицепции, различаются в зависимости от типа ткани: экзогенные аллергены)
Болезненные раздражители в суставах обычно возникают в результате механического стресса (например, чрезмерная нагрузка на сустав) и химического воспаления
Во внутренних органах: механическое растяжение, растяжение, а также химические раздражители обычно вызывают ноцицептивные сигналы
В мышцах наиболее распространены тяжелые механические нагрузки (например, тупая сила, чрезмерное растяжение) и химические модальности
Ноцицептивная передача сигнала в мозг вызывает восприятие боли. Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Функция
Нервные механизмы боли и ноцицепции выполняют адаптивную функцию, сводя к минимуму повреждение тканей от окружающей среды. Важно отметить, что существует несколько операционных категорий болевого поведения. Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Механизм
Под действием многочисленных медиаторов воспаления (как описано ранее в этой статье) в месте повреждения выделяется «воспалительный суп», стимулирующий активацию ноцицепторов. Афферентные ноцицепторы с периферии передают повреждающие сигналы к проекционным нейронам, расположенным в дорсальных рогах спинного мозга. Клетки в заднем роге располагаются слоями физиологически обособленных отделов, называемых пластинками. В зависимости от типа синапса в пластинках, образованных ноцицептивным волокном, подмножество этих проекционных нейронов будет передавать информацию в соматосенсорную кору через таламус, которая предоставляет информацию о пространственных характеристиках и интенсивности болевого стимула. 4][5]
4][5]
Учитывая различие между болью и ноцицепцией, важно также учитывать различные нервные пути, участвующие в аффективном, корковом компоненте переживания боли. Этому процессу способствуют проекционные нейроны, которые задействуют поясную и островковую кору через связи с парабрахиальным ядром ствола мозга, а также с миндалевидным телом, и считается восходящим путем, который инициирует сознательное восприятие боли. Восходящая информация может также побудить нейроны рострального вентрального продолговатого мозга и периакведуктального серого среднего мозга задействовать нисходящие системы обратной связи, которые регулируют выход из спинного мозга и, таким образом, модулируют болевые ощущения. Это происходит за счет высвобождения гормонов и химических веществ (например, эндогенных опиоидов, ГАМК, глицина), которые могут обладать обезболивающими свойствами для ограничения болевых ощущений. И наоборот, такие вещества, как вещество Р, глутамат и аспартат, могут воздействовать на спинной мозг, вызывая восприятие боли. [3][4][5]
[3][4][5]
Локальная стимуляция А-дельта и А-бета также служит для модулирования передачи болевой информации посредством возбуждения интернейронов. Эти интернейроны оказывают тормозящее влияние на нейроны проекции заднего рога, которые передают сигналы в переднебоковую систему. Это основной механизм растирания раны с целью притупить острую боль.[12]
В основе восприятия боли лежит ряд психологических процессов. Ориентация внимания на болезненное ощущение и его источник может способствовать усилению болезненного переживания. Например, обнаружено, что пациенты с соматической озабоченностью и ипохондрией чрезмерно обращают внимание на телесные ощущения, усиливая их в виде боли. Точно так же другие факторы, такие как когнитивная оценка значения ощущения, эмоциональные и психофизиологические реакции, ожидания и навыки преодоления, могут служить обратной связью, влияющей на восприятие боли.[13]
Связанные исследования
Сложная, многогранная и субъективная природа боли делает ее довольно сложной для клинического измерения. За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
В настоящее время инструменты, упомянутые выше, используются в основном в исследовательских целях, хотя предлагаются новые экспериментальные измерения боли, например, нейровизуализация в качестве объективного измерения.[17]
Клиническое значение
Характеристики боли у пациента указывают на ее патогенез. Таким образом, краткое объяснение классов боли полезно с клинической точки зрения, чтобы помочь в управлении болью как симптомом и возможной диагностикой основного состояния.
Острая боль : В месте местного повреждения ткани активация ноцицептивных преобразователей способствует возникновению этой формы боли. Местная травматическая среда может дополнительно изменить характеристики ноцицепторов, центральных связей и вегетативной нервной системы.[1][2][3][4]
Хроническая боль : Постоянная боль часто связана с состояниями (например, сахарным диабетом, артритом и ростом опухоли), которые усиливают хроническое воспаление тканей или изменение свойств периферических нервов (нейропатические). Учитывая непрекращающийся характер хронической боли, ожидается, что внешние факторы, такие как стресс, эмоции и окружающая среда, могут оказывать суммарный эффект на поврежденную ткань, усиливая интенсивность и постоянство боли. [1-4]
Соматическая боль : Эта форма боли может быть острой или хронической и активируется ноцицепторами в кожных или глубоких тканях. В случае кожной соматической боли, например, при порезе кожи, она описывается как острая или жгучая и хорошо локализована.
 В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]Висцеральная боль : Эта боль возникает в основном во внутренних органах и глубоких соматических структурах (например, боль в желудочно-кишечном тракте). Висцеральная боль, не имеющая четкой локализации, переносится по С-волокнам из глубоких структур в спинной мозг.[16]
Нейропатическая : Эта постоянная боль часто является следствием повреждения этих нервных волокон, что приводит к усилению спонтанного возбуждения или изменению их проводимости или нейромедиаторных свойств.[17]
Аллодиния : Боль, вызванная обычно безвредным раздражителем, называется аллодинией. Хотя механизм до конца не ясен, считается, что он потенциально возникает из-за 1) сенсибилизации кожи, приводящей к снижению порога молчащих ноцицепторов, или 2) повреждения периферических нейронов, вызывающего структурные изменения, приводящие к перенаправлению сенсорно-чувствительных волокон и формированию синапсов.
 в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]Гипералгезия : Возникает, когда вредные раздражители вызывают преувеличенную болевую реакцию. Механизмы аналогичны предложенным в случае аллодинии, когда пациенты демонстрируют усиление боли или гипералгезию, а также длительное сохранение боли.[3]
Отраженная боль : При восприятии боли в месте, отличном от места болевого раздражителя, это называется отраженной болью. Классический пример отраженной боли включает боль в шее, плечах и спине после инфаркта миокарда. В настоящее время нет единого мнения относительно истинных механизмов отраженной боли, и существует несколько теорий. Отраженная боль может быть висцеральной или соматической, причем первая описывает боль от органа, а вторая описывает боль от глубоких тканей, таких как мышцы или суставы. В Рухе 1961 конвергентно-проекционная теория, где афферентные висцеральные сенсорные болевые волокна и соматические волокна входят в одни и те же спинномозговые ганглии задних корешков спинного мозга, заставляя ЦНС ошибочно интерпретировать боль как возникающую где-то на стенке тела, а не во внутренних органах.
 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Контрольные вопросы
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Раффаэли В., Арнаудо Э. Боль как болезнь: обзор. Джей Боль Рез. 2017;10:2003-2008. [Бесплатная статья PMC: PMC5573040] [PubMed: 28860855]
- 2.
Loeser JD, Melzack R. Боль: обзор. Ланцет. 1999 мая 08; 353 (9164): 1607-9. [PubMed: 10334273]
- 3.
Basbaum AI, Bautista DM, Scherrer G, Julius D.
 Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]- 4.
Венкатачалам К., Монтелл К. Каналы ГТО. Анну Рев Биохим. 2007;76:387-417. [Бесплатная статья PMC: PMC4196875] [PubMed: 17579562]
- 5.
Бессон Дж. М. Нейробиология боли. Ланцет. 1999 мая 08;353(9164):1610-5. [PubMed: 10334274]
- 6.
Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Боль у плода: систематический междисциплинарный обзор доказательств. ДЖАМА. 2005 г., 24 августа; 294(8):947-54. [PubMed: 16118385]
- 7.
Гловер В., Фиск Н.М. Боль плода: последствия для исследований и практики. Br J Obstet Gynaecol. 1999 г., сен; 106 (9): 881-6. [PubMed: 10492096]
- 8.
Anand KJ, Hickey PR. Боль и ее последствия у новорожденного и плода человека. N Engl J Med. 1987 19 ноября; 317(21):1321-9. [PubMed: 3317037]
- 9.

Гарланд ЭЛ. Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012 сен; 39 (3): 561-71. [Бесплатная статья PMC: PMC3438523] [PubMed: 22958566]
- 10.
Моррисон И., Перини И., Данхэм Дж. Аспекты и механизмы адаптивного болевого поведения: прогнозирующая регуляция и действие. Передний шум нейронов. 2013 28 ноября; 7:755. [Бесплатная статья PMC: PMC3842910] [PubMed: 24348358]
- 11.
Кук Д.Ф., Грациано М.С. Оборонительные движения, вызываемые струей воздуха у обезьян. J Нейрофизиол. 2003 ноябрь; 90 (5): 3317-29. [PubMed: 12801896]
- 12.
Braz J, Solorzano C, Wang X, Basbaum AI. Передача сообщений о боли и зуде: современный взгляд на цепи спинного мозга, которые генерируют контроль ворот. Нейрон. 2014 07 мая; 82 (3): 522-36. [Бесплатная статья PMC: PMC4492533] [PubMed: 24811377]
- 13.
Хансен Г.Р., Стрельцер Дж.
 Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]
Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]- 14.
Янгер Дж., МакКью Р., Макки С. Исходы боли: краткий обзор инструментов и методов. Curr Pain Headache Rep. 2009 Feb;13(1):39-43. [Бесплатная статья PMC: PMC28] [PubMed: 170]
- 15.
Farrar JT, Berlin JA, Strom BL. Клинически важные изменения в показателях исхода острой боли: проверочное исследование. J Управление симптомами боли. 2003 г., май; 25(5):406-11. [В паблике: 12727037]
- 16.
Сикандар С., Дикенсон А.Х. Висцеральная боль: входы и выходы, взлеты и падения. Curr Opin Support Palliat Care. 2012 март;6(1):17-26. [Бесплатная статья PMC: PMC3272481] [PubMed: 22246042]
- 17.
Кэмпбелл Дж. Н., Мейер Р.А. Механизмы нейропатической боли. Нейрон. 2006 05 октября; 52 (1): 77-92. [Бесплатная статья PMC: PMC1810425] [PubMed: 17015228]
- 18.
Арендт-Нильсен Л.
 , Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]
, Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]- 19.
Цинь С., Чендлер М.Дж., Миллер К.Е., Форман Р.Д. Ответы и афферентные пути поверхностных и более глубоких клеток c(1)-c(2) спинного мозга на интраперикардиальные алгогенные химические вещества у крыс. J Нейрофизиол. 2001 г., апрель; 85 (4): 1522-32. [PubMed: 11287476]
- 20.
Богдук Н. Об определениях и физиологии боли в спине, отраженной и корешковой боли. Боль. 2009 15 декабря; 147 (1-3): 17-9. [PubMed: 19762151]
- 21.
Гебхарт Г.Ф., Билефельдт К. Физиология висцеральной боли. сост. физиол. 2016 15 сентября; 6 (4): 1609-1633. [PubMed: 27783853]
- 22.
Форман Р.Д., Гарретт К.М., Блэр Р.В. Механизмы сердечной боли. сост. физиол. 2015 Апрель;5(2):929-60. [PubMed: 25880519]
Физиология, боль — StatPearls — Книжная полка NCBI
Цзятонг (Стивен) Чен; Патрисия Ф. Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Кэндл; Ян Мюррей; Лорен А. Фицджеральд; Джасджит С. Сехдев.
Информация об авторе
Последнее обновление: 26 июля 2021 г.
Введение
Боль, вероятно, является наиболее распространенной симптоматической жалобой в медицине; понимание его патофизиологии имеет решающее значение для его интерпретации у пациентов.
Стоит различать термины ноцицепция и боль. Ноцицепция относится к обнаружению вредных раздражителей ноцицепторами с последующей трансдукцией и передачей сенсорной нервной информации с периферии в мозг. Для сравнения, боль относится к продукту обработки высших мозговых центров; это влечет за собой фактические неприятные эмоциональные и сенсорные переживания, порожденные нервными сигналами. Таким образом, сообщения о боли являются не просто прямым результатом ноцицепции, они включают взаимодействие с многочисленными входными данными (внимание, аффективные измерения, вегетативные переменные, иммунные переменные и т. д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
д.) и могут более точно рассматриваться с точки зрения нейроматрицы.[2]
Клеточный
Когда термические, механические или химические раздражители достигают пагубной интенсивности, свидетельствующей о травме, они обнаруживаются ноцицепторами, представляющими собой субпопуляцию периферических нервных волокон, обнаруженных в коже, суставах, внутренних органах, костях и мышцах.[ 3]
Поврежденная ткань высвобождает и производит многочисленные факторы, которые, в свою очередь, активируют нервные окончания. Эти факторы включают, среди прочего, глобулин, протеинкиназы, арахидоновую кислоту, гистамин, фактор роста нервов (NGF), вещество P (SP), пептид, родственный гену кальцитонина (CGRP). Эти факторы стимулируют каналы преобразователя, основным примером которых являются каналы переходного рецепторного потенциала (TRP) [3]. Каналы TRP функционируют аналогично потенциалзависимым калиевым каналам или каналам, управляемым нуклеотидами, и, таким образом, помогают инициировать рецепторные потенциалы, следовательно, индуцируя потенциал действия в нервных волокнах.
Два основных класса ноцицепторов включают миелинизированные (А-дельта) афференты среднего диаметра, которые передают острую, хорошо локализованную быструю боль, и немиелинизированные С-волокна малого диаметра, которые передают плохо локализованную, медленную боль.[3][4] ][5]
На основании электрофизиологических исследований А-дельта-ноцицепторы могут быть дополнительно подразделены на классы А-дельта типа I и типа II. Ноцицепторы А-дельта типа I функционируют, реагируя на механические и химические раздражители, но обычно обнаруживают тепло только при более высоких порогах (более 50°С). Напротив, ноцицепторы А-дельта типа II обладают гораздо большей чувствительностью к теплу, но обладают очень высоким механическим порогом. Таким образом, в ситуациях прямых механических раздражителей (например, укол булавкой) первыми провоцируются А-дельта-ноцицепторы типа I, тогда как в случаях острого вредного тепла, вероятно, сначала активируются А-дельта-ноцицепторы типа II.[3] [4] [5]
Подобно А-дельта-ноцицепторам, большинство немиелинизированных С-волокон являются полимодальными и, таким образом, реагируют как на механические, так и на термические раздражители. Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Молчащие ноцицепторы также попадают в этот класс ноцицепторов. Эти афференты более чувствительно реагируют на химические стимулы (например, капсаицин и гистамин), но механически не реагируют, если им не предшествует повреждение ткани.
Разработка
Из-за явных ограничений прямого измерения боли у плода, выяснение временной шкалы развития восприятия боли зависит от вторичных измерений. Во время внутриутробного развития ноцицептивные процессы (сенсорные рецепторы и синапсы спинного мозга) развиваются раньше, чем таламокортикальные пути, необходимые для сознательного восприятия боли. Свободные нервные окончания начинают развиваться примерно на седьмой неделе беременности, в период, когда ламинарная структура таламуса или коры еще не созрела. Гистологические исследования плодов человека показывают, что таламические проекции в корковую пластинку обычно развиваются в возрасте от 23 до 30 недель беременности [6]. Типичные реакции гормонального стресса на боль наблюдаются у плодов около 18 недель беременности, в то время как гемодинамические реакции головного мозга и поведенческие реакции на ноцицептивные стимулы совпадают к 26 неделе беременности. Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Эти наблюдения подтверждают общую оценку того, что боль возникает примерно на 26 неделе беременности.[7][8]
Вовлеченные системы органов
Хотя в этой статье отмечается, что ноцицепторы присутствуют во внутренних органах, коже, суставах, костях и мышцах, важным соображением является то, что ноцицепторы не обнаружены в ЦНС; это объяснение того, почему краниотомия в сознании возможна и безболезненна для пациента.
Также необходимо понимать, что конкретные сенсорные модальности, ведущие к ноцицепции, различаются в зависимости от типа ткани: экзогенные аллергены)
Болезненные раздражители в суставах обычно возникают в результате механического стресса (например, чрезмерная нагрузка на сустав) и химического воспаления
Во внутренних органах: механическое растяжение, растяжение, а также химические раздражители обычно вызывают ноцицептивные сигналы
В мышцах наиболее распространены тяжелые механические нагрузки (например, тупая сила, чрезмерное растяжение) и химические модальности
Ноцицептивная передача сигнала в мозг вызывает восприятие боли. Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Сложный биопсихосоциальный феномен боли возникает в корковых и подкорковых областях, таких как таламус, миндалевидное тело, гипоталамус, околоводопроводные отделы серого мозга, базальные ганглии и области коры головного мозга. Хотя в типичных ситуациях ноцицепция обычно предшествует восприятию боли, существуют клинические обстоятельства, при которых эти интерфейсы не перекрываются. Ноцицепция может возникать без последующего осознания боли, а боль может присутствовать без измеримого основного вредного стимула. Например, первое может наблюдаться после тяжелой травмы, когда жертвы практически не чувствуют боли, несмотря на обширную травму; последний может наблюдаться у людей, страдающих функциональными болевыми синдромами, которые сообщают о сильной боли без признаков физического повреждения.[9]]
Функция
Нервные механизмы боли и ноцицепции выполняют адаптивную функцию, сводя к минимуму повреждение тканей от окружающей среды. Важно отметить, что существует несколько операционных категорий болевого поведения. Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Отдергивание как простое рефлекторное действие чаще всего связано с острой болью при травме; спинальные рефлексы вызывают эти действия при активации ноцицепторов. Однако более сложное поведение также тесно связано с нервными путями боли. Например, движения рук, вызванные в ожидании аверсивного стимула для глаз, требуют интеграции рефлекторных действий с пространственной, сенсорной и временной информацией более высокого порядка.
Механизм
Под действием многочисленных медиаторов воспаления (как описано ранее в этой статье) в месте повреждения выделяется «воспалительный суп», стимулирующий активацию ноцицепторов. Афферентные ноцицепторы с периферии передают повреждающие сигналы к проекционным нейронам, расположенным в дорсальных рогах спинного мозга. Клетки в заднем роге располагаются слоями физиологически обособленных отделов, называемых пластинками. В зависимости от типа синапса в пластинках, образованных ноцицептивным волокном, подмножество этих проекционных нейронов будет передавать информацию в соматосенсорную кору через таламус, которая предоставляет информацию о пространственных характеристиках и интенсивности болевого стимула. 4][5]
4][5]
Учитывая различие между болью и ноцицепцией, важно также учитывать различные нервные пути, участвующие в аффективном, корковом компоненте переживания боли. Этому процессу способствуют проекционные нейроны, которые задействуют поясную и островковую кору через связи с парабрахиальным ядром ствола мозга, а также с миндалевидным телом, и считается восходящим путем, который инициирует сознательное восприятие боли. Восходящая информация может также побудить нейроны рострального вентрального продолговатого мозга и периакведуктального серого среднего мозга задействовать нисходящие системы обратной связи, которые регулируют выход из спинного мозга и, таким образом, модулируют болевые ощущения. Это происходит за счет высвобождения гормонов и химических веществ (например, эндогенных опиоидов, ГАМК, глицина), которые могут обладать обезболивающими свойствами для ограничения болевых ощущений. И наоборот, такие вещества, как вещество Р, глутамат и аспартат, могут воздействовать на спинной мозг, вызывая восприятие боли. [3][4][5]
[3][4][5]
Локальная стимуляция А-дельта и А-бета также служит для модулирования передачи болевой информации посредством возбуждения интернейронов. Эти интернейроны оказывают тормозящее влияние на нейроны проекции заднего рога, которые передают сигналы в переднебоковую систему. Это основной механизм растирания раны с целью притупить острую боль.[12]
В основе восприятия боли лежит ряд психологических процессов. Ориентация внимания на болезненное ощущение и его источник может способствовать усилению болезненного переживания. Например, обнаружено, что пациенты с соматической озабоченностью и ипохондрией чрезмерно обращают внимание на телесные ощущения, усиливая их в виде боли. Точно так же другие факторы, такие как когнитивная оценка значения ощущения, эмоциональные и психофизиологические реакции, ожидания и навыки преодоления, могут служить обратной связью, влияющей на восприятие боли.[13]
Связанные исследования
Сложная, многогранная и субъективная природа боли делает ее довольно сложной для клинического измерения. За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
За последние несколько десятилетий был разработан ряд проверенных мер, призванных помочь в исследованиях механизмов боли и результатов измерения. При острой боли, имеющей отношение к лечению хирургических процедур или острого психического заболевания, для оценки интенсивности боли чаще всего используются визуальная аналоговая шкала (ВАШ) и числовая оценочная шкала (ЧШР). Для хронической боли были разработаны многомерные инструменты, такие как Опросник боли Макгилла (MPQ) и Краткий опросник боли (BPI).
В настоящее время инструменты, упомянутые выше, используются в основном в исследовательских целях, хотя предлагаются новые экспериментальные измерения боли, например, нейровизуализация в качестве объективного измерения.[17]
Клиническое значение
Характеристики боли у пациента указывают на ее патогенез. Таким образом, краткое объяснение классов боли полезно с клинической точки зрения, чтобы помочь в управлении болью как симптомом и возможной диагностикой основного состояния.
Острая боль : В месте местного повреждения ткани активация ноцицептивных преобразователей способствует возникновению этой формы боли. Местная травматическая среда может дополнительно изменить характеристики ноцицепторов, центральных связей и вегетативной нервной системы.[1][2][3][4]
Хроническая боль : Постоянная боль часто связана с состояниями (например, сахарным диабетом, артритом и ростом опухоли), которые усиливают хроническое воспаление тканей или изменение свойств периферических нервов (нейропатические). Учитывая непрекращающийся характер хронической боли, ожидается, что внешние факторы, такие как стресс, эмоции и окружающая среда, могут оказывать суммарный эффект на поврежденную ткань, усиливая интенсивность и постоянство боли. [1-4]
Соматическая боль : Эта форма боли может быть острой или хронической и активируется ноцицепторами в кожных или глубоких тканях. В случае кожной соматической боли, например, при порезе кожи, она описывается как острая или жгучая и хорошо локализована.
 В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]Висцеральная боль : Эта боль возникает в основном во внутренних органах и глубоких соматических структурах (например, боль в желудочно-кишечном тракте). Висцеральная боль, не имеющая четкой локализации, переносится по С-волокнам из глубоких структур в спинной мозг.[16]
Нейропатическая : Эта постоянная боль часто является следствием повреждения этих нервных волокон, что приводит к усилению спонтанного возбуждения или изменению их проводимости или нейромедиаторных свойств.[17]
Аллодиния : Боль, вызванная обычно безвредным раздражителем, называется аллодинией. Хотя механизм до конца не ясен, считается, что он потенциально возникает из-за 1) сенсибилизации кожи, приводящей к снижению порога молчащих ноцицепторов, или 2) повреждения периферических нейронов, вызывающего структурные изменения, приводящие к перенаправлению сенсорно-чувствительных волокон и формированию синапсов.
 в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]Гипералгезия : Возникает, когда вредные раздражители вызывают преувеличенную болевую реакцию. Механизмы аналогичны предложенным в случае аллодинии, когда пациенты демонстрируют усиление боли или гипералгезию, а также длительное сохранение боли.[3]
Отраженная боль : При восприятии боли в месте, отличном от места болевого раздражителя, это называется отраженной болью. Классический пример отраженной боли включает боль в шее, плечах и спине после инфаркта миокарда. В настоящее время нет единого мнения относительно истинных механизмов отраженной боли, и существует несколько теорий. Отраженная боль может быть висцеральной или соматической, причем первая описывает боль от органа, а вторая описывает боль от глубоких тканей, таких как мышцы или суставы. В Рухе 1961 конвергентно-проекционная теория, где афферентные висцеральные сенсорные болевые волокна и соматические волокна входят в одни и те же спинномозговые ганглии задних корешков спинного мозга, заставляя ЦНС ошибочно интерпретировать боль как возникающую где-то на стенке тела, а не во внутренних органах.
 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Контрольные вопросы
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Раффаэли В., Арнаудо Э. Боль как болезнь: обзор. Джей Боль Рез. 2017;10:2003-2008. [Бесплатная статья PMC: PMC5573040] [PubMed: 28860855]
- 2.
Loeser JD, Melzack R. Боль: обзор. Ланцет. 1999 мая 08; 353 (9164): 1607-9. [PubMed: 10334273]
- 3.
Basbaum AI, Bautista DM, Scherrer G, Julius D.
 Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]- 4.
Венкатачалам К., Монтелл К. Каналы ГТО. Анну Рев Биохим. 2007;76:387-417. [Бесплатная статья PMC: PMC4196875] [PubMed: 17579562]
- 5.
Бессон Дж. М. Нейробиология боли. Ланцет. 1999 мая 08;353(9164):1610-5. [PubMed: 10334274]
- 6.
Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Боль у плода: систематический междисциплинарный обзор доказательств. ДЖАМА. 2005 г., 24 августа; 294(8):947-54. [PubMed: 16118385]
- 7.
Гловер В., Фиск Н.М. Боль плода: последствия для исследований и практики. Br J Obstet Gynaecol. 1999 г., сен; 106 (9): 881-6. [PubMed: 10492096]
- 8.
Anand KJ, Hickey PR. Боль и ее последствия у новорожденного и плода человека. N Engl J Med. 1987 19 ноября; 317(21):1321-9. [PubMed: 3317037]
- 9.

Гарланд ЭЛ. Обработка боли в нервной системе человека: выборочный обзор ноцицептивных и биоповеденческих путей. Прим Уход. 2012 сен; 39 (3): 561-71. [Бесплатная статья PMC: PMC3438523] [PubMed: 22958566]
- 10.
Моррисон И., Перини И., Данхэм Дж. Аспекты и механизмы адаптивного болевого поведения: прогнозирующая регуляция и действие. Передний шум нейронов. 2013 28 ноября; 7:755. [Бесплатная статья PMC: PMC3842910] [PubMed: 24348358]
- 11.
Кук Д.Ф., Грациано М.С. Оборонительные движения, вызываемые струей воздуха у обезьян. J Нейрофизиол. 2003 ноябрь; 90 (5): 3317-29. [PubMed: 12801896]
- 12.
Braz J, Solorzano C, Wang X, Basbaum AI. Передача сообщений о боли и зуде: современный взгляд на цепи спинного мозга, которые генерируют контроль ворот. Нейрон. 2014 07 мая; 82 (3): 522-36. [Бесплатная статья PMC: PMC4492533] [PubMed: 24811377]
- 13.
Хансен Г.Р., Стрельцер Дж.
 Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]
Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]- 14.
Янгер Дж., МакКью Р., Макки С. Исходы боли: краткий обзор инструментов и методов. Curr Pain Headache Rep. 2009 Feb;13(1):39-43. [Бесплатная статья PMC: PMC28] [PubMed: 170]
- 15.
Farrar JT, Berlin JA, Strom BL. Клинически важные изменения в показателях исхода острой боли: проверочное исследование. J Управление симптомами боли. 2003 г., май; 25(5):406-11. [В паблике: 12727037]
- 16.
Сикандар С., Дикенсон А.Х. Висцеральная боль: входы и выходы, взлеты и падения. Curr Opin Support Palliat Care. 2012 март;6(1):17-26. [Бесплатная статья PMC: PMC3272481] [PubMed: 22246042]
- 17.
Кэмпбелл Дж. Н., Мейер Р.А. Механизмы нейропатической боли. Нейрон. 2006 05 октября; 52 (1): 77-92. [Бесплатная статья PMC: PMC1810425] [PubMed: 17015228]
- 18.
Арендт-Нильсен Л.


 В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]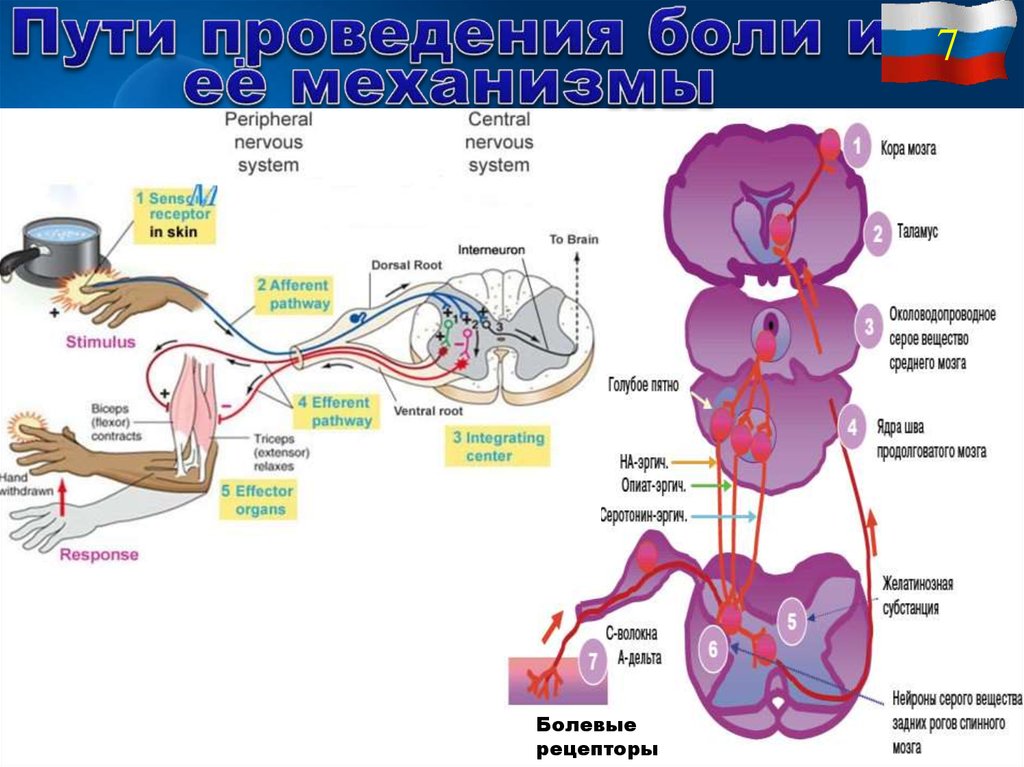 в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]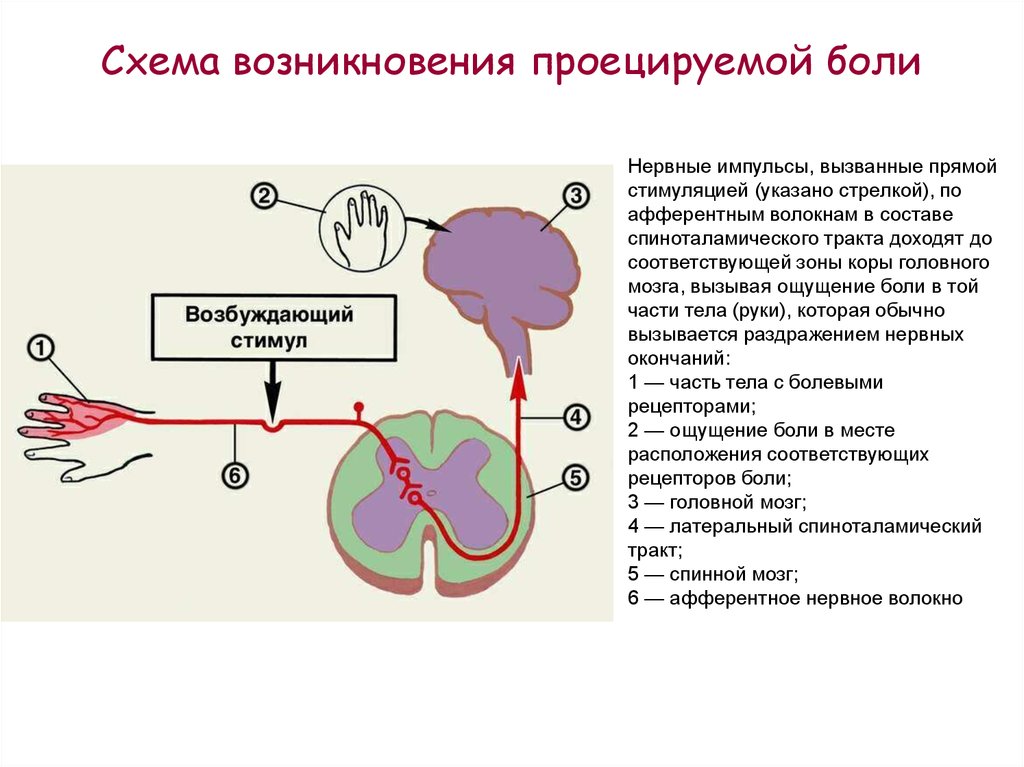 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22] Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
Клеточные и молекулярные механизмы боли. Клетка. 2009 16 октября; 139 (2): 267-84. [Бесплатная статья PMC: PMC2852643] [PubMed: 19837031]
 Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386]
Психология боли. Emerg Med Clin North Am. 2005 май; 23(2):339-48. [PubMed: 15829386] , Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083]
, Свенссон П. Отраженная мышечная боль: основные и клинические данные. Клин Джей Пейн. 2001 март; 17(1):11-9. [PubMed: 11289083] В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ]
В случае соматической боли, возникающей из глубоких тканей, например, в суставах, сухожилиях и костях, она описывается как более пульсирующая или ноющая и менее локализованная.[1][2][3][4][16]. ] в областях спинного мозга, которые обычно получают болевые ощущения.[3]
в областях спинного мозга, которые обычно получают болевые ощущения.[3]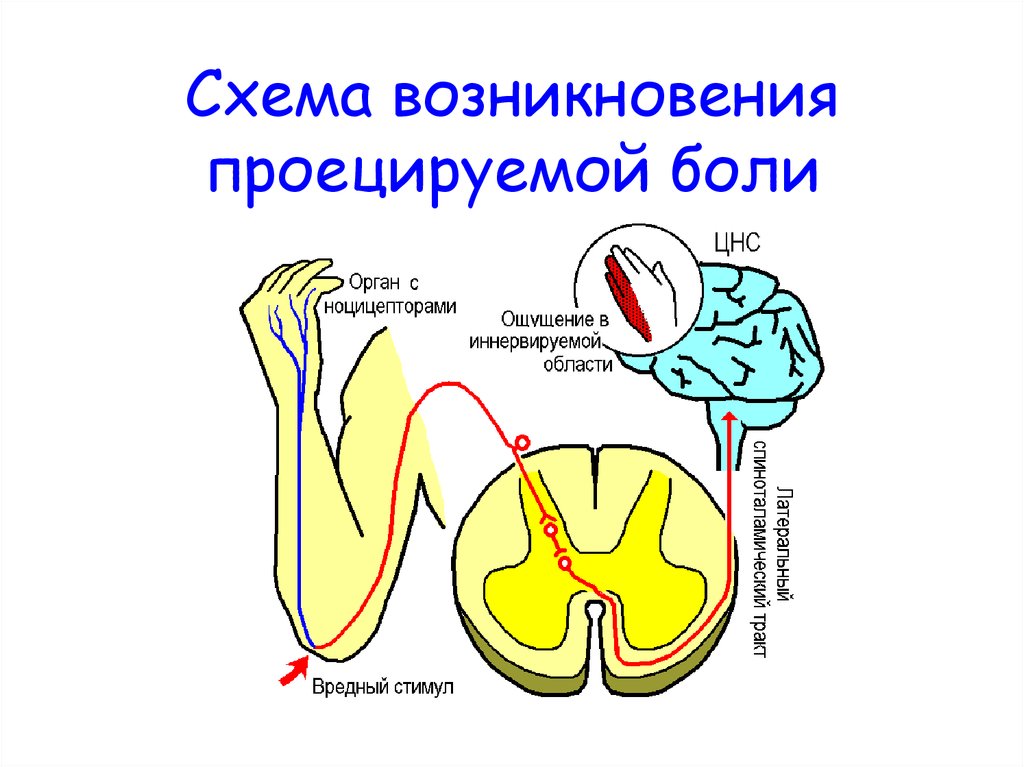 Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]
Соматическая рефлекторная боль возникает, когда структуры позвоночника, такие как диски или суставы, получают болезненный стимул, и впоследствии боль интерпретируется как локализованная в глубоких тканях, чаще всего в нижних конечностях. Предполагается, что это происходит за счет нейронов, которые иннервируют эти соматические ткани, сходящихся с ноцицептивными афферентными нейронами на тех же нейронах второго порядка в спинном мозге.][20][21][22]