ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ? | Сервье Россия
Клинические исследования проводятся с участием людей и относятся к серии научных исследований, которые необходимо выполнить для разработки новых лекарств.
Они подлежат строгому регулированию и являются важнейшим этапом в процессе регистрации лекарственного средства и определении методов его оптимального применения для обеспечения терапевтического эффекта у пациентов.
Клинические исследования могут длиться несколько лет и должны быть организованы в строгом соответствии с протоколом исследования, который гарантирует безопасность участников.
Клинические исследования как необходимость научной точности
Под клиническими исследованиями понимаются все научные исследования с участием людей, которые проводятся с целью оценки эффективности и безопасности нового лекарственного препарата / изделия медицинского назначения или расширения показаний к применению существующего на рынке лекарственного препарата / изделия медицинского назначения.
Клинические исследования используются для оценки безопасности и эффективности новых методов лечения, и являются обязательным условием для вывода лекарственного препарата на рынок. Они требуют применения строгого научного подхода, чтобы гарантировать как терапевтический эффект, так и безопасность участников. Помимо терапевтического интереса, клинические исследования также вносят вклад в развитие медицины и биологии.2
Четыре фазы клинических испытаний
До начала клинических исследований с участием человека в обязательном порядке проводятся доклинические исследования, которые включают в себя тестирование изучаемой молекулы на животных.
Разработка нового лекарственного препарата обычно состоит из четырех последовательных фаз клинических исследований, целью которых является изучение действия препарата в организме человека и оценка его эффективности.
Фаза I: соответствует первому применению исследуемого препарата у человека и может длиться несколько месяцев.Молекула обычно тестируется в группе от 20 до 100 человек (здоровых добровольцев) для оценки переносимости и фармакокинетики (изучение того, что происходит с лекарством в организме). На этом этапе также определяется самая высокая и безопасная доза для применения у пациентов.
Фаза II: оценка эффективности препарата в группе от нескольких десятков до нескольких сотен пациентов. На этом этапе проверяется, активна ли молекула в лечении целевого заболевания, определяется оптимальная доза и регистрируются побочные эффекты.
Фаза III: часто упоминается как «ключевое исследование». Молекула тестируется на большей группе пациентов, состав которой может достигать нескольких тысяч человек.

Фаза IV: проводится после получения регистрационного удостоверения. На этом этапе изучается переносимость и эффективность лекарства в долгосрочной перспективе. Постмаркетинговый мониторинг важен, потому что даже после многочисленных исследований определенные эффекты препарата могут быть не полностью изучены.4
На данный момент только одна молекула из десяти проходит все вышеописанные стадии3. Однако процесс клинической разработки лекарств для лечения онкологических или редких заболеваний может быть ускорен путем уменьшения количества участвующих в исследованиях пациентов и объединения определенных фаз.
Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
Клинические исследования обычно занимают несколько лет, а иногда могут длиться до десяти лет, и требуют ежедневных усилий всех вовлеченных в них сторон, направленных на поиск новых, жизненно важных для пациентов методов лечения.
Клинические исследования чаще всего инициируются и финансируются фармацевтическими компаниями. Все клинические исследования проводятся квалифицированными специалистами в соответствующей области медицины, которых называют исследователями. Они несут ответственность за надлежащее проведение исследования, за включение пациентов в исследование и за их безопасность. Что касается участников, то они всегда привлекаются на добровольной основе.
Все клинические исследования проводятся квалифицированными специалистами в соответствующей области медицины, которых называют исследователями. Они несут ответственность за надлежащее проведение исследования, за включение пациентов в исследование и за их безопасность. Что касается участников, то они всегда привлекаются на добровольной основе.
Обеспечение прозрачности результатов в строгих правовых рамках
Чтобы начать клиническое исследование, требуются различные разрешения от компетентных органов каждой страны. Сроки получения разрешений варьируются в различных странах: от 30 до более чем 200 дней. В Российской Федерации этот срок составляет около 90-100 дней.
Каждый участник должен получить всю информацию об исследовании в письменной форме (включая все преимущества и риски, связанные с исследованием) и должен дать свое согласие, подписав форму информированного согласия, прежде чем он/она сможет начать участие в исследовании. Этические аспекты медицинских исследований во всем мире регулируются Нюрнбергским кодексом и Хельсинкской декларацией 1964 года, а также их последующими редакциями.
Публикация результатов клинических исследований представляет большой интерес для медицинского и научного сообществ, поскольку помогает обеспечить прозрачность результатов, независимо от их характера. Хельсинская декларация гласит: «Каждое исследование с участием людей в качестве субъектов исследования должно быть зарегистрировано в публично доступной базе данных прежде, чем в него будет включен первый субъект».
ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Ускорение исследований и получения регистрационного удостоверения.Столкнувшись с пандемией COVID-19, многие фармацевтические компании ведут настоящую «гонку вакцин» и стремятся ускорить исследования, чтобы в срочном порядке предоставить эффективную вакцину, доступную для всех.
- Повышенная потребность в прозрачности:в контексте, когда широкая общественность выражает недоверие к фармацевтической промышленности, заинтересованные стороны мобилизуются для большей прозрачности.
 Поскольку в Европе публикуется только половина результатов исследований 5, было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
Поскольку в Европе публикуется только половина результатов исследований 5, было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
- Цифровизация клинических испытаний. Ускорение перехода к цифровому формату – важная задача для всех заинтересованных сторон в сфере здравоохранения. Использование цифровых технологий в клинических исследованиях может быть целесообразным, поскольку это облегчит участие пациентов, живущих далеко от исследовательских центров, повысит их приверженность лечению (например, посредством уведомлений) и обеспечит доступ к данным в режиме реального времени.
- Пациент в центре исследований: . Они могут лучше всех рассказать о своем заболевании / состоянии, его течении и эффективности лечения, которое они получают. Вовлечение пациентов на как можно более раннем этапе позволяет ускорить клинические исследования и разработать методы лечения, которые наилучшим образом соответствует их потребностям.

А как в Сервье?
Клинические исследования Группы проводятся командами экспертов с применением высоких и строгих стандартов. Надлежащее проведение исследований требует слаженной работы команд, ответственных за международную координацию, и локальных команд в 18 странах, что позволяет организовывать клинические исследования во всем мире. Таким образом, глобализация процесса разработки лекарственных препаратов в Сервье играет фундаментальную роль в формировании научного имиджа компании и позволяет разрабатывать инновационные лекарства, соответствующие различным потребностям пациентов.
Чтобы создавать лекарственные препараты, которые наилучшим образом отвечали бы потребностям пациентов, Сервье стремится привлекать их к разработке лекарственных препаратов напрямую или через ассоциации пациентов: сюда включают обсуждение протоколов клинических исследований, разработку форм информированного согласия и брошюр для повышения осведомленности пациентов, получение отзывов пациентов после исследования и предоставление им адаптированных резюме исследования.
Цифровые технологии и данные повышают гибкость, эффективность и продуктивность, ускоряя процесс разработки лекарственных средств, итеративный алгоритм идентификации молекул и проведение клинических исследований, а также помогают лучше понимать пациентов. Для внедрения цифровых технологий в клинические исследования используется программа SCORE: она обеспечивает удаленную связь между пациентами и медицинскими и научными специалистами, позволяя им получать доступ к данным исследований в режиме реального времени, тем самым упрощая принятие решений. Платформа FEDERATES, которая в настоящее время находится в стадии разработки, повысит качество передачи информации и данных в режиме реального времени и ускорит проведение исследования на разных этапах.
1https://clinicaltrials.servier.com/about-clinical-trials/
2https://www.inserm.fr/recherche-inserm/recherche-clinique
3https://www.leem. org/recherche-et-developpement
org/recherche-et-developpement
4https://www.clinicaltrials.gov/ct2/help/glossary/phase
5Goldacre Ben, DeVito Nicholas J, Heneghan Carl, Irving Francis, Bacon Seb, Fleminger Jessica et al. Compliance with requirement to report results on the EU Clinical Trials Register: cohort study and web resource BMJ 2018; 362 :k3218
Клиническая диагностика
Клиническая диагностика представляет собой раздел медицины, который изучает содержание, методы и последовательный ход определения болезней или особых физиологических состояний. В узком смысле под данным понятием подразумевается процесс распознавания заболевания, оценки индивидуальных биологических особенностей пациента, который включает целенаправленное обследование организма, истолкование полученных результатов и их обобщение в виде установленного диагноза. Медицинский центр HOMO’89 проводит клиническую диагностику с использованием надежных современных методов.
Составляющие диагностики
Как раздел медицины клиническая диагностика включает следующие основные разделы.
Семиотика. Семиотика представляет собой изучение признаков болезни и их значения в диагностике. Выделяются специфические симптомы, свойственные для определенных заболеваний (например, кашель при заболеваниях органов дыхания), неспецифические, характерные для заболеваний различного типа (потеря веса, повышение температуры и др.), и патогномонические, возникающие при одном конкретном заболевании (диастолический рокочущий шум в верхней области сердца при митральной недостаточности). Обычно болезни проявляются целым рядом признаков. Совокупность симптомов с общей патогенетической основой называется синдромом.
Методы обследования пациента. Обследование пациента осуществляется для выявления его индивидуальных особенностей, установления диагноза, обоснования необходимого лечения и определения прогноза. Объем диагностических процедур зависит от их целей (диспансерное наблюдение, проверка эффективности назначенной терапии и др. ) и от типа заболевания, по которому они проводятся. Выделяются две группы методов обследования пациента: клинические, которые осуществляются непосредственно медицинским специалистом, и дополнительные (параклинические), выполняемые по назначению доктора с применением узкопрофильных исследований (при гинекологических, урологических, глазных, стоматологических и других болезнях).
) и от типа заболевания, по которому они проводятся. Выделяются две группы методов обследования пациента: клинические, которые осуществляются непосредственно медицинским специалистом, и дополнительные (параклинические), выполняемые по назначению доктора с применением узкопрофильных исследований (при гинекологических, урологических, глазных, стоматологических и других болезнях).
Установление диагноза
Диагноз представляет собой заключение о сущности заболевания и состоянии пациента, выраженное в принятой медицинской терминологии. Его установление осуществляется на основе данных клинических и дополнительных обследований пациента и предполагает переход от абстрактного теоретического предположения о наличии той или иной болезни к конкретному заключению (для конкретного больного) с учетом совокупности анатомических, патогенетических, этиологических, социальных и симптоматических фактов, которые имеют место в данном случае.
Методы диагностики
В медицинском центре HOMO’89 используются следующие основные методы диагностики.
Сбор анамнеза
Анамнез представляет собой совокупность сведений о клиенте и истории его болезни, которые получены путем целенаправленного расспроса пациента или знающих его лиц. Различаются два направления в сборе анамнеза.
- Анамнез болезни. Под анамнезом болезни подразумевается сбор информации о начале и особенностях течения болезни. При получении данных выясняется время появления жалоб, изучаются последующие симптомы, устанавливаются вероятные причины возникновения недомогания, уточняются способы предпринятого (врачом и самостоятельно пациентом) лечения. Короткий анамнез (сроком от нескольких часов до пары недель) свидетельствует об остром патологическом процессе, продолжительный (периодом в недели, месяцы или года) говорит о наличии хронического заболевания.
- Анамнез жизни. Под анамнезом жизни подразумевается сбор информации о психическом, социальном и физическом статусе пациента. К составным элементам данного вида относится психическое и физиологическое развитие в детские и юношеские годы, условия жизни, качество питания, место работы, стаж трудовой деятельности, вредные привычки, перенесенные заболевания, травмы или операции, склонность к аллергии, наследственность и др.
 Анамнез у детей (до совершеннолетнего возраста) осуществляется на основе опроса родителей или близких родственников. При сборе информации о человеке, страдающем психическим расстройством, необходимо отличать субъективный анамнез (представление самого пациента о его самочувствии) от объективного (реального положения дел, которое выясняется у знающих его лиц).
Анамнез у детей (до совершеннолетнего возраста) осуществляется на основе опроса родителей или близких родственников. При сборе информации о человеке, страдающем психическим расстройством, необходимо отличать субъективный анамнез (представление самого пациента о его самочувствии) от объективного (реального положения дел, которое выясняется у знающих его лиц).
Осмотр пациента
Важный этап успешной диагностики. Различают общее и специальное визуальное исследование больного. Общий осмотр проводится всегда, не зависимо от жалоб пациента. Процедура осуществляется в изолированной, теплой комнате с хорошим освещением. Врачом оценивается внешний вид пациента, его положение тела, осанка, выражение лица, цвет кожи, вес тела, рост, походка. Затем осматривается голова, лицо, шея, туловище, конечности, определяется состояние лимфатических узлов, подкожных жировых тканей, костно-мышечной системы и др. Специальное исследование больного проводится узкими специалистами (офтальмологом, гинекологом и др. ) с применением медицинских инструментов. Внимательно и грамотно проведенный осмотр пациента позволяет значительно сократить круг возможных заболеваний.
) с применением медицинских инструментов. Внимательно и грамотно проведенный осмотр пациента позволяет значительно сократить круг возможных заболеваний.
Пальпация
Пальпация – метод клинического обследования пациента, основанный на мануальном (осязательном) обследовании. С его помощью врач определяет место расположения внутренних органов (при нормальной локации или при их смещении), характер их движения, эластичность и консистенцию тканей организма, локальную температуру, область травмы, болезненные участки, наличие патологии в различных частях тела и др. Выделяют поверхностную и глубокую пальпацию. При комплексном осмотре врачом осуществляется последовательное обследование покровов кожи, мышечной массы, костей, областей с лимфатическими узлами. Для исследования внутренних органов применяется бимануальная пальпация почек, влагалищная пальпация яичников и матки, трансректальная пальпация малого таза и др.
Перкуссия
Перкуссия – метод клинического обследования пациента, основанный на простукивании различных областей его тела с последующим истолкованием изменения получаемого звука. Данная процедура проводится с целью определения уплотнения в тканях (глухой звук), эластичности (барабанный звук), наличия воздушности и скрытых полостей (звонкий звук). При простукивании различных областей тела пациента возникают колебания тканей организма. Данная вибрация воспринимается ухом доктора в форме звуков с определенной высотой, которая пропорциональна плотности обследуемой зоны. При перкуссии сердца (плотной ткани) возникают высокие звуки, а при простукивании легких (ткани с низкой плотностью) – низкие. Барабанный звук возникает при обследовании больших полостей, которые заполнены воздухом (например, желудка или плеврального пространства при пневмотораксе).
Данная процедура проводится с целью определения уплотнения в тканях (глухой звук), эластичности (барабанный звук), наличия воздушности и скрытых полостей (звонкий звук). При простукивании различных областей тела пациента возникают колебания тканей организма. Данная вибрация воспринимается ухом доктора в форме звуков с определенной высотой, которая пропорциональна плотности обследуемой зоны. При перкуссии сердца (плотной ткани) возникают высокие звуки, а при простукивании легких (ткани с низкой плотностью) – низкие. Барабанный звук возникает при обследовании больших полостей, которые заполнены воздухом (например, желудка или плеврального пространства при пневмотораксе).
Аускультация
Аускультация – метод клинического обследования пациента, основанный на выслушивании и интерпретации звуков, которые образовываются в процессе работы внутренних органов. Она может быть прямой (когда доктор прикладывает ухо к определенному участку тела пациента) и непрямой (с применением специального инструмента – стетоскопа). В норме функционирование организма человека сопровождается определенными характерными звуками. При патологических процессах во внутренних органах звуки, сопровождающие их работу, изменяются. Например, при поражениях бронхов и легких возникают дыхательные хрипы, при проблемах с сердечными клапанами улавливаются различные шумы, по типу которых можно предположить конкретное заболевание.
В норме функционирование организма человека сопровождается определенными характерными звуками. При патологических процессах во внутренних органах звуки, сопровождающие их работу, изменяются. Например, при поражениях бронхов и легких возникают дыхательные хрипы, при проблемах с сердечными клапанами улавливаются различные шумы, по типу которых можно предположить конкретное заболевание.
Значение комплексного исследования
Комплексная клиническая диагностика пациента является обязательным инструментом для установления правильного и точного диагноза, который полностью определяет ход необходимого лечения и назначение рекомендаций для конкретного больного. Если медицинский работник сомневается в постановке достоверного заключения, то в этом случае осуществляется консилиум группы ведущих докторов узкой специализации. Описанные выше методы диагностики относятся к общедоступным, не требующим специального оборудования, что особенно важно в ситуациях, когда дополнительные лабораторные и аппаратные методы обследования невозможны. Владение техникой комплексного обследования пациента и умение точно интерпретировать полученные результаты позволяют нашим специалистам верно устанавливать диагноз и грамотно назначать необходимое лечение.
Владение техникой комплексного обследования пациента и умение точно интерпретировать полученные результаты позволяют нашим специалистам верно устанавливать диагноз и грамотно назначать необходимое лечение.
Записаться на клиническую диагностику
Что такое клинические испытания и исследования?
На этой странице:
Клинические исследования — это медицинские исследования с участием людей. Есть два типа, обсервационные исследования и клинические испытания.
Наблюдательные исследования наблюдают за людьми в обычных условиях. Исследователи собирают информацию, группируют добровольцев по широким характеристикам и сравнивают изменения с течением времени. Например, исследователи могут собирать данные с помощью медицинских осмотров, тестов или опросников о группе пожилых людей с течением времени, чтобы узнать больше о влиянии различных образов жизни на когнитивное здоровье. Эти исследования могут помочь выявить новые возможности для клинических испытаний.
Клинические испытания — это научные исследования, проводимые на людях и направленные на оценку медицинских, хирургических или поведенческих вмешательств. Это основной способ, с помощью которого исследователи выясняют, является ли новое лечение, такое как новое лекарство, диета или медицинское устройство (например, кардиостимулятор), безопасным и эффективным для людей. Часто клинические испытания используются для того, чтобы узнать, является ли новое лечение более эффективным и/или менее опасным побочным эффектом, чем стандартное лечение.
Другие клинические испытания проверяют способы обнаружения болезни на ранней стадии, иногда до появления симптомов. Третьи тестируют способы предотвращения проблем со здоровьем. В рамках клинического испытания также может быть рассмотрен вопрос о том, как улучшить жизнь людей, живущих с опасным для жизни заболеванием или хроническими проблемами со здоровьем. Клинические испытания иногда изучают роль опекунов или групп поддержки.
Клинические испытания иногда изучают роль опекунов или групп поддержки.
Прежде чем Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрит начало клинических испытаний, ученые проводят лабораторные тесты и исследования на животных, чтобы проверить безопасность и эффективность потенциальной терапии. Если эти исследования показывают положительные результаты, FDA дает разрешение на тестирование вмешательства на людях.
Каковы четыре фазы клинических испытаний?
Клинические испытания проходят четыре фазы, чтобы протестировать лечение, найти подходящую дозировку и выявить побочные эффекты. Если после первых трех фаз исследователи обнаруживают, что лекарство или другое вмешательство безопасно и эффективно, FDA одобряет его для клинического использования и продолжает отслеживать его эффекты.
Клинические испытания лекарств обычно описываются на основании их фазы. FDA обычно требует проведения испытаний фазы I, II и III, чтобы определить, может ли лекарство быть одобрено для использования.
- A Испытание фазы I тестирует экспериментальное лечение на небольшой группе практически здоровых людей (от 20 до 80), чтобы оценить его безопасность и побочные эффекты, а также определить правильную дозировку препарата.
- В испытании фазы II участвует больше людей (от 100 до 300). В то время как акцент на этапе I делается на безопасность, акцент на этапе II делается на эффективности. Этот этап направлен на получение предварительных данных о том, действует ли препарат на людей с определенным заболеванием или состоянием. Эти испытания также продолжают изучать безопасность, включая краткосрочные побочные эффекты. Эта фаза может длиться несколько лет.
- Исследование Фаза III собирает дополнительную информацию о безопасности и эффективности, изучая разные группы населения и разные дозировки, используя препарат в сочетании с другими препаратами.
 Количество испытуемых обычно колеблется от нескольких сотен до примерно 3000 человек. Если FDA согласится с положительными результатами испытаний, оно одобрит экспериментальное лекарство или устройство.
Количество испытуемых обычно колеблется от нескольких сотен до примерно 3000 человек. Если FDA согласится с положительными результатами испытаний, оно одобрит экспериментальное лекарство или устройство. - Испытание фазы IV для лекарств или устройств проводится после того, как FDA одобрит их использование. Эффективность и безопасность устройства или лекарственного средства контролируются на больших и разнообразных популяциях. Иногда побочные эффекты препарата могут не проявляться до тех пор, пока больше людей не примут его в течение более длительного периода времени.
История мистера Джексона
Мистеру Джексону 73 года, и он только что узнал, что у него болезнь Альцгеймера. Он беспокоится о том, как это повлияет на его повседневную жизнь. Не забудет ли он принять лекарство? Забудет ли он свои любимые воспоминания, такие как рождение детей или участие в Марше на Вашингтон с Мартином Лютером Кингом-младшим? Когда г-н Джексон говорил со своим врачом о своих опасениях, врач рассказал ему о клинических испытаниях, в ходе которых проверяется возможное новое лечение болезни Альцгеймера.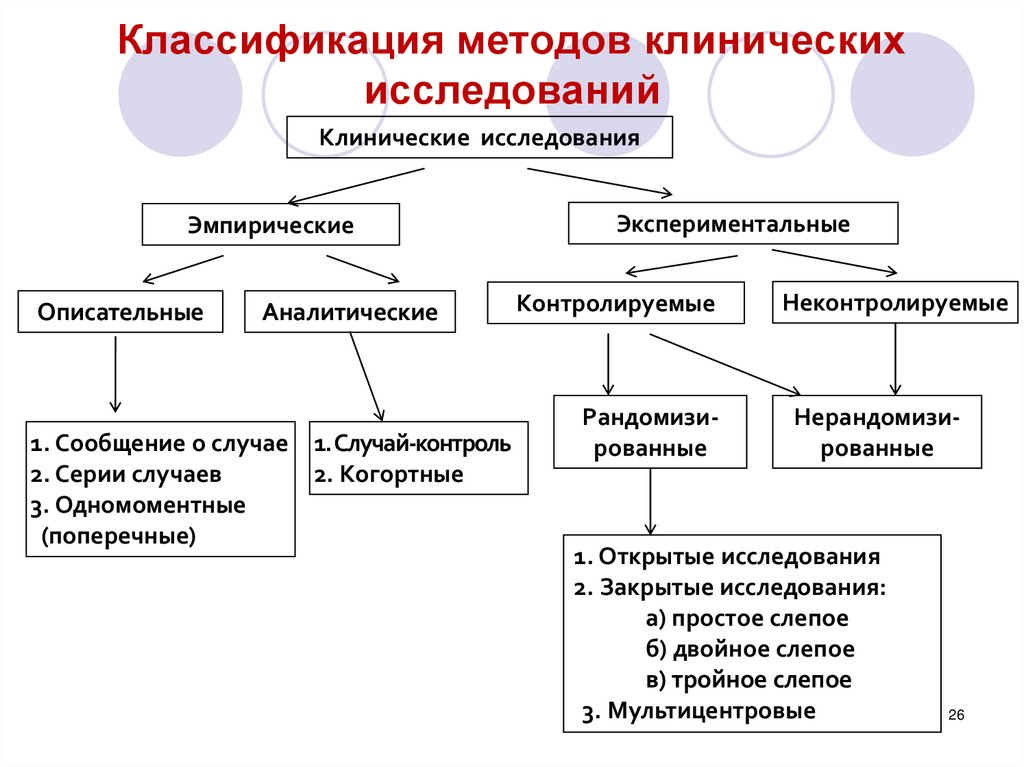 Но мистер Джексон не уверен в этих клинических испытаниях. Он не хочет чувствовать себя лабораторной крысой или рисковать лечением, которое может не сработать или ухудшить его самочувствие. Д-р Мур объяснила, что участие в клинических испытаниях сопряжено как с риском, так и с выгодой, и поговорила с г-ном Джексоном об этих исследованиях — что это такое, как они работают и почему для них нужны добровольцы. Эта информация помогла г-ну Джексону лучше относиться к клиническим испытаниям. Он планирует узнать больше о том, как присоединиться к исследованию.
Но мистер Джексон не уверен в этих клинических испытаниях. Он не хочет чувствовать себя лабораторной крысой или рисковать лечением, которое может не сработать или ухудшить его самочувствие. Д-р Мур объяснила, что участие в клинических испытаниях сопряжено как с риском, так и с выгодой, и поговорила с г-ном Джексоном об этих исследованиях — что это такое, как они работают и почему для них нужны добровольцы. Эта информация помогла г-ну Джексону лучше относиться к клиническим испытаниям. Он планирует узнать больше о том, как присоединиться к исследованию.
Как и г-н Джексон, вы, возможно, слышали о клинических испытаниях, но не знаете, что это такое и хотите ли вы присоединиться к ним. Вот некоторая информация, которая может помочь вам решить, подходит ли вам участие в клиническом испытании.
Зачем участвовать в клинических испытаниях?
Есть много причин, по которым люди решают присоединиться к клиническому испытанию. Некоторые присоединяются к испытаниям, потому что методы лечения, которые они пробовали для решения своих проблем со здоровьем, не сработали. Другие участвуют, потому что их проблема со здоровьем не лечится. Участвуя в клинических испытаниях, участники могут узнать о новых методах лечения до того, как они станут широко доступны. Некоторые исследования предназначены или включают людей, которые здоровы, но хотят помочь найти способы предотвращения болезни, например той, которая может быть распространена в их семье.
Другие участвуют, потому что их проблема со здоровьем не лечится. Участвуя в клинических испытаниях, участники могут узнать о новых методах лечения до того, как они станут широко доступны. Некоторые исследования предназначены или включают людей, которые здоровы, но хотят помочь найти способы предотвращения болезни, например той, которая может быть распространена в их семье.
Многие люди говорят, что участие в клинических испытаниях — это способ играть более активную роль в заботе о собственном здоровье. Другие люди говорят, что хотят помочь исследователям узнать больше об определенных проблемах со здоровьем. Какой бы ни была мотивация, когда вы решаете участвовать в клиническом испытании, вы становитесь партнером в научных открытиях. И ваш вклад может помочь будущим поколениям вести более здоровый образ жизни. Крупные медицинские открытия не могли бы произойти без щедрости участников клинических испытаний — молодых и старых.
Посмотрите видео, в котором участник объясняет, почему он решил присоединиться к исследованию:
youtube.com/embed/5Xut9UipfUc?start=0″ title=»Why I Participate in Alzheimer’s Research — Bob’s Story (Short version)»>Вот что происходит в испытании:
- Исследовательский персонал подробно расскажет об испытании и соберет больше информации о вас.
- После того, как вы получили ответы на все свои вопросы и согласились участвовать, вы подписываете форму информированного согласия.
- Вы проходите проверку, чтобы убедиться, что соответствуете требованиям для участия в пробной версии.
- Если вас приняли в испытательный срок, вы назначаете первое посещение (называемое «базовым» посещением). Во время этого визита исследователи проводят когнитивные и/или физические тесты.
- Вы случайным образом попадаете в экспериментальную или контрольную группу.
- Вы и члены вашей семьи соблюдаете процедуры исследования и сообщаете о любых проблемах или опасениях исследователям.
- Вы можете посещать исследовательский центр в установленное время для новых когнитивных, физических или других оценок и обсуждений с персоналом.
 Во время этих посещений исследовательская группа собирает информацию о последствиях вмешательства, а также о вашей безопасности и благополучии.
Во время этих посещений исследовательская группа собирает информацию о последствиях вмешательства, а также о вашей безопасности и благополучии. - В течение всего исследования вы продолжаете посещать своего обычного врача для получения обычной медицинской помощи.
Где я могу найти клинические испытания?
Есть много способов получить помощь в поиске клинического испытания. Вы можете поговорить со своим врачом или другим поставщиком медицинских услуг. Или вы можете выполнить поиск ClinicalTrials.gov. Вы можете зарегистрироваться в реестре или службе сопоставления, чтобы связать вас с пробными версиями в вашем регионе. Группы поддержки и веб-сайты, посвященные конкретному заболеванию, иногда содержат списки клинических исследований. Кроме того, вы можете увидеть рекламу испытаний в вашем районе в газете или по телевидению.
Узнайте больше об участии в клинических испытаниях и исследованиях по болезни Альцгеймера и связанной с ней деменции.
Какой следующий шаг после того, как я найду клиническое испытание?
Как только вы найдете исследование, к которому, возможно, захотите присоединиться, свяжитесь с координатором клинического исследования или исследования.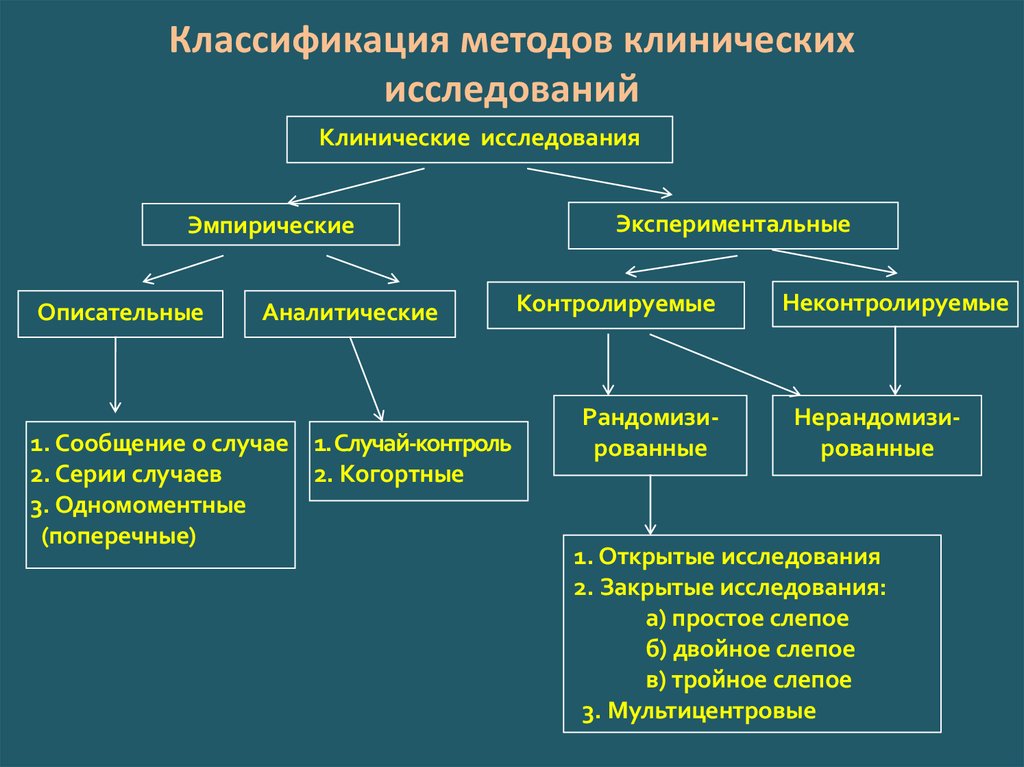 Обычно эту контактную информацию можно найти в описании исследования. Первым шагом является предварительное собеседование, чтобы узнать, соответствуете ли вы требованиям для участия. Эта встреча также дает вам возможность задать свои вопросы об исследовании.
Обычно эту контактную информацию можно найти в описании исследования. Первым шагом является предварительное собеседование, чтобы узнать, соответствуете ли вы требованиям для участия. Эта встреча также дает вам возможность задать свои вопросы об исследовании.
Сообщите своему врачу, что вы думаете об участии в клиническом испытании. Он или она может захотеть поговорить с исследовательской группой о вашем здоровье, чтобы убедиться, что исследование безопасно для вас, и координировать ваше лечение, пока вы участвуете в исследовании.
Как исследователи решают, кто будет участвовать?
После того, как вы дадите согласие, клинический персонал проверит вас, чтобы узнать, соответствуете ли вы критериям для участия в исследовании или что-либо может вас исключить. Скрининг может включать когнитивные и физические тесты.
Критерии включения в исследование могут включать возраст, стадию заболевания, пол, генетический профиль, семейный анамнез, а также наличие у вас партнера по исследованию, который может сопровождать вас во время будущих посещений. Критерии исключения могут включать такие факторы, как определенные состояния здоровья или лекарства, которые могут помешать тестируемому лечению.
Критерии исключения могут включать такие факторы, как определенные состояния здоровья или лекарства, которые могут помешать тестируемому лечению.
Многие добровольцы должны быть проверены, чтобы найти достаточное количество людей для исследования. Как правило, вы можете одновременно участвовать только в одном испытании или исследовании. Разные испытания имеют разные критерии, поэтому исключение из одного испытания не обязательно означает исключение из другого.
Почему в клинических испытаниях важны пожилые и разные участники?
Для клинических испытаний важно, чтобы в них участвовали участники разного возраста, пола, расы и этнической принадлежности. Когда в исследовании участвует группа людей, которые похожи друг на друга, результаты могут не распространяться на всех и не приносить им пользы. Когда клинические испытания включают разных участников, результаты исследования могут иметь гораздо более широкое применение.
Исследователям необходимо участие пожилых людей в их клинических испытаниях, чтобы ученые могли больше узнать о том, как новые лекарства, методы лечения, медицинские устройства, хирургические процедуры или тесты будут работать для пожилых людей. Многие пожилые люди имеют особые медицинские потребности, которые отличаются от потребностей молодых людей. Например, с возрастом организм человека может по-разному реагировать на наркотики. Пожилым людям могут потребоваться разные дозировки (или количества) препарата, чтобы получить правильный результат. Кроме того, некоторые лекарства могут иметь разные побочные эффекты у пожилых людей и у молодых людей. Участие пожилых людей в испытаниях лекарств помогает исследователям получать информацию, необходимую им для разработки правильного лечения для пожилых людей.
Многие пожилые люди имеют особые медицинские потребности, которые отличаются от потребностей молодых людей. Например, с возрастом организм человека может по-разному реагировать на наркотики. Пожилым людям могут потребоваться разные дозировки (или количества) препарата, чтобы получить правильный результат. Кроме того, некоторые лекарства могут иметь разные побочные эффекты у пожилых людей и у молодых людей. Участие пожилых людей в испытаниях лекарств помогает исследователям получать информацию, необходимую им для разработки правильного лечения для пожилых людей.
Исследователи знают, что некоторым пожилым людям может быть трудно участвовать в клинических испытаниях. Например, если у вас много проблем со здоровьем, можете ли вы участвовать в испытании, в котором изучается только одно заболевание? Если вы слабы или у вас есть инвалидность, хватит ли у вас сил участвовать? Если вы больше не водите машину, как вы сможете добраться до учебного центра? Поговорите с координатором клинических испытаний о своих опасениях.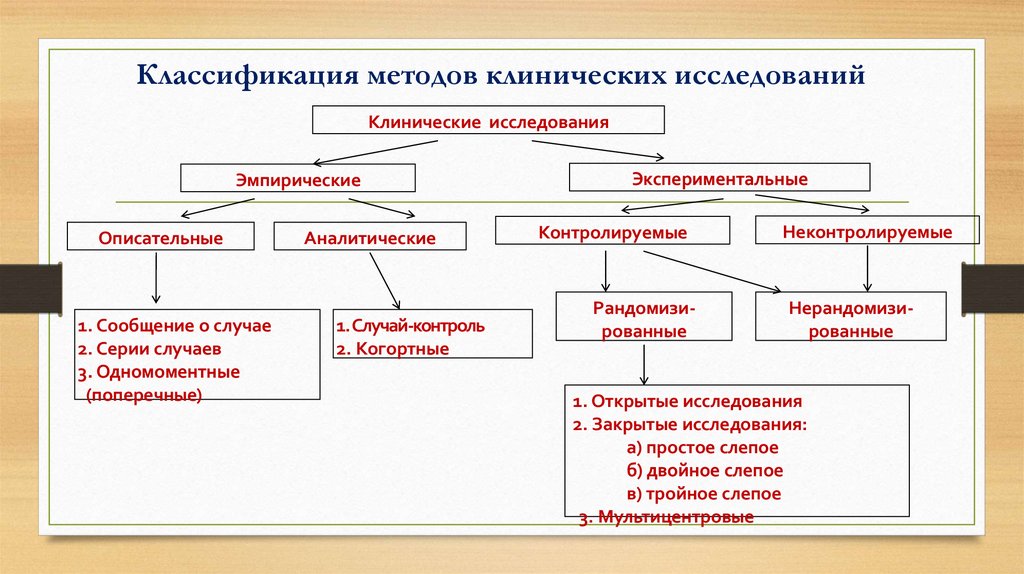 Исследовательская группа, возможно, уже подумала о некоторых препятствиях для пожилых людей и разработала план, как облегчить вам участие в испытании.
Исследовательская группа, возможно, уже подумала о некоторых препятствиях для пожилых людей и разработала план, как облегчить вам участие в испытании.
Узнайте больше о разнообразии в клинических испытаниях.
Загрузите и поделитесь этим советом на китайском языке (PDF, 455K).
Что происходит, когда заканчивается клиническое испытание или исследование?
После завершения клинического испытания или исследования исследователи соберут и проанализируют данные, чтобы увидеть, какие следующие шаги необходимы в результате полученных результатов. Как участник, вам должна быть предоставлена информация до начала исследования о том, как долго оно будет продолжаться, будете ли вы продолжать получать исследуемое лечение после окончания исследования, если это применимо, и как вы будете информироваться о результатах исследования. Обязательно спрашивайте, если у вас есть конкретные вопросы. Узнайте больше о том, что происходит, когда заканчивается клиническое испытание или исследование.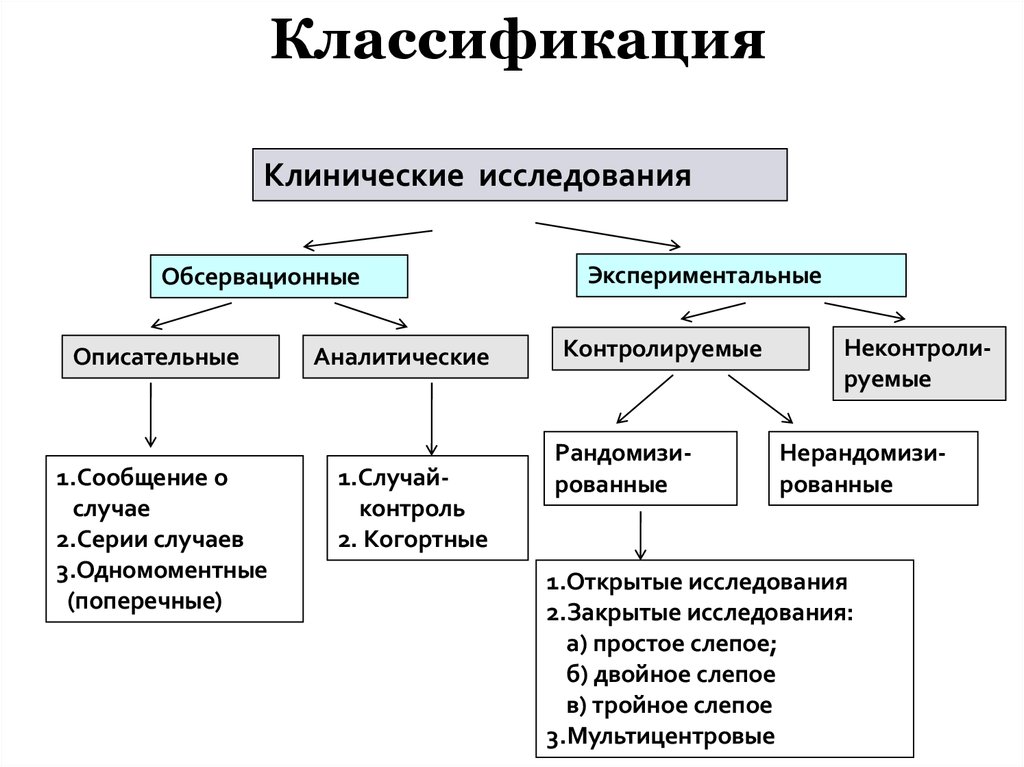
Вопросы, которые следует задать перед участием в клиническом испытании
Ниже приведены некоторые вопросы, которые следует задать исследовательской группе при планировании клинического испытания. Запишите любые вопросы, которые могут у вас возникнуть, и возьмите их с собой на первую встречу с исследовательской группой.
Об исследовании
- Что пытается выяснить это исследование?
- Какое лечение или анализы мне предстоят? Будут ли они больно? Вы дадите мне результаты анализов или анализов?
- Каковы шансы, что я получу экспериментальное лечение или плацебо?
- Каковы возможные риски, побочные эффекты и преимущества исследуемого лечения по сравнению с моим текущим лечением?
- Как я узнаю, работает ли лечение?
- Как долго продлится клиническое испытание?
- Где будет проходить исследование? Придется ли мне оставаться в больнице?
- Предоставите ли вы мне способ добраться до исследовательского центра, если мне это понадобится, например, с помощью услуги попутчиков?
- Могу ли я пройти какую-либо часть исследования у своего лечащего врача? Есть ли более близкое клиническое испытание ко мне?
- Как исследование повлияет на мою повседневную жизнь?
- Какие шаги обеспечивают мою конфиденциальность?
Медицинское обслуживание
- Как вы будете защищать мое здоровье, пока я участвую в исследовании?
- Что произойдет, если моя проблема со здоровьем ухудшится во время исследования?
- Могу ли я принимать обычные лекарства во время испытания?
- Кто будет заботиться обо мне, пока я участвую в исследовании? Смогу ли я обратиться к своему врачу?
- Как вы будете информировать моего врача о моем участии в исследовании?
- Если я откажусь, повлияет ли это на мой обычный уход?
Расходы и возмещение
- Будет ли мне что-нибудь стоить участие в исследовании? Если да, то будут ли мне возмещены такие расходы, как проезд, парковка или проживание?
- Будет ли моя страховка покрывать расходы, не покрываемые исследовательским испытанием, или мне придется платить из своего кармана? Если у меня нет страховки, могу ли я участвовать?
- Нужен ли мне партнер по учебе? Если да, то как долго ему или ей нужно будет участвовать? Будет ли мой партнер по учебе получать компенсацию за его или ее время?
После окончания исследования
- Будете ли вы следить за моим здоровьем после окончания исследования?
- Сообщите мне результаты исследования?
- Кому звонить, если у меня есть дополнительные вопросы?
Для получения дополнительной информации о клинических испытаниях
ClinicalTrials. gov
gov
www.clinicaltrials.gov
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
888-463-6332
[email protected]
www.fda.gov
Эти материалы предоставлены Национальным институтом по проблемам старения NIH (NIA). Ученые NIA и другие эксперты проверяют этот контент, чтобы убедиться, что он точен и актуален.
Контент проверен:
09 апреля 2020 г.
Методология клинических исследований I: Введение в рандомизированные испытания
1. Всемирная организация здравоохранения. Международная платформа реестра клинических испытаний (ICTRP) 2007. [По состоянию на 30 августа]. Доступно по адресу: http://www.who.int/ictrp/en/9.0003
2. Маклеод Р.С. Проблемы хирургических рандомизированных контролируемых исследований. Мир J Surg. 1999; 23:1210–1214. [PubMed] [Google Scholar]
3. Соломон М.Дж., Лаксамана А., Девор Л., Маклеод Р. С. Рандомизированные контролируемые исследования в хирургии. Хирургия. 1994; 115:707–712. [PubMed] [Google Scholar]
С. Рандомизированные контролируемые исследования в хирургии. Хирургия. 1994; 115:707–712. [PubMed] [Google Scholar]
4. Hardin WD, Jr, Stylianos S, Lally KP. Доказательная практика в детской хирургии. J Pediatr Surg. 1999; 34: 908–912. обсуждение 912–913. [PubMed] [Google Scholar]
5. McCulloch P, Taylor I, Sasako M, et al. Рандомизированные исследования в хирургии: проблемы и возможные решения. БМЖ. 2002; 324:1448–1451. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Авраам Н.С., Янг Дж.М., Соломон М.Дж. Систематический обзор причин не включения подходящих пациентов в хирургические рандомизированные контролируемые испытания. Хирургия. 2006; 139: 469–483. [PubMed] [Google Scholar]
7. Фунг Э.К., Лор Дж.М., мл. Рандомизированные контролируемые испытания для оценки хирургических вопросов. Arch Otolaryngol Head Neck Surg. 2002; 128: 631–634. [PubMed] [Google Scholar]
8. Соломон М.Дж., Маклеод Р.С. Должны ли мы проводить больше рандомизированных контролируемых испытаний по оценке хирургических операций? Хирургия. 1995;118:459–467. [PubMed] [Google Scholar]
1995;118:459–467. [PubMed] [Google Scholar]
9. Pawlik TM, Abdalla EK, Barnett CC, et al. Возможность рандомизированного исследования расширенной лимфаденэктомии при раке поджелудочной железы. Арка Сур. 2005; 140: 584–589. обсуждение 589–591. [PubMed] [Google Scholar]
10. Лилфорд Р.Дж., Торнтон Дж.Г., Браунгольц Д. Клинические испытания и редкие заболевания: выход из загадки. БМЖ. 1995; 311:1621–1625. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Schulz KF, Grimes DA. Расчеты размера выборки в рандомизированных исследованиях: обязательные и мистические. Ланцет. 2005; 365:1348–1353. [PubMed] [Академия Google]
12. Адамина М., Гуллер Ю., Вебер В.П., Ортли Д. Оценки предрасположенности и хирург. Бр Дж Сур. 2006; 93: 389–394. [PubMed] [Google Scholar]
13. Provonost P, West B, Rosenstein B, et al. Внедрение и проверка комплексной программы обеспечения безопасности на уровне отдельных подразделений. J Пациент Саф. 2005; 1:33–40. [Google Scholar]
14. Hebert PC, Wells G, Blajchman MA, et al. Многоцентровое, рандомизированное, контролируемое клиническое исследование требований к переливанию крови при интенсивной терапии. Требования к переливанию крови у исследователей интенсивной терапии, Канадская группа исследований в области интенсивной терапии. N Engl J Med. 1999;340:409–417. [PubMed] [Google Scholar]
Hebert PC, Wells G, Blajchman MA, et al. Многоцентровое, рандомизированное, контролируемое клиническое исследование требований к переливанию крови при интенсивной терапии. Требования к переливанию крови у исследователей интенсивной терапии, Канадская группа исследований в области интенсивной терапии. N Engl J Med. 1999;340:409–417. [PubMed] [Google Scholar]
15. Hill SR, Carless PA, Henry DA, et al. Пороги трансфузии и другие стратегии проведения аллогенных трансфузий эритроцитарной массы. Кокрановская система базы данных, ред. 2002 г., CD002042. [PubMed] [Google Scholar]
16. Antman K, Ayash L, Elias A, et al. Исследование фазы II высоких доз циклофосфамида, тиотепа и карбоплатина с аутологичной поддержкой костного мозга у женщин с поддающимся измерению распространенным раком молочной железы, отвечающих на терапию стандартной дозой. Дж. Клин Онкол. 1992;10:102–110. [PubMed] [Google Scholar]
17. Farquhar C, Marjoribanks J, Basser R, et al. Высокодозная химиотерапия и аутологичная трансплантация костного мозга или стволовых клеток по сравнению с традиционной химиотерапией для женщин с метастатическим раком молочной железы. Кокрановская система базы данных, ред. 2005 г., CD003142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кокрановская система базы данных, ред. 2005 г., CD003142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Peters WP, Shpall EJ, Jones RB, et al. Высокие дозы комбинированных алкилирующих агентов с поддержкой костного мозга в качестве начального лечения метастатического рака молочной железы. Дж. Клин Онкол. 1988;6:1368–1376. [PubMed] [Google Scholar]
19. Thomas EJ, Taggart B, Crandell S, et al. Обучение совместной работе в рамках программы реанимации новорожденных: рандомизированное исследование. Дж. Перинатол. 2007; 27: 409–414. [PubMed] [Google Scholar]
20. Отсутствие экстракраниально-интракраниального артериального шунтирования для снижения риска ишемического инсульта. Результаты международного рандомизированного исследования. Исследовательская группа обхода EC/IC. N Engl J Med. 1985; 313:1191–1200. [PubMed] [Google Scholar]
21. Weinstein PR, Rodriguez y, Baena R, Chater NL. Результаты экстракраниально-интракраниального артериального шунтирования при внутричерепном стенозе внутренней сонной артерии: обзор 105 случаев. Нейрохирургия. 1984;15:787–794. [PubMed] [Google Scholar]
Нейрохирургия. 1984;15:787–794. [PubMed] [Google Scholar]
22. Браунгольц Д.А., Эдвардс С.Дж., Лилфорд Р.Дж. Полезны ли нам рандомизированные клинические испытания (в краткосрочной перспективе)? Доказательства «пробного эффекта» J Clin Epidemiol. 2001; 54: 217–224. [PubMed] [Google Scholar]
23. Janni W, Kiechle M, Sommer H, et al. Участие в исследовании улучшает стратегии лечения и индивидуальный уход за пациентами в участвующих центрах. Противораковый Рез. 2006; 26:3661–3667. [PubMed] [Google Scholar]
24. Hallstrom A, Friedman L, Denes P, et al. Улучшают ли выживаемость пациентов с аритмией, участвуя в рандомизированных клинических исследованиях? Наблюдения в ходе испытаний по подавлению сердечной аритмии (CAST) и испытаний антиаритмических препаратов в сравнении с имплантируемыми дефибрилляторами (AVID) Control Clin. 2003; 24: 341–352. [PubMed] [Академия Google]
25. Weijer C, Freedman B, Fuks A, et al. Какая разница, лечиться в клинических испытаниях? Пилотное исследование. Клин Инвест Мед. 1996; 19: 179–183. [PubMed] [Google Scholar]
Клин Инвест Мед. 1996; 19: 179–183. [PubMed] [Google Scholar]
26. Moseley JB, O’Malley K, Petersen NJ, et al. Контролируемое исследование артроскопической хирургии остеоартрита коленного сустава. N Engl J Med. 2002; 34:81–88. [PubMed] [Google Scholar]
27. Balasubramanian SP, Wiener M, Alshameeri Z, et al. Стандарты отчетности рандомизированных контролируемых исследований в общей хирургии: можем ли мы добиться большего? Энн Сург. 2006 244;: 663–667. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Jacquier I, Boutron I, Moher D, et al. Отчеты о рандомизированных клинических испытаниях с использованием хирургического вмешательства нуждаются в немедленном улучшении: систематический обзор. Энн Сург. 2006; 244: 677–683. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Chang DC, Matsen SL, Simpkins CE. Почему хирурги должны заботиться о методологии клинических исследований? J Am Coll Surg. 2006; 203: 827–830. [PubMed] [Google Scholar]
30. Sacks H, Chalmers TC, Smith H., Jr Рандомизированный контроль в сравнении с историческим контролем для клинических испытаний. Am J Med. 1982;72:233–240. [PubMed] [Google Scholar]
Sacks H, Chalmers TC, Smith H., Jr Рандомизированный контроль в сравнении с историческим контролем для клинических испытаний. Am J Med. 1982;72:233–240. [PubMed] [Google Scholar]
31. Кунц Р., Вист Г., Оксман А.Д. Рандомизация для защиты от предвзятости при отборе в медицинских исследованиях. Кокрановская система базы данных, ред. 2007 г., MR000012. [PubMed] [Google Scholar]
32. Baggs JG, Schmitt MH, Mushlin AI, et al. Связь между сотрудничеством медсестры и врача и результатами лечения пациентов в трех отделениях интенсивной терапии. Крит Уход Мед. 1999; 27:1991–1998. [PubMed] [Google Scholar]
33. Sturmer T, Schneeweiss S, Avorn J, Glynn RJ. Корректировка оценок эффекта для неизмеренного смешения с проверочными данными с использованием калибровки показателя склонности. Am J Эпидемиол. 2005;162:279–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Джадад А. Рандомизированные контролируемые испытания: руководство пользователя. Лондон: Книги BMJ; 1998. [Google Scholar]
[Google Scholar]
35. King M, Nazareth I, Lampe F, et al. Влияние предпочтений участников и врачей на рандомизированные испытания: систематический обзор. ДЖАМА. 2005; 293:1089–1099. [PubMed] [Google Scholar]
36. Альтман Д.Г., Бланд Дж.М. Как рандомизировать. БМЖ. 1999; 319: 703–704. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Альтман Д.Г., Бланд Дж.М. Заметки о статистике. Распределение лечения в контролируемых исследованиях: зачем рандомизировать? БМЖ. 1999; 318:1209. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Дойг Г.С., Симпсон Ф. Рандомизация и сокрытие распределения: практическое руководство для исследователей. J Крит Уход. 2005; 20:187–191. обсуждение 191–193. [PubMed] [Google Scholar]
39. Hall JC, Hall JL. Рандомизация в хирургических исследованиях. Хирургия. 2002; 132: 513–518. [PubMed] [Google Scholar]
40. Эллис С., Холл Дж. Л., Халил А., Холл Дж. К. Эволюция методологических стандартов в хирургических исследованиях. ANZ J Surg. 2005; 75: 874–877. [PubMed] [Академия Google]
ANZ J Surg. 2005; 75: 874–877. [PubMed] [Академия Google]
41. Frisell J, Lidbrink E, Hellstrom L, Rutqvist LE. Последующее наблюдение через 11 лет — обновленные результаты смертности в Стокгольмском маммографическом скрининговом исследовании. Лечение рака молочной железы. 1997; 45: 263–270. [PubMed] [Google Scholar]
42. Chalmers TC, Celano P, Sacks HS, Smith H., Jr Предвзятость при назначении лечения в контролируемых клинических испытаниях. N Engl J Med. 1983; 309: 1358–1361. [PubMed] [Google Scholar]
43. Шульц К.Ф., Чалмерс И., Хейс Р.Дж., Альтман Д.Г. Эмпирические доказательства предвзятости. Параметры методологического качества, связанные с оценкой эффектов лечения в контролируемых исследованиях. ДЖАМА. 1995;273:408–412. [PubMed] [Google Scholar]
44. Шульц К.Ф., Граймс Д.А. Генерация последовательностей распределения в рандомизированных испытаниях: шанс, а не выбор. Ланцет. 2002; 359: 515–519. [PubMed] [Google Scholar]
45. Деверо П.Дж., Бхандари М. , Кларк М. и соавт. Потребность в рандомизированных контролируемых испытаниях, основанных на экспертизе. БМЖ. 2005;330:88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Кларк М. и соавт. Потребность в рандомизированных контролируемых испытаниях, основанных на экспертизе. БМЖ. 2005;330:88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Kernan WN, Viscoli CM, Makuch RW, et al. Стратифицированная рандомизация для клинических испытаний. Дж. Клин Эпидемиол. 1999;52:19–26. [PubMed] [Google Scholar]
47. Fitzgibbons RJ, Jonasson O, Gibbs J, et al. Разработка клинического исследования для определения того, является ли выжидательная тактика приемлемой альтернативой рутинной герниорафии для пациентов с минимальными симптомами грыжи или без них. J Am Coll Surg. 2003; 196: 737–742. [PubMed] [Google Scholar]
48. Бракен МБ. О стратификации, минимизации и защите от ошибок 1 и 2 рода. Дж. Клин Эпидемиол. 2001; 54: 104–105. [PubMed] [Академия Google]
49. Розенбергер В.Ф. Рандомизированные клинические испытания по принципу «играй в победителя»: обзор и рекомендации. Контрольные клинические испытания. 1999; 20: 328–342. [PubMed] [Google Scholar]
50. Kuehn BM. Промышленность, FDA приветствует «адаптивные» испытания. ДЖАМА. 2006; 296:1955–1957. [PubMed] [Google Scholar]
Kuehn BM. Промышленность, FDA приветствует «адаптивные» испытания. ДЖАМА. 2006; 296:1955–1957. [PubMed] [Google Scholar]
51. Schmidt C. Адаптивный дизайн может ускорить клинические испытания. J Natl Cancer Inst. 2007; 99: 108–109. [PubMed] [Google Scholar]
52. Морита С., Сакамото Дж. Применение адаптивного дизайна к рандомизированному отборочному исследованию фазы II при раке желудка: отчет о дизайне исследования. Фарм Стат. 2006;5:109–118. [PubMed] [Google Scholar]
53. Bartlett RH, Roloff DW, Cornell RG, et al. Экстракорпоральное кровообращение при неонатальной дыхательной недостаточности: проспективное рандомизированное исследование. Педиатрия. 1985; 76: 479–487. [PubMed] [Google Scholar]
54. Paneth N, Wallenstein S. Экстракорпоральная мембранная оксигенация и правило игры победителя. Педиатрия. 1985; 76: 622–623. [PubMed] [Google Scholar]
55. Элбурн Д., Филд Д., Магфорд М. Экстракорпоральная мембранная оксигенация при тяжелой дыхательной недостаточности у новорожденных. Кокрановская система базы данных, ред. 2002 г., CD001340. [PubMed] [Академия Google]
Кокрановская система базы данных, ред. 2002 г., CD001340. [PubMed] [Академия Google]
56. Торгерсон Д.Дж., Сиббалд Б. Понимание контролируемых испытаний. Что такое исследование предпочтений пациентов? БМЖ. 1998;316:360. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Torgerson DJ, Klaber-Moffett J, Russell IT. Предпочтения пациентов в рандомизированных исследованиях: угроза или возможность? Политика J Health Serv Res. 1996; 1: 194–197. [PubMed] [Google Scholar]
58. Halpern SD. Оценка эффектов предпочтения в частично неслепых рандомизированных клинических испытаниях. Дж. Клин Эпидемиол. 2003;56:109–115. [PubMed] [Google Scholar]
59. Джадад А. Рандомизированные контролируемые испытания: руководство пользователя. Том. 24. Лондон: BMJ Books; 1998. Типы рандомизированных контролируемых исследований. [Google Scholar]
60. Адамсон Дж., Кокейн С., Паффер С., Торгерсон Д.Дж. Обзор рандомизированных испытаний с использованием дизайна пострандомизированного согласия (Zelen). Испытания Contemp Clin. 2006; 27: 305–319. [PubMed] [Google Scholar]
Испытания Contemp Clin. 2006; 27: 305–319. [PubMed] [Google Scholar]
61. Торгерсон Д.Дж., Роланд М. Что такое дизайн Зелена? БМЖ. 1998; 316:606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Blakely ML, Lally KP, McDonald S, et al. Послеоперационные результаты новорожденных с экстремально низкой массой тела при рождении с некротизирующим энтероколитом или изолированной перфорацией кишечника: проспективное когортное исследование, проведенное сетью исследований новорожденных NICHD. Энн Сург. 2005; 241:984–989. обсуждение 989–994. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Blakely ML, Tyson JE, Lally KP, et al. Лапаротомия по сравнению с дренированием брюшины при некротизирующем энтероколите или изолированной перфорации кишечника у детей с экстремально низкой массой тела при рождении: исходы в течение 18 месяцев с поправкой на возраст. Педиатрия. 2006; 117: e680–e687. [PubMed] [Академия Google]
64. Hardcastle JD, Chamberlain JO, Robinson MH, et al. Рандомизированное контролируемое исследование скрининга фекально-скрытой крови на колоректальный рак. Ланцет. 1996; 348: 1472–1477. [PubMed] [Google Scholar]
Рандомизированное контролируемое исследование скрининга фекально-скрытой крови на колоректальный рак. Ланцет. 1996; 348: 1472–1477. [PubMed] [Google Scholar]
65. Greenhalgh RM, Brown LC, Kwong GP, et al. Сравнение эндоваскулярной пластики аневризмы с открытой пластикой у пациентов с аневризмой брюшной аорты (исследование EVAR 1), результаты 30-дневной операционной смертности: рандомизированное контролируемое исследование. Ланцет. 2004; 364: 843–848. [PubMed] [Академия Google]
66. Сравнение эндоваскулярной пластики аневризмы с открытой пластикой у пациентов с аневризмой брюшной аорты (исследование EVAR 1): рандомизированное контролируемое исследование. Ланцет. 2005; 365: 2179–2186. [PubMed] [Google Scholar]
67. Дельгадо-Родригес М., Льорка Дж. Биас. J Эпидемиол общественного здоровья. 2004; 58: 635–641. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Rothwell PM. Факторы, которые могут повлиять на внешнюю валидность рандомизированных контролируемых испытаний.

 Поскольку в Европе публикуется только половина результатов исследований 5, было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
Поскольку в Европе публикуется только половина результатов исследований 5, было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
 Анамнез у детей (до совершеннолетнего возраста) осуществляется на основе опроса родителей или близких родственников. При сборе информации о человеке, страдающем психическим расстройством, необходимо отличать субъективный анамнез (представление самого пациента о его самочувствии) от объективного (реального положения дел, которое выясняется у знающих его лиц).
Анамнез у детей (до совершеннолетнего возраста) осуществляется на основе опроса родителей или близких родственников. При сборе информации о человеке, страдающем психическим расстройством, необходимо отличать субъективный анамнез (представление самого пациента о его самочувствии) от объективного (реального положения дел, которое выясняется у знающих его лиц). Количество испытуемых обычно колеблется от нескольких сотен до примерно 3000 человек. Если FDA согласится с положительными результатами испытаний, оно одобрит экспериментальное лекарство или устройство.
Количество испытуемых обычно колеблется от нескольких сотен до примерно 3000 человек. Если FDA согласится с положительными результатами испытаний, оно одобрит экспериментальное лекарство или устройство. Во время этих посещений исследовательская группа собирает информацию о последствиях вмешательства, а также о вашей безопасности и благополучии.
Во время этих посещений исследовательская группа собирает информацию о последствиях вмешательства, а также о вашей безопасности и благополучии.