Химия вокруг нас. В ПГАТУ показали опыты с водой
Самое важное
- Власти Перми представили программу празднования Дня города
- В лесах Пермского края установлен особый противопожарный режим
- Мобильные кондукторы начинают работать в пермском транспорте
- Парад Победы в Перми
- Рекордный минимум воды. В Прикамье обмелели реки
- Пермский край
- Обновлено в 13:57
Образование
- 25.
 03.2022
03.2022 - 14:55
Студенты Пермского аграрно-технологического университета провели опыты с водой и сняли про это видеоролик. Ассистент кафедры общей химии Анна Фомина показала несколько методов исследования качества воды, которые можно провести в домашних условиях.
Для опыта нужны стакан с водой, марганцовка и лакмусовая бумажка. Если лакмусовая бумажка посинела, в воде присутствует щелочь, если вода имеет желтый оттенок или осадок, пить ее нельзя. Цель эксперимента — определить, какую воду лучше использовать для питья без вреда для своего здоровья.
Главный вывод — водопроводную воду без кипячения и тем более талую воду употреблять не рекомендуется.
Username or email address * Password *Remember Me
Lost your password?- Главная
Проекты
- Вести Пермь
- События недели
- Гость студии
- Дежурная часть
- Вести с Думой
- Специальный репортаж
- Радио
- 95 лет краевому радио
- Кудымкар
- Вести.
 Здоровье
Здоровье - Приметы времени
- Пермь 300
- За край земли
Разделы
- Общество
- Экономика
- Политика
- Происшествия
- Транспорт
- ЖКХ
- Образование
- Здоровье
- Культура
- Наука и техника
- Спорт
- Архив
-
Химические опыты
Химический опыт брома с алюминием
Горение алюминия в броме
Если в пробирку из термостойкого стекла поместить несколько миллилитров брома и аккуратно опустить в него кусочек алюминиевой фольги, то через некоторое время (необходимое для того, чтобы бром проник через оксидную плёнку) начнётся бурная реакция. От выделяющегося тепла алюминий плавится и в виде маленького огненного шарика катается по поверхности брома (плотность жидкого алюминия меньше плотности брома), быстро уменьшаясь в размерах. Пробирка наполняется парами брома и белым дымом, состоящим из мельчайших кристаллов бромида алюминия:
От выделяющегося тепла алюминий плавится и в виде маленького огненного шарика катается по поверхности брома (плотность жидкого алюминия меньше плотности брома), быстро уменьшаясь в размерах. Пробирка наполняется парами брома и белым дымом, состоящим из мельчайших кристаллов бромида алюминия:
2Al+3Вr2→ 2AlВr3.
Также интересно наблюдать реакцию алюминия с иодом. Смешаем в фарфоровой чашечке небольшое количество порошкообразного иода с алюминиевой пудрой. Пока реакции не заметно: в отсутствие воды она протекает крайне медленно. Пользуясь длинной пипеткой, капнем на смесь несколько капель воды, играющей роль инициатора, и реакция пойдёт энергично — с образованием пламени и выделением фиолетовых паров иода.
Химические опыты с порохом: как взрывается порох!
ПорохаДымный, или чёрный, порох представляет собой смесь калийной селитры (нитрата калия — KNO3), серы (S) и угля (C). Он воспламеняется при температуре около 300 °С. Порох может взрываться и от удара. В его состав входят окислитель (селитра) и восстановитель (уголь). Сера также является восстановителем, но главная её функция — связывать калий в прочное соединение. При горении пороха протекает реакция:
Порох может взрываться и от удара. В его состав входят окислитель (селитра) и восстановитель (уголь). Сера также является восстановителем, но главная её функция — связывать калий в прочное соединение. При горении пороха протекает реакция:
2KNO3+ЗС+S→ K2S+N2+3СО2,
— в результате которой выделяется большой объём газообразных веществ. С этим и связано использование пороха в военном деле: образующиеся при взрыве и расширяющиеся от тепла реакции газы выталкивают пулю из оружейного ствола. В образовании сульфида
калия легко убедиться, понюхав ствол ружья. Он пахнет сероводородом — продуктом гидролиза сульфида калия.
Химические опыты с селитрой: огненная надпись
Эффектный химический опыт можно провести, имея калийную селитру. Напомню, что селитры — это сложные вещества — соли азотной кислоты. В данном случае нам понадобится калиевая селитра. Её химическая формула KNO3.
2KNO3→ 2 KNO2 +O2.
Здесь KNO2 +O2 — соль азотистой кислоты. От выделяющегося кислорода бумага обугливается и сгорает. Для большего эффекта опыт можно проводить в тёмном помещении.
Химические опыт растворения стекла в плавиковой кислоте
Стекло растворяетсяв плавиковой кислоте
Действительно, стекло легко растворяется. Стекло — это очень вязкая жидкость. В том, что стекло может растворяться, можно убедиться, проделав следующую химическую реакцию.
Плавиковая кислота — это кислота, образованная растворением фтороводорода (HF) в воде. Её ещё называют фтороводородная кислота.
Для большей наглядности возьмём тонкое спекло, на которое прицепим грузик. Стекло с грузиком опустим в раствор плавиковой кислоты. Когда стекло растворится в кислоте, грузик упадёт на дно колбы.
Стекло — это очень вязкая жидкость. В том, что стекло может растворяться, можно убедиться, проделав следующую химическую реакцию.
Плавиковая кислота — это кислота, образованная растворением фтороводорода (HF) в воде. Её ещё называют фтороводородная кислота.
Для большей наглядности возьмём тонкое спекло, на которое прицепим грузик. Стекло с грузиком опустим в раствор плавиковой кислоты. Когда стекло растворится в кислоте, грузик упадёт на дно колбы.
Химические опыты с выделением дыма
Химические реакции свыделением дыма
(хлорид аммония)
Проведём красивый опыт по получению густого белого дыма. Для этого нам нужно приготовить смесь поташа (карбонат калия К
2CO3) раствором аммиака (нашатырный спирт). Смешаем реагенты: поташ и нашатырный спирт. К полученной смеси добавим раствор соляной кислоты. Реакция начнётся уже в момент, когда колба с соляной кислотой будет близко поднесена к колбе, в которой содержится аммиак. Аккуратно прилейте соляную кислоту к раствору аммиака и наблюдайте образование густого белого пара хлорида аммония, химическая формула которого NH4Cl.
Химическая реакция между аммиаком и соляной кислотой протекает следующим образом:
Аккуратно прилейте соляную кислоту к раствору аммиака и наблюдайте образование густого белого пара хлорида аммония, химическая формула которого NH4Cl.
Химическая реакция между аммиаком и соляной кислотой протекает следующим образом:
HCl+NH3→ NH4Cl
Химические опыты: свечение растворов
Реакция свечения раствораКак отмечено выше — свечение растворов — признак химической реакции. Проведём ещё один эффектный опыт, при котором у нас раствор будет светиться. Для реакции нам необходим раствор люминол, раствор перекиси водорода H
 Свечение происходит при реакции люминола с некоторыми окислителями в щелочной среде.
Свечение происходит при реакции люминола с некоторыми окислителями в щелочной среде.
Итак, начнём: прилейте раствор перекиси водорода к люминолу, затем к полученному раствору добавьте горсть кристалликов красной кровяной соли. Для большего эффекта попробуйте проводить опыт в темном помещении! Как только кристаллики кровяной красной соли коснуться раствора, сразу будет заметно холодное голубое свечение, что свидетельствует о течении реакции. Свечение при химической реакции называется хемилюминисценцией
Ещё один химический опыт со светящимися растворами:
Для него нам потребуется: гидрохинон (раньше использовался в фототехнике), карбонат калия K2CO3 (ещё известен под названием «поташ»), аптечный раствор формалина (формальдегида) и перекись водорода.
Растворите 1 гр гидрохинона и 5 гр карбоната калия K2CO3 в 40 мл аптечного формалина (водный раствор формальдегида). Перелейте эту реакционную смесь в большую колбу или бутылку емкостью не менее литра.
В небольшом сосуде приготовьте 15 мл концентрированного раствора перекиси водорода. Можно использовать таблетки гидроперита — соединение перекиси водорода с мочевиной (мочевина не помешает опыту).
Для большего эффекта зайдите в темную комнату, когда глаза привыкнут к темноте, слейте раствор пероксида водорода в большой сосуд с гидрохиноном. Смесь начнет вспениваться (поэтому и надо взять большой сосуд) и появится отчетливое оранжевое свечение!
Перелейте эту реакционную смесь в большую колбу или бутылку емкостью не менее литра.
В небольшом сосуде приготовьте 15 мл концентрированного раствора перекиси водорода. Можно использовать таблетки гидроперита — соединение перекиси водорода с мочевиной (мочевина не помешает опыту).
Для большего эффекта зайдите в темную комнату, когда глаза привыкнут к темноте, слейте раствор пероксида водорода в большой сосуд с гидрохиноном. Смесь начнет вспениваться (поэтому и надо взять большой сосуд) и появится отчетливое оранжевое свечение!
Химические реакции, при которых появляется свечение происходят не только при окислении. Иногда свечение возникает при кристаллизации. Самый простой способ его наблюдения — поваренная соль. Растворите поваренную соль в воде, причем соли возьмите столько, чтобы на дне стакана оставались нерастворившиеся кристаллы. Полученный насыщенный раствор перелейте в другой стакан и по каплям добавляйте к этому раствору концентрированную соляную кислоту.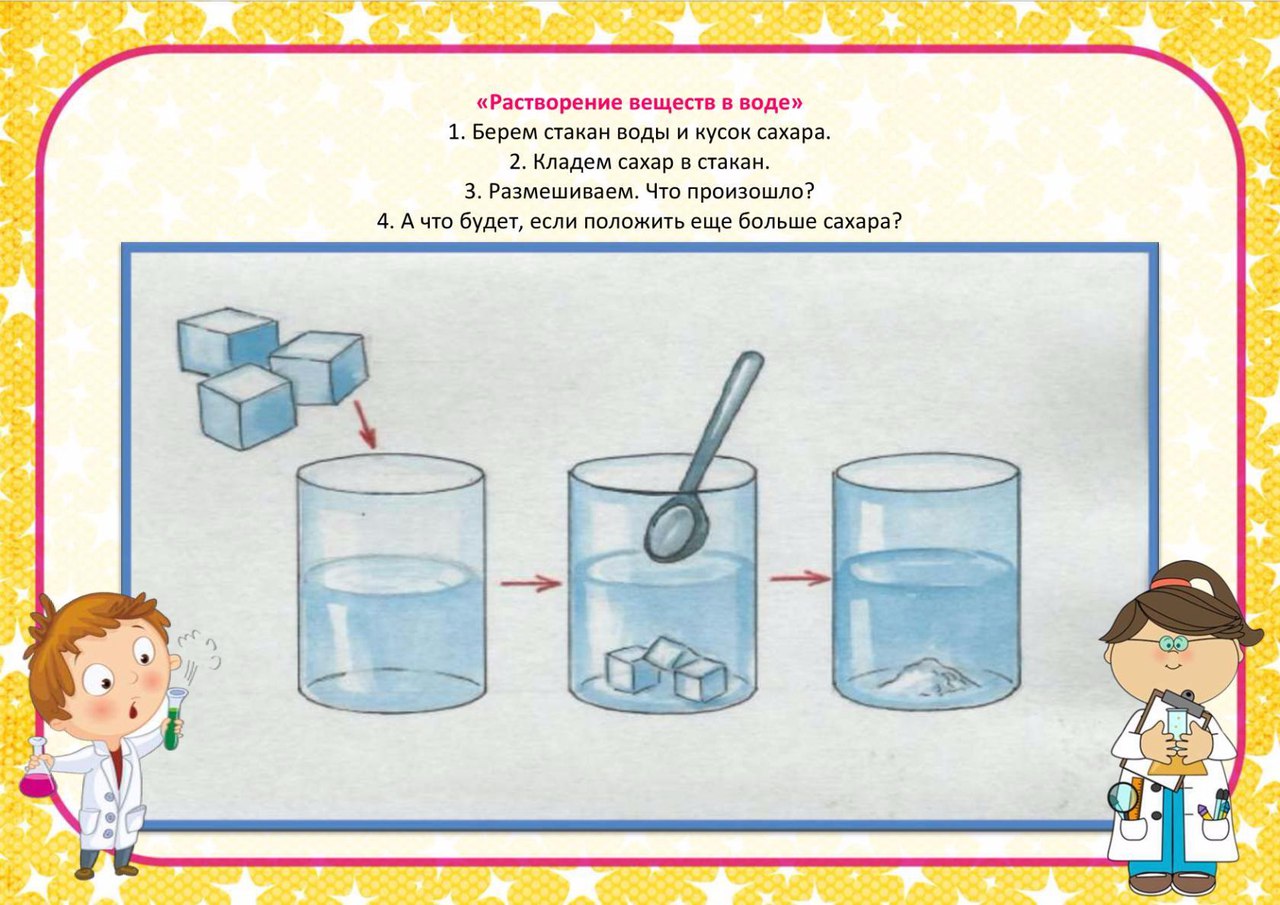 Соль начнет кристаллизоваться, при этом в растворе будут проскальзывать искры. Наиболее красиво, если опыт ставить в темноте!
Соль начнет кристаллизоваться, при этом в растворе будут проскальзывать искры. Наиболее красиво, если опыт ставить в темноте!
Химические опыты с хромом и его соединениями
Разноцветный хром!…
Окраска солей хрома может легко переходить из фиолетовой в зелёную и наоборот. Проведём реакцию: растворим в воде несколько фиолетовых кристалликов хлорида хрома CrCl3*6Н2О. При кипячении фиолетовый раствор этой соли становится зелёным. При выпаривании зелёного раствора образуется зелёный порошок того же состава, что и исходная соль. А если насытить охлаждённый до 0 °С зелёный раствор хлорида хрома хлороводородом (HCl), цвет его вновь станет фиолетовым.
Как объяснить наблюдаемое явление?
Это редкий в неорганической химии пример изомерии — существования веществ, имеющих одинаковый состав, но разные строение и свойства. В фиолетовой соли атом хрома связан с шестью молекулами воды, а атомы хлора являются противоионами: [Cr(Н2О)6]Cl3, а в зелёном хлориде хрома они меняются местами: [Cr(Н2О)4Cl2]Cl*2Н2О. В кислой среде бихроматы являются сильными окислителями. Продукты их восстановления — ионы Cr3+:
В кислой среде бихроматы являются сильными окислителями. Продукты их восстановления — ионы Cr3+:
К2Cr2О7+4H2SO4+3K2SO3→ Cr2(SO4)3+4K2SO4+4H2O.
Хромат калия (жёлтый)бихромат — (красный)
При пониженной температуре из образовавшегося раствора удаётся выделить фиолетовые кристаллы хромокалиевых квасцов KCr(SO4)2•12Н2О.
Тёмно-красный раствор, получаемый при добавлении концентрированной серной кислоты к насыщенному водному раствору дихромата калия, называется «хромпик». В лабораториях он служит для мытья и обезжиривания химической посуды. Посуду осторожно ополаскивают хромпиком, который не выливают в раковину, а используют многократно. В конце концов смесь становится зелёной — весь хром в таком растворе уже перешёл в форму Сr3+.
Особенно сильный окислитель — оксид хрома (VI) СrО3. С его помощью можно зажечь спиртовку без спичек: достаточно прикоснуться к смоченному спиртом фитилю палочкой с несколькими кристалликами этого вещества.
При разложении CrО3 может быть получен тёмно-коричневый порошок оксида хрома (IV) CrО2. Он обладает ферромагнитными свойствами и используется в магнитных лентах некоторых типов аудиокассет.
В организме взрослого человека содержится всего около б мг хрома. Многие соединения этого элемента (особенно хроматы и дихроматы) токсичны, а некоторые из них являются канцерогенами, т.е. способны вызывать рак.
С его помощью можно зажечь спиртовку без спичек: достаточно прикоснуться к смоченному спиртом фитилю палочкой с несколькими кристалликами этого вещества.
При разложении CrО3 может быть получен тёмно-коричневый порошок оксида хрома (IV) CrО2. Он обладает ферромагнитными свойствами и используется в магнитных лентах некоторых типов аудиокассет.
В организме взрослого человека содержится всего около б мг хрома. Многие соединения этого элемента (особенно хроматы и дихроматы) токсичны, а некоторые из них являются канцерогенами, т.е. способны вызывать рак.
Химические опыты: восстановительные свойства железа
Хлорид железа III
Данный тип химической реакции относится к окислительно-восстановительным реакциям.
Для проведения реакции нам потребуется разбавленный (5%-й) водные растворы хлорида железа(III) FeCl3 и такой же раствор иодида калия KI.
Итак, в одну колбу наливают раствор хлорида железа(III). Затем добавляем к ней несколько капель раствора иодида калия. Наблюдаем изменение окраски раствора. Жидкость приобретёт красно-бурый цвет.
В растворе будут протекать следующие химические реакции:
Затем добавляем к ней несколько капель раствора иодида калия. Наблюдаем изменение окраски раствора. Жидкость приобретёт красно-бурый цвет.
В растворе будут протекать следующие химические реакции:
2FeCl3 + 2KI→ 2FeCl2 + 2KCl + I2
KI + I2→ K[I(I)2]
Хлорид железа II
Ещё один химический опыт с соединениями железа. Для него нам понадобятся разбавленные (10–15%-й) водные растворы сульфата железа(II) FeSO4 и тиоцианата аммония NH4NCS, бромная вода Br2.
Начнём. В одну колбу наливаем раствор сульфата железа(II). Туда же добавляют 3–5 капель раствора тиоцианата аммония. Замечаем, что нет никаких признаков химических реакций. Конечно, катионы железа(II) не образуют с тиоцианат-ионами окрашенных комплексов. Теперь в эту колбу добавляем бромную воду. А вот теперь ионы железа «выдали себя» и окрасили раствор в кроваво-красный цвет. так реагируют ион (III) -валентного железа на тиоцианат-ионы.
Вот, что происходило в колбе:
так реагируют ион (III) -валентного железа на тиоцианат-ионы.
Вот, что происходило в колбе:
6FeSO4 + 3Br2→ 2Fe2(SO4)3 + 2FeBr3
Fe(H2O)6]3+ + n NCS– [Fe(H2O)6–n(NCS)n](n–3) – + n H2O
Химический опыт по обезвоживанию сахара серной кислотой
Обезвоживание сахарасерной кислотой
Концентрированная серная кислота обезвоживает сахар. Сахар — это сложное органическое вещество, формула которого C12H22O11. Вот, как это происходит.
Сахарную пудру помещают в высокий стеклянный стакан, чуть смачивают водой. Затем к влажному сахару приливают немного концентрированной серной кислоты. осторожно и быстро перемешивают стеклянной палочкой. Палочку так и оставляют в середине стакана со смесью. Через 1 — 2 минуты сахар начинает чернеть, вспучиваться и в виде объёмной, рыхлой массы чёрного цвета подниматься, забирая с собой стеклянную палочку. Cмесь в стакане сильно разогревается и немного дымиться.
При этой химической реакции серная кислота не только отбирает у сахара воду, но и частично превращает его в уголь.
Cмесь в стакане сильно разогревается и немного дымиться.
При этой химической реакции серная кислота не только отбирает у сахара воду, но и частично превращает его в уголь.
C12H22O11+2H2SO4(конц.)→ 11С+CO2+13H2O+2SO2
Выделяющаяся вода при такой химической реакции в основном поглощается серной кислотой (серная кислота «жадно» поглощает воду) с образованием гидратов, — отсюда сильное выделение тепла. А углекислый газ CO2, который получается при окислении сахара, и сернистый газ SO2 поднимают обугливающуюся смесь вверх.
Химическая опыт с исчезновением алюминиевой ложки
Раствор нитрата ртути
Проведём ещё одну забавную химическую реакцию: для этого нам потребуется алюминиевая ложка и нитрат ртути (Hg(NO3)2).
Итак, возьмём ложку, очистим её мелкозернистой наждачной бумагой, затем обезжирим ацетоном. Окуните ложку на несколько секунд в раствор нитрата ртути (Hg(NO3)2). (помните, что соединения ртути ядовиты!). Как только поверхность алюминиевой ложки в растворе ртути станет серого цвета, ложку надо вынуть, обмыть кипячёной водой высушить (промокая, но не вытирая).
Через несколько секунд металлическая ложка будет превращаться в белые пушистые хлопья, и вскоре от неё останется лишь сероватая кучка пепла. Произошло вот что:
Окуните ложку на несколько секунд в раствор нитрата ртути (Hg(NO3)2). (помните, что соединения ртути ядовиты!). Как только поверхность алюминиевой ложки в растворе ртути станет серого цвета, ложку надо вынуть, обмыть кипячёной водой высушить (промокая, но не вытирая).
Через несколько секунд металлическая ложка будет превращаться в белые пушистые хлопья, и вскоре от неё останется лишь сероватая кучка пепла. Произошло вот что:
Al + 3 Hg(NO3)2→ 3 Hg + 2 Al(NO3)3.
В растворе в начале реакции на поверхности ложки появляется тонкий слой амальгамы алюминия (сплав алюминия и ртути). Затем амальгама превращается в белые пушистые хлопья гидроксида алюминия (Al(OH)3). Израсходованный в реакции металл пополняется новыми порциями алюминия, растворённого в ртути. И, наконец, вместо блестящей ложки на бумаге остаётся белый порошок Al(OH)3 и мельчайшие капельки ртути. Если после раствора нитрата ртути (Hg(NO3)2) алюминиевую ложку сразу погрузить в дистиллированную воду, то на её поверхности появятся пузырьки газа и чешуйки белого цвета (произойдёт выделение водорода и гидроксида алюминия).
Если после раствора нитрата ртути (Hg(NO3)2) алюминиевую ложку сразу погрузить в дистиллированную воду, то на её поверхности появятся пузырьки газа и чешуйки белого цвета (произойдёт выделение водорода и гидроксида алюминия).
Water Chemistry Science Fair Projects & Experiments
Начальная школа — классы K-3
P =Project    E =Experiment
Как взаимодействуют между собой жидкости разной плотности? [ Е ]
Пузыри всегда круглые? [ Р ] [ Р ]
Проверьте, улучшит ли смесь раствор для пузырей добавление глицерина или кукурузного сиропа. [ Е ]
Какой рецепт создаст самые большие пузыри? [ Е ] [ Е ]
Узнайте, как различные концентрации водно-солевого раствора повлияли на скорость гоночного автомобиля Hot Wheels Formula Fuelers на нашей гоночной трассе. [ Р ]
При добавлении капли моющего средства в тарелку с молоком с пищевым красителем, какое молоко дает наилучшие завихрения цвета: 1%, 2% или цельное молоко? Что происходит с простой водой? [ Р ]
Соль заставит лед таять быстрее? [ Е ] [ Е ]
Жесткость воды и рН воды Проекты научной ярмарки
Вода Эксперименты с К-12 и справочная информация
Междисциплинарная тема: Вода
Междисциплинарная тема: Лед
Начальная школа — 4-6 классы
P =Project    E =Эксперимент
Узнайте, какие материалы могут поймать пузырь, не лопнув его. [ Е ]
[ Е ]
Холодная вода закипает быстрее, чем теплая? [ Е ]
Сделайте лучше экологически чистый плавильщик льда. [ Р ] [ Р ]
Проверьте, могут ли более дорогие полотенца удерживать больше воды и являются ли они более прочными. [ Р ]
Какая из шести тканей (джинс, шерсть, хлопок, флис, полиэстер и войлок) лучше всего изолирует нагретую воду? [ Р ]
Отделите чистую воду от фруктового сока с помощью простого перегонного аппарата. [ Е ]
Найдите критическую точку для коллоидных смесей, состоящих из различных видов крахмала. [ Е ]
Сделайте гели из кукурузного крахмала и воды и проверьте, сможете ли вы изменить консистенцию конечного продукта, изменив соотношение ингредиентов. [ Е ]
Влияние скорости ветра, влажности и температуры воздуха на скорость испарения воды [ Р ]
Выясните, повысится ли температура кипения воды при добавлении различных количеств различных растворенных веществ.
 [ Е ]
[ Е ]Выясните, может ли добавление соли, масла, моющих средств и воды для отопления повлиять на поверхностное натяжение обычной водопроводной воды. [ Е ]
Определите, какой тип воды будет растворять брусок мыла с наибольшей скоростью. [ Е ]
Влияние соли на температуру кипения воды [ Р ]
Оценить эффективность различных продуктов для плавления льда [ Р ]
Как влияет концентрация хлора на эффективность угольного фильтра? [ Р ]
Жесткость воды и рН воды Проекты научной ярмарки
Вода Эксперименты с К-12 и справочная информация
Междисциплинарная тема: Вода
Междисциплинарная тема: Лед
Средняя школа — 7-9 классы
P =Проект    E =Эксперимент
Бумага какого цвета из черной, белой, синей, желтой, зеленой и красной обеспечивает наибольшую температуру воды в банке после 1 часа пребывания в нагревательной лампе? [ Р ]
Какие кубики льда быстрее всего растают в разных емкостях с разными веществами? [ Р ]
Экологически чистое и недорогое решение для удаления и извлечения красителя из промышленных сточных вод [ Е ]
Удаление наночастиц красителя с помощью природного коагулянта с электрокоагуляцией в последовательной очистке сточных вод [ Е ]
Снижение температуры кипения воды [ Е ]
Узнайте, останется ли горный ручей жидким при температурах, которые замерзают в высокогорном озере.
 [ Е ]
[ Е ]Управление поверхностным натяжением воды для поиска наилучшего способа очистки [ Е ]
Гидравлический разрыв пласта с использованием морской воды [ Е ]
Влияние биоразлагаемого красителя на скорость испарения соленой воды [ Е ]
Могут ли сшитые полимеры помочь в водном кризисе в Калифорнии [ Е ]
Используйте электрический калориметр для измерения теплоемкости воды и измерения преобразования электрической энергии в тепловую. [ Е ]
Определите, как изменяется температура смеси воды и аммиачной селитры в зависимости от количества растворенной в воде аммиачной селитры. [ Е ]
Определите, вода или уксус (вода с уксусной кислотой) лучше подходят для определения содержания свинца в бытовых предметах. [ Е ]
Определите, какой добавленный материал заставит лед таять быстрее. [ Е ]
Определите, изменяется ли проводимость дистиллированной воды при смешивании ее с различными веществами и в какой степени.
 [ Е ]
[ Е ]Анализ воды на ртуть с помощью света [ Е ]
Определите ионную или неионную природу воды, создав собственный измеритель электропроводности воды. [ Е ]
Как вещества, смешанные с водой, влияют на скорость ее испарения? [ Е ]
Зависит ли скорость нагрева воды от солености? [ Е ]
Влияние растворенных соли и сахара на скорость таяния льда [ Е ] [ С ]
Как солнечный свет влияет на химический состав воды в аквариуме с морским рифом? [ Е ]
Создайте эффективную и экономичную холодную упаковку, используя воду и различные виды и количество удобрений. [ Р ]
Почему сахарная вода увеличивает магнитное притяжение? [ Е ]
Как четыре соли влияют на электропроводность [ Е ]
Найдите лучший способ переработки мочи, чтобы астронавты могли получать воду, не тратя на космическую станцию больших денег и веса груза.
 [ Е ]
[ Е ]Как быстро ионы водорода диффундируют в воде? [ Е ]
Солнечный электролиз воды для производства водорода [ Е ]
Насколько уменьшается поверхностное натяжение воды при увеличении количества моющего средства? [ Е ]
Регулировка уровня хлора для минимизации потерь от испарения воды в бассейне [ Е ]
Влияние температуры на растворимость в воде квасцов, пищевой соды, соли Эпсома и соли [ Р ]
Антиобледенители [ Р ] [ Р ]
Как температура влияет на скорость молекул в воде? [ Е ]
Международный проект точки кипения [ Е ]
Как соль влияет на температуру кипения воды? [ Е ]
Понижает ли добавление соли в воду температуру ее замерзания? [ Е ] [ Е ] [ Е ]
Факторы, влияющие на реакцию кислотных дождей на известняк [ Е ]
Проверить электропроводность воды [ Е ]
Исследуйте динамику потока солевого осциллятора [ Е ]
Посмотрите, чем отличается гидравлическая проводимость воды и сырой нефти.
 [ Е ]
[ Е ]Жесткость воды и рН воды Проекты научной ярмарки
Вода K-12 Эксперименты и справочная информация
Междисциплинарная тема: Вода
Междисциплинарная тема: Лед
Средняя школа — 10-12 классы
P =Проект    E =Эксперимент
Узнайте, что произойдет, если мы будем выращивать агрегаты серебра при различных концентрациях и разности потенциалов. [ Е ]
Новые методы рентгеновской спектроскопии для исследования связывающей структуры воды [ Е ]
Определить эффективность коммерческих ледоколов. [ Р ]
Проверка проводимости воды и других жидкостей [ Е ]
Проводимость и качество воды [ Е ]
Эффективность замораживания опреснения [ Е ]
Влияние хлора на образование побочных продуктов дезинфекции [ Е ]
НОВЫЙ КВАНТОВО-МЕХАНИЧЕСКИЙ ПОДХОД К ОПРЕДЕЛЕНИЮ ОКТАНОЛОВЫХ КОЭФФИЦИЕНТОВ ВОДОРАСПРЕДЕЛЕНИЯ (Kow) ОРГАНИЧЕСКИХ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ [ Е ]
Изучение понижения температуры замерзания воды как функции ионизации растворенных веществ с термодинамической точки зрения [ Е ]
Технологии очистки воды [ Е ]
Жесткость воды и рН воды Проекты научной ярмарки
Вода Эксперименты с К-12 и справочная информация
Междисциплинарная тема: Вода
Междисциплинарная тема: Лед
Полезные ссылки
R = Ресурс
Научная ярмарка Проекты Ресурсы [ р ]
Руководства по цитированию, Руководства по стилю, Справочник [ р ]
Ресурсы по безопасности [ р ] [ р ]
10 Эксперименты по науке о воде – Childsplayabc ~ Природа – наша игровая площадка
Вся жизнь на Земле зависит от воды (это неотъемлемая часть химии жизни), она также составляет 60% человеческого тела, и мы не можем выжить более чем несколько дней без него. Хотя вода покрывает 70 % поверхности Земли, вы можете быть удивлены, обнаружив, что только 3 % воды — пресная вода, а остальные 97 % — соленая вода! Вода – это природное химическое вещество, состоящее из комбинации атомов кислорода и водорода. Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода, отсюда и химическая формула h3O.
Хотя вода покрывает 70 % поверхности Земли, вы можете быть удивлены, обнаружив, что только 3 % воды — пресная вода, а остальные 97 % — соленая вода! Вода – это природное химическое вещество, состоящее из комбинации атомов кислорода и водорода. Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода, отсюда и химическая формула h3O.
Вода может находиться в трех разных состояниях: газообразном (водяной пар), жидком (жидкость) или твердом (лед). Большая часть воды на Земле постоянно движется и меняет свое состояние по мере прохождения различных стадий круговорота воды. Круговорот воды — это процесс, при котором вода перемещается между поверхностью земли и атмосферой в непрерывном цикле.
Ниже вы найдете 10 простых и легких идей и экспериментов по изучению воды, которые помогут вам узнать больше об этом замечательном веществе.
1. Нарисуйте диаграмму круговорота воды
Вы можете легко показать различные этапы круговорота воды, используя простую картинку или диаграмму, нарисованную на бумаге или переработанном картоне. В круговороте воды выделяют 4 основных этапа. Испарение, конденсация, осаждение и сбор, которые более подробно описаны ниже.
В круговороте воды выделяют 4 основных этапа. Испарение, конденсация, осаждение и сбор, которые более подробно описаны ниже.
1. Испарение – когда тепло солнца нагревает воду на суше (лужи, озера, реки и моря), вода испаряется и превращается в водяной пар.
2. Конденсация – это когда водяной пар охлаждается и снова превращается в капли воды. Когда это происходит в атмосфере, крошечные капельки образуют облака.
3. Осадки – это когда капли воды в облаках падают на землю (притягиваются под действием силы тяжести) в виде дождя, мокрого снега, снега или града.
4. Сбор – это когда вся вода, упавшая на землю и образующая поверхностные воды, в конечном итоге возвращается обратно в моря, озера и реки. Часть воды впитается в землю и образует грунтовые воды, которые, в свою очередь, впитываются корнями деревьев и растений.
2. Продемонстрировать испарение. конденсация и осадки
Вы можете провести простой научный эксперимент, чтобы продемонстрировать процессы испарения. конденсации и осаждения, используя только стеклянную банку, горячую воду, лед и либо фольгу, либо пищевую пленку.
конденсации и осаждения, используя только стеклянную банку, горячую воду, лед и либо фольгу, либо пищевую пленку.
Просто налейте горячую воду в банку с вареньем (осторожно, стекло может стать слишком горячим, чтобы его можно было трогать), а затем накройте сверху фольгой или пищевой пленкой. положите несколько кубиков льда на верхнюю часть фольги или пищевой пленки. Мы также украсили нашу банку перед экспериментом и добавили в воду несколько капель синего пищевого красителя, чтобы она выделялась, но вам не нужно этого делать.
Теперь вы можете посмотреть, что произойдет. Когда горячая вода испаряется и превращается в водяной пар, она поднимается вверх и встречается с холодным воздухом и поверхностью, образованной кубиками льда. Когда воздух охлаждается, водяной пар снова превращается в капли воды, которые образуются на стенках и верхней части банки в виде конденсата. По мере того, как образуется больше конденсата, вода начинает слипаться, образуя все большие и большие капли, которые в конечном итоге становятся слишком тяжелыми. Затем гравитация тянет их вниз по стенкам банки в виде осадков.
Затем гравитация тянет их вниз по стенкам банки в виде осадков.
3. Сделайте самодельный измеритель дождя
Помимо демонстрации процесса дождя, вы также можете измерить количество дождя, выпадающего за определенный период времени, с помощью самодельных мер дождя. Сделать меру дождя очень просто, все, что вам нужно, это переработанная пластиковая бутылка (бутылки из-под молока идеально подходят для этого) или старая банка из-под варенья.
Если вы используете какую-либо бутылку, первое, что вам нужно сделать, это аккуратно отрезать верхнюю половину. Если вы используете обычную бутылку, вы можете перевернуть верхнюю часть бутылки вверх дном и поместить ее на нижнюю половину бутылки, чтобы она служила воронкой для сбора дождевой воды. Однако, если вы используете молочную бутылку, верхняя часть вам не понадобится, поэтому вы можете либо переработать ее, либо использовать для другого занятия или поделки.
Затем вам понадобится ручка, которая будет писать на поверхности вашего контейнера (например, несмываемый маркер( и мерный кувшин. Вам понадобится мерный кувшин, чтобы налить 100 мл воды в меру дождя. Когда вода осядет, отметьте уровень воды с линией и номером Затем добавьте еще 100 мл в банку и отметьте новый уровень воды как 200 мл и т. д. и т. д., пока вы не отметите от 100 мл до 500 мл на боковой стороне бутылки
Вам понадобится мерный кувшин, чтобы налить 100 мл воды в меру дождя. Когда вода осядет, отметьте уровень воды с линией и номером Затем добавьте еще 100 мл в банку и отметьте новый уровень воды как 200 мл и т. д. и т. д., пока вы не отметите от 100 мл до 500 мл на боковой стороне бутылки
Вы можете оставить Измерьте уровень дождя просто или украсьте его ручкой, краской или наклейками. Он сразу готов к использованию. Просто разместите его на улице и подождите, пока пойдет дождь. Затем вы сможете проверять уровень воды и отслеживать, сколько дождя выпало каждый день. это также хорошая возможность поговорить о круговороте воды и о том, как вода перемещается в непрерывном цикле между поверхностью земли и атмосферой 9.0005
4. Проведите эксперимент с поверхностью листа
Листья большинства растений либо отталкивают воду, либо удерживают ее. Листья, поверхность которых отталкивает воду, называются гидрофобными. Для некоторых растений эта способность отталкивать воду является важным механизмом выживания, поскольку избыток влаги может создать идеальную среду для роста вредных грибков, бактерий и плесени.
Для других растений использование листьев для удержания и направления воды является не менее важной стратегией выживания, поскольку это позволяет им собирать воду в районах, где дожди выпадают реже, или поглощать любые питательные вещества, растворенные в дождевой воде. Листья, поверхность которых удерживает воду, называются гидрофильными.
Способность отталкивать или удерживать воду в основном обусловлена тремя основными элементами строения листьев: кутикулой (защитный слой на листе), наличием любых волосков и формой листьев.
Листья с безволосой восковой кутикулой и наклонной поверхностью очень хорошо отталкивают воду, так как дождь соскальзывает прямо с водонепроницаемой восковой поверхности. Восковидная кутикула также защищает растение от жары, насекомых, УФ-излучения и патогенов. . Многие растения тропических лесов используют эту стратегию, чтобы выжить во влажном климате.
У пустынных растений, однако, более вероятно наличие волосистой восковой кутикулы, тонкий слой волосков на кутикуле помогает удерживать поверхностную воду, а также создает пограничный слой, который сохраняет лист более прохладным, чем окружающий воздух. Сохранение листа более прохладным, чем окружающий воздух, помогает как удержанию воды, так и химическому процессу фотосинтеза.
Сохранение листа более прохладным, чем окружающий воздух, помогает как удержанию воды, так и химическому процессу фотосинтеза.
Вы можете изучить и продемонстрировать гидрофобные и гидрофильные свойства листьев с помощью двух простых научных экспериментов. Для первого эксперимента вам просто нужно капнуть или брызнуть водой на листья разных растений (пока они прикреплены к растению) и наблюдать, что происходит с водой: остается ли она на листе или сразу скатывается?
Для второго научного эксперимента вы можете весело провести время, создавая и тестируя различные поверхности, чтобы увидеть, являются ли они гидрофобными и гидрофильными. Для этого вам понадобится кусок картона, восковые мелки, краска, ткань и некоторые искусственные или натуральные материалы. Сначала разметьте области на карточке (мы сделали наши области в форме листа), а затем нанесите или приклейте другой материал к каждой области.
Затем капните или побрызгайте водой на поверхность каждого материала и посмотрите, что произойдет. Наконец, попробуйте еще раз тот же эксперимент, но на этот раз слегка наклоните доску, прежде чем наносить воду, чтобы вы могли наблюдать, с каких поверхностей вода соскальзывает на этот раз.
Наконец, попробуйте еще раз тот же эксперимент, но на этот раз слегка наклоните доску, прежде чем наносить воду, чтобы вы могли наблюдать, с каких поверхностей вода соскальзывает на этот раз.
5. Проведите эксперимент с формой листа
Вы также можете провести эксперимент с формой листа, чтобы изучить, как растения либо направляют воду от себя к земле, где она может быть поглощена корнями, либо к ним и стеблю, где она может собирать в магазинах для непосредственного поглощения растением. Все, что вам понадобится для этого эксперимента, — это две картонные трубки (хорошо подойдет кухонная или рулон туалетной бумаги) и немного картона, чтобы вырезать его в форме листьев.
Первый набор листьев нужно слегка согнуть пополам, а затем прикрепить к трубкам под прямым углом, чтобы вода, падающая на листья, скатывалась вниз к центру трубки, которая является стеблем растения. Второй набор листьев также нужно немного согнуть пополам, но на этот раз их нужно прикрепить под углом вниз, чтобы вода, падающая на них, скатилась с конца листа и от трубки, которая является стеблем растения. .
.
6. Создайте искусство дождя и наблюдайте за воздействием капель дождя
Когда дождь падает и падает, он воздействует на поверхность, вызывая эрозию поверхности, перемещая или рассеивая частицы поверхности. Иногда это происходит медленно, в течение столетий, как вы можете видеть на примере выветривания каменных поверхностей, в других случаях это происходит мгновенно, как вы можете видеть на примере грязевых оползней и внезапных наводнений.
Вы можете наблюдать, как капли дождя воздействуют на поверхность, просто покрасив кусок переработанного картона (для этого идеально подходит внутренняя часть коробок с хлопьями) нетоксичной плакатной или акварельной краской, а затем поместив картину на улицу под дождь, пока краска еще мокрая. Вам нужно оставить картину на 10 минут или около того, чтобы увидеть эффект. Если вы оставите это слишком долго, картон может стать слишком влажным и распасться.
Дождь вытесняет частицы краски так же, как частицы почвы. Вы можете видеть, как дождь разъедает поверхность картины, смывая ее точно так же, как верхний слой почвы смывается с поверхности пейзажа.
7. Провести эксперимент по эрозии почвы
Знаете ли вы, что почва живая? Одна чайная ложка здоровой почвы может содержать более 100 миллионов микроорганизмов, и четверть всех видов Земли обитает в почве. Здоровая почва также предотвращает затопление и хранит огромные объемы углерода, препятствуя его утечке в атмосферу. Удивительно, но только в земной почве содержится больше углерода, чем во всей атмосфере, а также в деревьях и растениях мира вместе взятых.
Мы воспринимаем почву как должное, однако 95% нашего производства продуктов питания зависит от нее, особенно верхний слой почвы, для формирования которого требуется невероятно много времени. Всего 2 см верхнего слоя почвы могут формироваться в течение 500-1000 лет, и тем не менее мы разрушаем его в 10-40 раз быстрее, чем его можно восполнить. По оценкам Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО), 33% почв в мире деградировали из-за интенсивного земледелия, загрязнения и потери местных деревьев и растений.
Почва, не покрытая растительностью, особенно уязвима для загрязнения, эрозии и затопления. Вы можете продемонстрировать это с помощью простого эксперимента по эрозии почвы. Для этого эксперимента вам понадобятся три переработанных пластиковых бутылки, три переработанных прозрачных горшка или контейнера, веревка, почва, опавшие листья и растение, которое выросло или растет в небольшом горшке.
Сначала вам нужно положить бутылки, а затем отрезать почти все верхние стороны, чтобы превратить их в контейнеры в виде кашпо. Затем вам нужно поместить почву в две бутылки, оставьте одну пустой, а другую полностью засыпьте опавшими листьями. Теперь осторожно удалите растение со всей землей, прикрепленной к его корням, и поместите его в последнюю бутылку.
Затем осторожно проткните отверстия с каждой стороны пластиковых горшков или контейнеров, затем проденьте и завяжите веревку через каждое отверстие, чтобы получилась петля, с помощью которой вы сможете повесить горшки на горлышках бутылок. Теперь ваш эксперимент готов к запуску. Лучше всего использовать лейку для имитации дождя, но если у вас ее нет под рукой, подойдет и небольшой кувшин.
Теперь ваш эксперимент готов к запуску. Лучше всего использовать лейку для имитации дождя, но если у вас ее нет под рукой, подойдет и небольшой кувшин.
Вода из бутылки с растением должна быть самой чистой и протекать медленнее, потому что растение покрывает поверхность почвы, защищая ее от дождя, а корни растения также скрепляют почву, предотвращая дальнейшее эрозия и перемещение частиц почвы.
Вода из бутылки, покрытая опавшими листьями, будет содержать больше частиц почвы и течь быстрее, так как, хотя опавшие листья обеспечивают некоторую защиту от воздействия дождя, сама почва не связана корнями. Последняя бутылка с голой почвой должна течь быстрее всего и содержать наибольшее количество частиц почвы, вы даже можете получить мини-внезапный паводок, поскольку вода смывает большое количество почвы. Это показывает, что голая почва без растений наиболее уязвима для эрозии и внезапных наводнений.
Это показывает, что голая почва без растений наиболее уязвима для эрозии и внезапных наводнений.
8. Проведите красочный эксперимент с капиллярным действием
Капиллярное действие — хитроумный трюк, который используют растения для транспортировки воды от корней вверх по стеблю и к остальным частям растения. Чтобы транспортировать воду, растение сначала должно преодолеть гравитацию, создавая силы, которые тянут воду вверх и сквозь растение. Этими силами являются адгезия (сила, которая притягивает жидкость к поверхности), сцепление и поверхностное натяжение, которые связывают жидкость вместе.
Вы можете увидеть эти силы в действии, если поместите капли воды на плоскую пластиковую поверхность. Капли образуют маленькие круглые пузырьки воды, сохраняющие свою форму (сплоченность и поверхностное натяжение в действии), а не сплющиваются, растекаются и сливаются друг с другом. Если вы кладете бумажное полотенце, просто касаясь капли, оно прилипает к поверхности бумажного полотенца, и три силы вместе перемещают воду из пластика на бумажное полотенце.
Этот эксперимент — очень простой и увлекательный способ показать, как эти три силы действуют на стебель растения. Все, что вам нужно, это несколько основных бумажных кухонных полотенец, вода, чашки и пищевой краситель (столько цветов, сколько вам нравится). Сначала вам нужно сделать бумажные цветы из кухонных полотенец. Сложите одно полотенце пополам, чтобы получился прямоугольник (1.), а затем еще раз пополам, чтобы получился квадрат (2.) Затем сложите его по диагонали пополам, чтобы получился треугольник (3.) Сложите треугольник по диагонали еще раз пополам (4. ) Теперь аккуратно обрежьте верхнюю часть треугольника, придав ей кончик лепестка. (5.)
Разверните треугольник, и у вас должна получиться красивая плоская форма цветка. (6.) Сожмите и скрутите середину цветка, а края и лепестки втяните внутрь, чтобы сделать цветок трехмерным. Теперь нужно добавить стебель. Разрежьте лист бумажного полотенца пополам, а затем сверните и скрутите полотенце, чтобы получился стебель. Прикрепите стебель к головке цветка скотчем. Вуаля, теперь у вас есть первый цветок для вашего эксперимента. Вы можете сделать столько цветов, сколько захотите.
Прикрепите стебель к головке цветка скотчем. Вуаля, теперь у вас есть первый цветок для вашего эксперимента. Вы можете сделать столько цветов, сколько захотите.
Далее вам нужно смешать пищевые красители разных цветов с водой в переработанных чашках или контейнерах. (Имейте в виду, что пищевой краситель может окрасить одежду, поверхности и руки). Затем поместите концы цветочных стеблей в чашки и опустите середину стеблей за край, чтобы головка вашего цветка опиралась на землю (на открытом воздухе) или на поднос (в помещении). Затем наблюдайте, как происходит волшебство, когда цветная вода начинает двигаться вверх по стеблю растения через край чаши и вниз к головке цветка. Это капиллярное действие в движении.
Когда вы закончите свой эксперимент, вы можете разложить цветы из бумажных полотенец сушиться на подносе. Возможно, вам придется изменить форму цветочных головок, когда они высохнут. В итоге у вас должен получиться красивый красочный букет из бумажных цветов. Вы можете использовать свои цветы в качестве украшений, сюжетных реквизитов, в ролевых играх и играх или подарить их.
9. Эксперименты с температурой воды.
Знаете ли вы, что холодная вода плотнее теплой? Холодная вода океана опускается на дно, а теплая поднимается вверх. Это связано с тем, что, когда вы нагреваете вещество, молекулы ускоряются и немного расходятся, делая вещество менее плотным, и точно так же, когда вы охлаждаете вещество, молекулы замедляются и немного сближаются, делая его более плотным.
Вы можете продемонстрировать и изучить это с помощью простого эксперимента с плотностью. Для этого вам понадобятся 2 баночки (или стакана), теплая вода, холодная вода, пищевой краситель и пипетки или пипетки. Просто наполните одну банку теплой водой и одну банку холодной водой. Затем смешайте одну порцию пищевого красителя с теплой водой, а другую — с холодной.
Теперь попробуйте брызнуть холодной окрашенной водой в теплую банку и посмотреть, что произойдет. Холодная окрашенная вода должна опуститься на дно банки. Теперь попробуйте впрыснуть теплую окрашенную воду в банку с холодной водой и понаблюдайте, что произойдет.

 03.2022
03.2022 Здоровье
Здоровье