Три стадии стресса по Селье: тревога, сопротивление, истощение
Просмотров: 220252 Опубликовано: / Обновлено:
- Стресс
Общие сведения
Стресс — одно из нормальных состояний организма, поскольку связан с повышением адаптационных механизмов. Стресс является неотъемлемым проявлением жизни. Стрессовые реакции филогенетически помогали человеку справляться с трудностями, поэтому в этом аспекте стрессовые реакции полезны. Однако, когда стресс имеет яркое выражение и длительное проявление, в таком случае он причиняет вред здоровью человека.
Виды стресса
По типу воздействия стресс бывает системным и психическим. Системный стресс отражает ответную реакцию организма на травмы, воспаление, инфекции и проч. Психический стресс сначала вызывает изменения в психо-эмоциональной сфере, а затем проявляется на биологическом уровне.
Психический стресс сначала вызывает изменения в психо-эмоциональной сфере, а затем проявляется на биологическом уровне.
Наблюдения Селье
Ганс Селье считается родоначальником теории биологического стресса. Модель общего адаптационного синдрома Ганса Селье представляет чёткое биологическое объяснение того, как организм реагирует и приспосабливается к стрессу.
В своих исследованиях Селье заметил, что организм приспосабливается к внешним стрессорам с точки зрения биологической модели, которая пытается восстановить и сохранить внутренний баланс. В своей попытке сохранить гомеостаз организм использует гормональную ответную реакцию, которая непосредственно осуществляет борьбу со стрессором. Борьба организма против стресса является главной темой общего адаптационного синдрома.
Еще одно наблюдение, которое обнаружил Селье, заключалось в том, что стрессовые реакции имеют свои пределы. Ограниченный запас энергии организма для адаптации к стрессовой среде истощается, когда организм постоянно подвергается воздействию стрессора.
Три фазы стрессовой реакции
Общий адаптационный синдром — это модель, которая состоит из трёх элементов или фаз, которые описывают реакцию организма на стресс:
1. Стадия тревоги
На стадии реакции тревоги, сигнал бедствия посылается в часть мозга, которая называется гипоталамус. Гипоталамус обеспечивает высвобождение гормонов, называемых глюкокортикоидами.
Глюкокортикоиды запускают выброс адреналина и кортизола. Адреналин дает человеку заряд энергии: сердечный ритм увеличивается, кровяное давление повышается, уровень сахара крови также повышается. Эти физиологические изменения регулируются частью вегетативной нервной системы человека, называемой симпатической ветвью.
Надпочечники начинают активно вырабатывать повышенное количество кортизола и находятся в состоянии гиперфункции. Это состояние можно подтвердить, используя паттерн изменений в гормональном профиле слюны, при котором будут следующие показатели: повышенный уровень кортизола/нормальный уровень DHEA.
2. Стадия сопротивления
Во время стадии сопротивления организм пытается противодействовать физиологическим изменениям, которые произошли во время стадии реакции тревоги. Стадия сопротивления регулируется частью вегетативной нервной системой, которая называется парасимпатической.
Парасимпатическая нервная система пытается вернуть тело в норму: уменьшается количество вырабатываемого кортизола, частота сердечных сокращений и артериальное давление начинают возвращаться к норме. Уровень сопротивляемости организма значительно выше обычного. На этой стадии осуществляется сбалансированное расходование адаптационных ресурсов.
Если стрессовая ситуация заканчивается, на этапе сопротивления тело возвращается в нормальное состояние. Однако, если стрессогенный фактор остаётся, организм остаётся настороже, чтобы бороться с его проявлениями.
Надпочечники адаптируются к этой стадии, уже используя механизм, называемый «захват прегненолона». Прегненолон является метаболитом холестерина и представляет собой исходное химическое вещество для производства как кортизола, так и половых гормонов, включая тестостерон.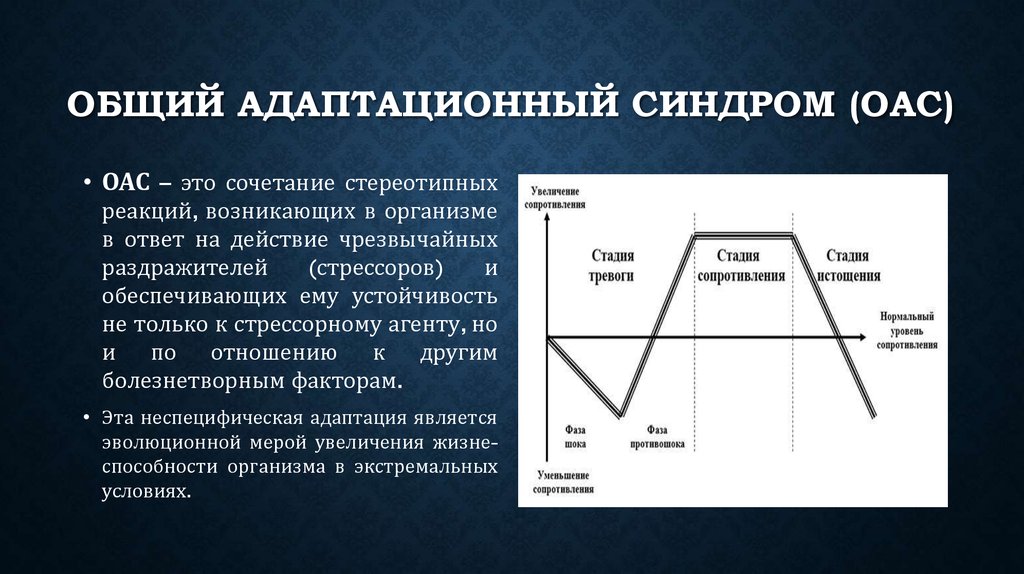 При изменении метаболизма прегненолона, уровень тестостерона, вырабатываемого в организме, снижается. При этой стадии, паттерн гормонального профиля в слюне будет представлен следующими показателями: повышенный уровень кортизола/низкий уровень DHEA.
При изменении метаболизма прегненолона, уровень тестостерона, вырабатываемого в организме, снижается. При этой стадии, паттерн гормонального профиля в слюне будет представлен следующими показателями: повышенный уровень кортизола/низкий уровень DHEA.
На этом этапе стресс сохраняется в течение длительного периода. Организм начинает терять способность бороться со стрессором и уменьшать его вредное воздействие, поскольку истощается вся адаптивная способность. Стадия истощения может приводить к стрессовым перегрузкам и к проблемам со здоровьем, если они не будут решены немедленно.
В этой стадии надпочечники больше не способны адаптироваться к стрессу и исчерпали свои функциональные возможности. Сначала при исследовании гормонального профиля в слюне будут выявляться нормальный уровень кортизола/низкий уровень DHEA (или уровень кортизола, характерный для гиперфункции и сниженной функции будет сочетаться с нормальным уровнем DHEA). Когда надпочечники исчерпают свои возможности, будут определяться: низкий уровень кортизола/низкий уровень DHEA.
Если стресс продолжает воздействовать и далее, истощаются запасы кофакторов, которые необходимы для производства кортизола, вследствие чего организм разрывает механизм шунтирования прегненолона и вновь переключается на выработку DHEA. Такой паттерн будет представлен низким уровнем кортизола/нормальным уровнем DHEA.
Три стадии стресса
Стресс— одно из нормальных состояний организма, поскольку связан с повышением адаптационных механизмов. Стресс является неотъемлемым проявлением жизни. Стрессовые реакции филогенетически помогали человеку справляться с трудностями, поэтому в этом аспекте стрессовые реакции полезны. Однако, когда стресс имеет яркое выражение и длительное проявление, в таком случае он причиняет вред здоровью человека.
Наблюдения Селье
Ганс Селье считается родоначальником теории биологического стресса. В своих исследованиях Селье заметил, что организм приспосабливается к внешним стрессорам с точки зрения биологической модели, которая пытается восстановить и сохранить внутренний баланс. В своей попытке сохранить гомеостаз организм использует гормональную ответную реакцию, которая непосредственно осуществляет борьбу со стрессором.
В своей попытке сохранить гомеостаз организм использует гормональную ответную реакцию, которая непосредственно осуществляет борьбу со стрессором.
Три фазы стрессовой реакции
1. Стадия тревоги
На стадии реакции тревоги, сигнал бедствия посылается в часть мозга, которая называется гипоталамус. Гипоталамус обеспечивает высвобождение гормонов, называемых глюкокортикоидами.
Глюкокортикоиды запускают выброс адреналина и кортизола. Адреналин дает человеку заряд энергии: сердечный ритм увеличивается, кровяное давление повышается, уровень сахара крови также повышается. Эти физиологические изменения регулируются частью вегетативной нервной системы человека, называемой симпатической ветвью.
Надпочечники начинают активно вырабатывать повышенное количество кортизола и находятся в состоянии гиперфункции. Это состояние можно подтвердить, используя паттерн изменений в гормональном профиле слюны, при котором будут следующие показатели: повышенный уровень кортизола/нормальный уровень DHEA.
2. Стадия сопротивления
Во время стадии сопротивления организм пытается противодействовать физиологическим изменениям, которые произошли во время стадии реакции тревоги. Стадия сопротивления регулируется частью вегетативной нервной системой, которая называется парасимпатической.
Парасимпатическая нервная система пытается вернуть тело в норму: уменьшается количество вырабатываемого кортизола, частота сердечных сокращений и артериальное давление начинают возвращаться к норме. Уровень сопротивляемости организма значительно выше обычного. На этой стадии осуществляется сбалансированное расходование адаптационных ресурсов.
Если стрессовая ситуация заканчивается, на этапе сопротивления тело возвращается в нормальное состояние. Однако, если стрессогенный фактор остаётся, организм остаётся настороже, чтобы бороться с его проявлениями.
Надпочечники адаптируются к этой стадии, уже используя механизм, называемый «захват прегненолона». Прегненолон является метаболитом холестерина и представляет собой исходное химическое вещество для производства как кортизола, так и половых гормонов, включая тестостерон. При изменении метаболизма прегненолона, уровень тестостерона, вырабатываемого в организме, снижается. При этой стадии, паттерн гормонального профиля в слюне будет представлен следующими показателями: повышенный уровень кортизола/низкий уровень DHEA.
При изменении метаболизма прегненолона, уровень тестостерона, вырабатываемого в организме, снижается. При этой стадии, паттерн гормонального профиля в слюне будет представлен следующими показателями: повышенный уровень кортизола/низкий уровень DHEA.
3. Стадия истощения
На этом этапе стресс сохраняется в течение длительного периода. Организм начинает терять способность бороться со стрессором и уменьшать его вредное воздействие, поскольку истощается вся адаптивная способность. Стадия истощения может приводить к стрессовым перегрузкам и к проблемам со здоровьем, если они не будут решены немедленно.
В этой стадии надпочечники больше не способны адаптироваться к стрессу и исчерпали свои функциональные возможности. Сначала при исследовании гормонального профиля в слюне будут выявляться нормальный уровень кортизола/низкий уровень DHEA или уровень кортизола, характерный для гиперфункции и сниженной функции будет сочетаться с нормальным уровнем DHEA). Когда надпочечники исчерпают свои возможности, будут определяться: низкий уровень кортизола/низкий уровень DHEA.
Когда надпочечники исчерпают свои возможности, будут определяться: низкий уровень кортизола/низкий уровень DHEA.
Если стресс продолжает воздействовать и далее, истощаются запасы кофакторов, которые необходимы для производства кортизола, вследствие чего организм разрывает механизм шунтирования прегненолона и вновь переключается на выработку DHEA. Такой паттерн будет представлен низким уровнем кортизола/нормальным уровнем DHEA.
Гормоны стресса.
Адреналин: регулирует частоту сердечных сокращений;
регулирует поступление воздуха в легкие;
влияет на диаметр кровеносных сосудов и бронхов.
Кортизол: повышает уровень сахара в крови;
подавляет иммунную систему;
ускоряет метаболизм.
Самые важные гормоны формирующие стрессовую реакцию – это адреналин и норадреналин. Их синтезирует симпатическая нервная система. Другой важный класс гормонов реакции на стресс называют глюкокортикоидами, из них наиболее известен гормон кортизол.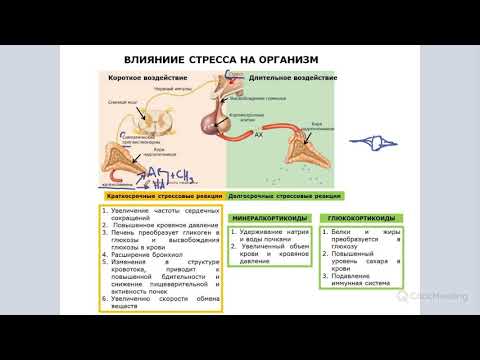 Кортизол помогает организму выстоять в стрессовой ситуации. Повышенный уровень кортизола может быть связан не только с явной опасностью для человека, но и с некоторыми изменениями в условиях жизни, которые организм воспринимает как опасность. Иногда самые благие намерения, например, занятие спортом, «здоровое» питание могут привести к нервному срыву. Но перед этим, был хронический стресс, который игнорировался. Избыточные физические нагрузки, недостаток качественного питания (диеты, недоедания), недостаток сна, злоупотребление алкоголем, эндокринные нарушения могут привести к дистрессу («плохому стрессу».
Кортизол помогает организму выстоять в стрессовой ситуации. Повышенный уровень кортизола может быть связан не только с явной опасностью для человека, но и с некоторыми изменениями в условиях жизни, которые организм воспринимает как опасность. Иногда самые благие намерения, например, занятие спортом, «здоровое» питание могут привести к нервному срыву. Но перед этим, был хронический стресс, который игнорировался. Избыточные физические нагрузки, недостаток качественного питания (диеты, недоедания), недостаток сна, злоупотребление алкоголем, эндокринные нарушения могут привести к дистрессу («плохому стрессу».
Группа глюкокортикоидных гормонов вырабатывается надпочечниками, и их действие часто похоже на действие адреналина. Адреналин начинает действовать в течение нескольких секунд, а глюкокортикоиды поддерживают его действие от нескольких минут до нескольких часов. Управление гормонами находится в зоне ответственности головного мозга.
Во время стресса поджелудочная железа начинает вырабатывать гормон глюкагон. Коктейль из глюкокортикоидов, глюкагона и секреции симпатической нервной системы повышает уровень глюкозы в крови. Глюкоза обеспечивает необходимую для реакции на стресс энергией. Активируются также и другие гормоны. Гипофиз вырабатывает пролактин, который кроме других эффектов способствует угнетению во время стресса репродуктивной функции. Гипофиз и мозг также вырабатывают особый класс эндогенных морфиноподобных веществ эндорфинов и энкефалинов, которые, среди всего прочего, притупляют ощущение боли. Наконец, гипофиз вырабатывает вазопрессин, гормон регулирующий уровень жидкости в организме, играющий важную роль в реакции сердечно-сосудистой системы на стресс. Вазопрессин поддерживает водный гомеостаз внутри организма, который необходим для жизни.
Коктейль из глюкокортикоидов, глюкагона и секреции симпатической нервной системы повышает уровень глюкозы в крови. Глюкоза обеспечивает необходимую для реакции на стресс энергией. Активируются также и другие гормоны. Гипофиз вырабатывает пролактин, который кроме других эффектов способствует угнетению во время стресса репродуктивной функции. Гипофиз и мозг также вырабатывают особый класс эндогенных морфиноподобных веществ эндорфинов и энкефалинов, которые, среди всего прочего, притупляют ощущение боли. Наконец, гипофиз вырабатывает вазопрессин, гормон регулирующий уровень жидкости в организме, играющий важную роль в реакции сердечно-сосудистой системы на стресс. Вазопрессин поддерживает водный гомеостаз внутри организма, который необходим для жизни.
В ответ на стресс активируются некоторые железы, а различные гормональные системы во время стресса угнетаются. Снижается секреция различных гормонов репродуктивной системы, таких как эстроген, прогестерон и тестостерон. Выработка гормонов, связанных с функцией роста (например, гормона соматотропин), также угнетается, как и выработка инсулина, гормона поджелудочной железы, который в нормальных условиях помогает телу накапливать энергию, чтобы использовать ее позже.
Эти научные факты говорят о прямой связи между эмоциональным состоянием и такими заболеваниями как сахарный диабет, нарушения функционирования репродуктивной системы, сердечно-сосудистых заболеваний, различных зависимостей.
В современном мире люди ежедневно сталкиваются с огромным количеством стрессовых ситуаций. Любая из них может стать последней каплей и спровоцировать депрессию. Знать о том, как лечится стресс, необходимо: психотерапия, физическая активность, релаксация, здоровый сон и правильно питание. Взращивайте дух, чтобы не бояться душевной, физической и материальной боли, учитесь хорошо зарабатывать, занимайтесь спортом, будьте здоровы!
Ведущий лаборант кафедры
функциональной диагностики Малаховская С.Н.
| ||||||||||||||||||||||||||||||
Авторизация
| ||||||||||||||||||||||||||||||
| | ||||||||||||||||||||||||||||||
| |
Группа «Физиология стресса и адаптации растений» |
| ||||||||||||||||||
| ||||
Заведующий кафедрой
Секретарь
|
СТРЕСС И ДИСТРЕСС — Новооскольская центральная районная больница
СТРЕСС И ДИСТРЕСС
В переводе с английского «стресс» — это «напряжение, давление, нажим». Его вызывают холод, жара, негативная информация, нанесенная обида, сильные эмоции вообще. Известный канадский биохимик Ганс Селье сформулировал понятие стресса как «неспецифичный ответ организма на любое предъявленное ему требование». Стресс сам по себе явление повседневное. Состояние стресса можно определить, как появление необходимости разрешить возникшую ситуацию и адаптироваться в новых условиях. Так можно ли жить без стресса? Ответ один – нельзя. Жизнь это постоянный источник изменений, и приспосабливаться к новым условиям нам приходится каждый день.
Известный канадский биохимик Ганс Селье сформулировал понятие стресса как «неспецифичный ответ организма на любое предъявленное ему требование». Стресс сам по себе явление повседневное. Состояние стресса можно определить, как появление необходимости разрешить возникшую ситуацию и адаптироваться в новых условиях. Так можно ли жить без стресса? Ответ один – нельзя. Жизнь это постоянный источник изменений, и приспосабливаться к новым условиям нам приходится каждый день.
Центром социальной и судебной психиатрии им. Сербского проводится ежегодный мониторинг населения России по общему количеству больных психическими заболеваниями и числу вновь выявленных. Кривая этих показателей неуклонно растет. В абсолютных цифрах на 100 тысяч населения психически больны 3 тысячи взрослых людей и 4 тысячи подростков. Такая статистика дает повод задуматься: как мы живем, что необходимо изменить, чтобы временные конфликты, неприятности и стрессы не привели к нарушению работы внутренних органов и психическим заболеваниям.
В жизни мы все чаще сталкиваемся с эмоциональным или психосоциальным стрессом, вызванным сильной эмоциональной реакцией человека на нестандартные личные и социальные обстоятельства. Обычно стресс возникает в условиях конфликтных ситуаций. Как правило, в таких случаях мы мобилизируем свои силы для того, чтобы разрешить проблему.
Стрессорная реакция является не только психическим, но и физиологическим ответом на изменение ситуации. Встречаясь с опасностью, человек начинает чаще дышать, его сердце бьется в ускоренном темпе. Это связано с действием выброшенного в кровь гормона – адреналина. В результате происходит перераспределение крови: от кожи и органов она оттекает к мышцам, подготавливая их к бою. Кроме этого, происходит повышение в крови уровня глюкозы (основного источника энергии), начинается распад жира – энергетического запаса организма, увеличивается свертываемость крови на случай травм. Поэтому стресс часто называют реакцией «бей или беги» (бук. от английского fight-or-flight) и направлена она на то, чтобы избежать неприятностей. Если это вовремя удается сделать, то организм быстро адаптируется без вреда для здоровья.
Если это вовремя удается сделать, то организм быстро адаптируется без вреда для здоровья.
Стрессы бывают эмоционально положительные и отрицательные, кратковременные и продолжительные.
Положительные стрессы (например: рождение ребенка, свадьба, поступление в институт и т.д.) обогащают и украшают нашу жизнь. В таком случае организм сам регулирует работу всех жизненно важных органов и продолжает функционировать в нормальном режиме после эмоционального взрыва. Такое нервное напряжение даже полезно, потому что мобилизует умственные и физические возможности, повышает самооценку и уверенность в себе.
Отрицательные стрессы.
Кратковременные отрицательные стрессы (например: напугала собака, грянул гром и т.д.) можно считать безвредными, если нет тяжелых заболеваний сердечно-сосудистой системы.
Длительный отрицательный стресс, дистресс является причиной возникновения многих заболеваний. Особенно вредны подавленные, невыраженные негативные чувства.
ЧТО ТАКОЕ ДИСТРЕСС
Если стресс продолжительный, неконтролируемый, то у организма нет возможности нормализовать уже активированные процессы и физиологические изменения в организме могут нанести вред здоровью. Скандалы в семье, материальные проблемы, потеря работы, или близких людей могут быть причиной длительного стресса на долгие месяцы, и даже годы. Опасным для психического и физического здоровья человека является продолжительный, хронический стресс или дистресс.
Такой стресс возникает в результате затяжных конфликтных ситуаций, когда отрицательные эмоции переходят в форму «застойного» возбуждения структур мозга и нарушаются основные биоритмы организма: сон, и гормональные функции, механизм саморегулирования отдельных наиболее ослабленных функциональных систем организма.
В результате длительных стрессов развиваются неврозы, психозы, алкоголизм, нарушения сердечной деятельности, артериальная гипертензия, язвенные поражения желудочно-кишечного тракта. Эти тяжелые последствия усугубляются, если существует склонность к злоупотреблению курением и алкоголем. Возможны даже такие критические исходы, как инфаркт миокарда и инсульт.
Эти тяжелые последствия усугубляются, если существует склонность к злоупотреблению курением и алкоголем. Возможны даже такие критические исходы, как инфаркт миокарда и инсульт.
Как распознать надвигающийся дистресс
Если в Вашей жизни происходят неприятные события, которые могут привести к дистрессу, и Вы встревожены своим состоянием, то постарайтесь прислушаться к себе и определить наличие симптомов надвигающегося дистресса:
Ø Переедание или потеря аппетита
Ø Увеличение количества выкуренных сигарет и доз спиртных напитков
Ø Бессонница, апатия
Ø Повышенная раздражительность и беспокойство
Ø Отсутствие чувства юмора
Ø Потеря интереса к сексуальным отношениям
Ø Забывчивость, трудности при выполнении привычной работы
Ø Отсутствие потребности общения с подругами, друзьями
Ø Необоснованная ревность и подозрения.
На фоне дистресса у Вас может ухудшиться самочувствие:
v Головная боль
v Необъяснимая усталость
v Боль в области сердца
v Снижение работоспособности
v Повышение артериального давления
v Дрожь и озноб
v Повышенная потливость
v Нехватка воздуха
v Тошнота
v Мышечная боль
Если указанные признаки имеют место, то очевидно, что в Вашей жизни происходят негативные явления, и Вы не можете быстро и правильно на них отреагировать. Это может быть длительный конфликт на работе или вынужденное расставание с близким человеком. Чтобы исправить ситуацию, надо принимать экстренные меры, и начинать следует с самых доступных средств.
Это может быть длительный конфликт на работе или вынужденное расставание с близким человеком. Чтобы исправить ситуацию, надо принимать экстренные меры, и начинать следует с самых доступных средств.
В качестве метода экспресс — диагностики может быть рекомендована шкала Ридера для самооценки уровня стресса.
Утверждение | Да, согласен | Скорее согласен | Скорее не согласен | Нет, не согласен |
1. Пожалуй, я человек нервный
| 1 | 2 | 3 | 4 |
2.
| 1 | 2 | 3 | 4 |
3. Я часто ощущаю нервное напряжение
| 1 | 2 | 3 | 4 |
4. Моя повседневная деятельность вызывает большое напряжение
| 1 | 2 | 3 | 4 |
5.
| 1 | 2 | 3 | 4 |
6. К концу дня я совершенно истощен физически и психически
| 1 | 2 | 3 | 4 |
7. В моей семье часто возникают напряженные отношения
| 1 | 2 | 3 | 4 |
Оцените свое состояние по таблице уровня психического стресса по среднему баллу (сложите все баллы и разделите на 7).
Уровень стресса | Средний балл | |
Мужчины | Женщины | |
высокий | 1 — 2 | 1 – 1,82 |
средний | 2,01 — 3 | 1,83 – 2,82 |
низкий | 3,01 — 4 | 2,83 — 4 |
Для того, что бы стрессовая ситуация не превратилась в дистресс, необходимо проанализировать ее и решить, что можно предпринять для того, что бы приобрести душевное равновесие.
1. Дайте выход агрессии: разбейте старые бутылки, порвите ненужные журналы, напишите письмо обидчику, в котором выплесните все свои эмоции, а заем порвите его.
2. Побалуйте себя: купите себе то, о чем давно мечтали, приготовьте себе любимое блюдо, бросьте домашние дела и поиграйте с детьми, идите в театр, организуйте пикник.
3. Приведите в порядок свой рацион. Небольшие порции богатой углеводами пищи способствует выработке гормона счастья — серотонина.
4. Постарайтесь успокоиться. Во время обеденного перерыва сходите в парк, посидите на скамейке или пройдитесь по аллее. Вечером примите теплую ванну, сделайте массаж, послушайте приятную успокаивающую музыку.
5. Будьте реалистами. Помните, что на смену неудачам обязательно придут счастливые дни. А может то, что произошло, и есть лучший выход из сложившийся ситуации?
6. Постарайтесь иногда что-то пустить на самотек, невозможно постоянно все контролировать.
7. Поговорите о своих проблемах с близким человеком. Это поможет Вам понять их суть, получить совет от тех, кто любит Вас и почувствовать, что Вы не одиноки.
Поговорите о своих проблемах с близким человеком. Это поможет Вам понять их суть, получить совет от тех, кто любит Вас и почувствовать, что Вы не одиноки.
Перечисленные примеры дадут Вам возможность получить передышку, расслабиться, успокоиться и уменьшить негативное действие дистресса на здоровье.
Как же уйти от длительного стресса или защититься от него? Что делать если Вы подвержены ему, если он угнетает Вас, выводит из строя нервную и сердечно-сосудистую систему, и все потому, что Вы попали в затяжную экстремальную ситуацию? Совет тут один: попытайтесь всеми силами приспособиться к изменившимся условиям, если они никак не зависят от Вас. Потеря любимой работы, конечно же, не только серьезный удар по вашему самолюбию, но и чувствительная утрата вчерашних, так необходимых для жизни материальных средств. Не отчаивайтесь! Постарайтесь найти любую другую работу, какой бы немилой она ни выглядела для вас. Сейчас важно «прокормить» себя, свою семью, а завтрашний день может открыть иные перспективы и возможности. Вера в будущее, борьба за будущее – ваше спасение. Паника, отчаяние, тоска, и чувство беспросветности – плохие попутчики.
Вера в будущее, борьба за будущее – ваше спасение. Паника, отчаяние, тоска, и чувство беспросветности – плохие попутчики.
Если вам не удается быстро справиться со сложной ситуацией и приходится долго пребывать в состоянии психоэмоционального, то все системы организма вынуждены работать с перегрузкой – возможно появление симптомов психологического истощения на фоне длительного стресса. В этот период характерны потеря контроля над собой, низкая самооценка, снижение интереса к работе и к другим ежедневным делам. У человека появляются безразличие, равнодушие, которые сопровождаются усталостью и упадком сил. Кажется, что ничто и никто не сможет вывести Вас из этого состояния.
Среди психосоциальных факторов наиболее значение для развития и прогрессирования сердечно-сосудистых заболеваний имеют депрессия и тревога.
| Нас сегодняшний день имеются научные доказательства, что длительные стрессы и психоневрологические расстройства являются самостоятельными факторами риска сердечно-сосудистых заболеваний, в первую очередь артериальной гипертонии и ишемической болезни сердца. |
КАК «СЖЕЧЬ» ЛИШНИЙ АДРЕНАЛИН
Если человеку не удается быстро справиться со сложной ситуацией и приходится долго пребывать в состоянии эмоционального напряжения, то все системы организма вынуждены работать с перегрузкой. Чтобы выдержать длительный стресс, необходимо иметь резервы здоровья, которые появляются только в результате длительных физических тренировок.
Стресс оказывает влияние на многие системы организма человека, в частности, на надпочечники, которые в состоянии нервного напряжения выделяют адреналин и норадреналин. По их воздействием повышается тревога, страх и острота восприятия, появляется раздражение и агрессия. Все эти процессы являются неотъемлемой частью острой реакции на стресс или угрозу.
Если человек физически тренирован, то его адаптационные силы справляются с кратковременной временной перегрузкой. Для того, чтобы выдержать длительный стресс, необходимо иметь хорошую физическую форму. Очень полезно владеть методами управления собой в критических ситуациях. Однако, многие из них направлены на подавление реакции на раздражение, а это лишает организм разрядки. Наукой доказано, что лучший способ нейтрализовать избыток выделившихся во время стресса гормонов (адреналина и норадреналина) является физическая нагрузка.
Очень полезно владеть методами управления собой в критических ситуациях. Однако, многие из них направлены на подавление реакции на раздражение, а это лишает организм разрядки. Наукой доказано, что лучший способ нейтрализовать избыток выделившихся во время стресса гормонов (адреналина и норадреналина) является физическая нагрузка.
Высокая концентрация адреналина и норадреналина оказывает повреждающее действие на сердце, что и наблюдается при стрессе. Избыток гормонов приводит к учащенному сердцебиению, и такая реакция может привести к тому, что у нетренированного человека сердце будет работать на пределе возможности. У людей, регулярно занимающихся оздоровительной физкультурой, частота сердечных сокращений низкая и даже в моменты эмоционального напряжения растет медленно за счет того, что сильное сердце за одно сокращение выбрасывает больше крови. Физические аэробные упражнения помогают смягчить стресс непосредственно в момент нервного напряжения. Для профилактики стресса полезными считаются аэробные упражнения в конце рабочего дня.
Физические нагрузки естественным образом в отличии от курения и алкоголя ослабляют действие адреналина и восстанавливают в организме состояние химического равновесия и этим помогают выдержать эмоциональные перегрузки.
Любая аэробная физическая нагрузка (бег, быстрая ходьба, плавание, аэробика и т.д.), которая дает положительный результат, усиливает чувство уверенности и снижает стресс. Упражнения должны быть длительными и интенсивными, но с соблюдением зоны безопасного пульса.
Нередко состояние душевного дискомфорта приводит к тому, что возникает привычка «заедать» стресс. Регулярные физические нагрузки в этом случае избавят Вас от проблем с лишним весом.
Многие физически активные люди во время и после аэробных тренировок испытывают чувство огромного удовлетворения или даже эйфории. Это объясняется усиленным выделением при напряженной физической активности гормона эндорфина. Повышенное содержание эндорфина в организме человека после завершения нагрузки сохраняется еще в течение 30 минут.
| Для любознательных! Эндорфины – вещества, которые синтезируются клетками головного мозга и обладают способностью уменьшать боль и влиять на эмоциональное состояние. Этот гормон называется «природным наркотиком» или «гормоном радости». Многие хронические заболевания, стресс, депрессия, синдром хронической усталости сопровождаются недостаточностью эндорфинов. Эндорфины обладают обезболивающим действием в экстремальной ситуации и нейтрализовать последствия выброса адреналина во время стресса и восстанавливают нормальную работу сердечно-легочной системы и других внутренних органов. |
КАК ПРОТИВОСТОЯТЬ ДЛИТЕЛЬНОМУ СТРЕССУ
РЕЛАКС-ТРЕНИНГ
Психическое состояние человека зависит от многих факторов, в частности от умения противостоять длительным стрессам. Эти методы помогут справиться с депрессией, плохим настроением, раздражительностью. Современная медицина уделяет большое внимание психологическим методам оздоровления человека. Врачи-психологи и психотерапевты профессионально помогут Вам выбрать индивидуальные методы нервно-мышечной и психологической релаксации в зависимости от вашего состояния и характера, стереотипов поведения. Значительный эффект приносит аутогенная тренировка. Она основана на использовании формулы самовнушения для достижения состояния релаксации.
Эти методы помогут справиться с депрессией, плохим настроением, раздражительностью. Современная медицина уделяет большое внимание психологическим методам оздоровления человека. Врачи-психологи и психотерапевты профессионально помогут Вам выбрать индивидуальные методы нервно-мышечной и психологической релаксации в зависимости от вашего состояния и характера, стереотипов поведения. Значительный эффект приносит аутогенная тренировка. Она основана на использовании формулы самовнушения для достижения состояния релаксации.
Релакс-тренинг – не только эффективное средство для нормализации общего состояния человека. Его можно по праву называть антистрессовой программой, своего рода учебным пособием для достижения сложнейшего искусства управления, владения собой в самых критических ситуациях.
Подберите оптимальный способ разрядки в зависимости от условий работы и образа жизни.
Упражнение 1
1. Начните считать от 10 до 1, на каждом счете делая вдох и медленный выдох. Выдох должен быть заметно длительнее вдоха.
Выдох должен быть заметно длительнее вдоха.
2. Закройте глаза. Снова посчитайте от 10 до 1, задерживая дыхание на каждом счете. Медленно выдыхайте, представляя, как с каждым выдохом уменьшается, и наконец, исчезает напряжение.
3. Не раскрывая глаз, считайте от 10 до 1. На этот раз представте, что выдыхаемый воздух окрашен в теплые, пастельные цвета. С каждым выдохом цветной туман сгущается, превращается в облако. Плывыти по ласковым облакам до тех пор, пока глаза не откроются сами.
4. Чтобы найти нужный ритм счета, дышите медленно и спокойно, не думая о всевозможных волнениях при помощи воображения. Этот метод очень хорошо ослабляет стресс. Через неделю начинайте считать от 20 до 1, еще через неделю от 30 до 1.
Правильное дыхание.
При стрессе мы совершаем быстрые, глубокие вдохи, часто сбиваемся – вздыхаем и задыхаемся. Что же делать и как правильно дышать в стрессовой ситуации? В противоположность описанному выше типу дыхания существует так называемое «абдоминальное» дыхание – дыхание с участием нашей главной дыхательной мышцы – диафрагмы. Его еще называют «дыхание животом». Такое дыхание всегда ровное, глубокое, и расслабление происходит само собой.
Его еще называют «дыхание животом». Такое дыхание всегда ровное, глубокое, и расслабление происходит само собой.
Попробуйте следующее:
1. Положите правую руку на живот, а левую на грудь.
2. Спокойно, свободно выдохните, как бы выпуская все напряжение из тела с этим выдохом, и Вы увидите и почувствуете, что Ваш живот как бы втягивается в момент выдоха.
3. Теперь вдохните через нос и почувствуйте, что Ваш живот как бы раздувается, в то время как Ваша грудная клетка практически неподвижна. Это был вдох за счет диафрагмы, а не мышц грудной клетки.
4. Продолжайте дышать, повторяя пункты 2-3-2-3-2-3… и Вы почувствуете расслабляющую волну, идущую по вашему телу. Не надо дышать слишком глубоко, дышите в максимально комфортном для Вас ритме. Подышав так несколько минут, Вы подготавливаете Ваш организм к сеансу релаксации.
Расслабление тела и разума.
Стресс приводит мышцы в состояние готовности к нагрузке, повышает их тонус (напряжение в покое), а при их расслаблении в мозг идет сигнал о том, что обстановка разрядилась и, таким образом, снимается стрессовое напряжение. Для сеанса релаксации нужна теплая, хорошо знакомая Вам комната, где никто не потревожит около 20 минут. Во время сеанса релаксации можно сидеть в кресле, а лучше лечь на кровать или на пол, обязательно подложив под голову подушку или валик.
Для сеанса релаксации нужна теплая, хорошо знакомая Вам комната, где никто не потревожит около 20 минут. Во время сеанса релаксации можно сидеть в кресле, а лучше лечь на кровать или на пол, обязательно подложив под голову подушку или валик.
1. Лежа на спине, руки вдоль тела, закройте глаза и начинайте дышать животом. Почувствуйте как напряжение покидает ваше тело с каждым выдохом. Представьте себе, как солнечное тепло проникает в ваше тело, расслабляя его и делая тяжелым. Ваше дыхание становиться естественно глубоким и спокойным.
2. Сожмите правый кулак и напрягите мышцы правой руки. Подержите руку в напряжении некоторое время, а затем расслабьте ее. Проделайте тоже с левой рукой.
3. Напрягите мышцы правой ноги так, чтобы слегка приподнялось колено. Не перестарайтесь, иначе ногу может свести. Сконцентрируйтесь на вашей правой ноге, почувствуйте напряжение, сковывающее ваши мышцы, а затем на выдохе расслабьтесь. Почувствуйте, как нога становиться тяжелее, напряжение сходит, и затем проделайте те же операции левой ногой.
4. Скажите «расслабься» на выдохе и подумайте о напряжении, уходящем из тела.
5. Поднимите плечи, постарайтесь буквально подтянуть их к ушам. Задержитесь в таком положении, ощутите неудобство в ваших плечах, груди и голове. Потом, выдыхая, постепенно ослабляйте напряжение мышц и затем дайте им полностью расслабиться.
6. Напрягите мышцы шеи, вжавшись затылком в подушку, задержитесь и опять постепенно расслабьтесь.
7. Напрягите плечи, как бы вжимая их в кровать (если вы лежите), выгнитесь (если вы сидите). Почувствуйте, как напряжена спина и шея, а затем на выдохе расслабьтесь.
8. Втяните живот как можно сильнее, напрягите мышцы пресса. Ваше дыхание как переместилось в грудную клетку, вы дышите грудью, и это немного другое дыхание. Ощутите напряжение и расслабьтесь до конца.
9. Напрягите мышцы лица, сожмите губы, ваше лицо превращается в гримасу. Почувствуйте как это неудобно и неестественно, а затем постепенно выпустите напряжение, ощутите, что ваше лицо снова становиться гладким и спокойным, и представьте, что солнце светит вам в лицо, не слепит, а как бы согревает вас.
10. Дайте своему телу полностью расслабиться под своим весом, почувствуйте, что оно стало как будто мягче и как бы растекается по кровати. Дышите животом, чувствуйте дыхание и движения брюшной стенки – вверх – вниз, вверх-вниз. Теперь наступил покой и вы представляете себе, что попали в сад с колодцем посередине. Вы входите в сад и чувствуете запах цветов, легкий ветер касается вашей кожи, поют птицы, и вы слышите их пение, неподалеку журчит ручей – это ваш сад, здесь ничто не потревожит, и вы можете приходить сюда, когда вам вздумается, надо только расслабиться.
11. Теперь нужно вернуться в комнату, в которой вы находились до этого. Просто подумайте о комнате, и ваши мысли сами вернуть вас в нее. Медленно откройте глаза и как следует потянитесь как бы включаясь. Можете вставать.
Научившись этим несложным приемам, вы можете теперь применять некоторые их них. Когда Вы еще не до конца научились расслабляться, можно пользоваться аудиокассетами с расслабляющей музыкой, можно даже записать описание своих действий на диктофон, так будет легче запомнить их последовательность. К тому же это ваш собственный голос, и вы его будете спокойней воспринимать.
К тому же это ваш собственный голос, и вы его будете спокойней воспринимать.
Проводя вот такие сеансы релаксации 1 – 2 раза в день, можно добиться того, что сможете заранее ощутить излишнее напряжение в мышцах и расслаблять их, чтобы не дать накопиться. Возможно даже сами этого не осознавая.
СОН
Важное место принадлежит полноценному сну, правильному режиму труда и отдыха. Сон – самая эффективная форма отдыха. Если Вы можете спать «как убитый», то это просто счастье для Вас. Многие люди при стрессе могут в лучшем случае отключаться на короткие промежутки времени, что совершенно не освежает и даже изматывает. Если Вы страдаете расстройствами сна при стрессе, то вот несколько советов, которые могут оказаться полезными.
Сон требует тишины. Постарайтесь устранить источник шума или, если это невозможно (например, вряд ли вы сможете перенести ветку железной дороги или аэропорт возле вашего дома), отправляйтесь на дачу, к родителям – куда угодно, где вам смогут предоставить тихое помещение, чтобы просто выспаться.
Кровать должна быть удобной. Если при росте под 2 метра ваше ложе имеет такую длину, что ноги свисают, а одеяло еле покрывает вас наполовину, то нечего удивляться вашей бессоннице. Просто подберите себе нормальную кровать.
Откажитесь от вечернего чая или кофе. Возможно, именно эта доза кофеина не дает вам уснуть.
Небольшая физическая нагрузка, даже немного усталости (за 2-3 часа до сна) поможет вам уснуть.
Не переедайте на ночь! Ваш желудок не даст вам уснуть. Последний прием пищи должен быть за 3 часа до сна.
Постарайтесь ложиться спать в определенное время, это тоже может помочь. Перед сном примите теплый душ.
Не внушайте себе: «Надо спать по 8 часов». Может вам в вашем положении хватить и 6. Наполеон спал 4-5 часов. Другое дело, если вы хотите спать и не можете уснуть. Но помните, что погружать себя в сон насильно, то же не стоит.
Перевозбуждение от радостных событий или умственной нагрузки также могут не дать вам уснуть. Старайтесь не смотреть перед сном по телевизору передач и фильмов, смакующих ужасы, стрельбу и убийство. Почитайте хорошую книгу, послушайте любимую музыку, расслабьтесь – это должно помочь.
Старайтесь не смотреть перед сном по телевизору передач и фильмов, смакующих ужасы, стрельбу и убийство. Почитайте хорошую книгу, послушайте любимую музыку, расслабьтесь – это должно помочь.
Если причиной бессонницы является нарушение естественного ритма, то эти методы помогут вам. В крайнем случае, можно применять снотворные препараты, но предварительно проконсультироваться с врачом.
ВОССТАНАВЛИВАЮЩИЙ ОТДЫХ
Для каждого работающего человека необходим регулярный отдых: после рабочего дня, по выходным, во время отпуска. Для того чтобы полноценно восстанавливать силы, старайтесь провести это время с пользой для физического и душевного здоровья.
Если Вы не хотите пошатнуть свое здоровье, то во время отпуска не пытайтесь сразу приобрести все: свободу, море, много солнца, изобилие еду и спиртных напитков, экзотику – не впадайте из одной крайности в другую.
Для людей напряженно работающих целый год, устающих от суеты, обилия деловых контактов, санаторно-курортный отдых поможет восстановить здоровье за короткий срок. Именно молодым и энергичным необходим отдых в тишине и покое в живописном уголке природы. Тренажерные залы, баня, массаж, бассейн или море, консультации врачей позволят вам снять напряжение и получить истинное удовольствие от отпуска.
Именно молодым и энергичным необходим отдых в тишине и покое в живописном уголке природы. Тренажерные залы, баня, массаж, бассейн или море, консультации врачей позволят вам снять напряжение и получить истинное удовольствие от отпуска.
Другой, очень полезный вид отдыха – это отправиться с рукзаком за плечами в путь. Активный отдых позволяет полностью отключиться от цивилизации и добавить себе здоровья с помощью физических нагрузок, новых впечатлений и хорошего настроения.
Неважно, как вы будете отдыхать, важно, чтобы был исключен риск для здоровья и после отпуска не потребовалось время для того, чтобы «прийти в себя».
КОНКРЕТНЫЕ СОВЕТЫ
В критической ситуации каждому человеку приходится решать, как поступить – вступить в схватку, защитить себя или попросту уйти, сбежать от опасности «не принимая боя».
Что же делать? В любом положении, в любой ситуации, какими бы опасными они не были, надо искать выход из кажущегося тупика.
Постарайтесь как можно быстрее разрешить конфликтную ситуацию и недоразумение.
Проявляя сдержанность в самом принципиальном конфликте, важно избавиться от раздражения, чтобы уберечь свое сердце. Это даст вам возможность сохранять контроль над собой и не выводить конфликт на новый виток.
Относитесь к окружающим как к себе.
Ставьте перед собой реальные цели и добивайтесь их. Учитесь планировать свои дела, выделять приоритеты.
Взвешивайте целесообразность действий и поступков.
Чаще смейтесь и улыбайтесь. Когда вы смеетесь отдыхают лицевые мышцы, падает эмоциональное напряжение, появляются положительные ощущения перспективы. Умение увидеть смешное или забавное в собственных трудностях – лучший способ изменения своего отношения к проблеме.
Надейтесь на лучшее. Если вы ожидаете неприятностей, то чаще всего они и случаются. Вы как бы предсказываете себе неудачу, ваше поведение меняется, окружающие реагируют на это соответствующим образом – и неприятность происходит.
Избегайте уединения с проблемой. Расскажите об этом своим близким. Не лишайте себя дружеской поддержки. Люди, у которых много друзей, оказываются в более выгодном положении, им легче выстоять в трудных жизненных ситуациях.
Займитесь физкультурой. Хорошая физическая форма повышает стрессоустойчивость.
Поддерживайте те привычки, которые повышают ощущение стабильности и уверенности в себе: начинайте день как обычно, с утренней зарядки, привычного душа и бутерброда с кофе. Этим вы даете себе понять, что «встали с нужной ноги» и все идет по плану.
Длительный стресс приводит к повышенному расходу витаминов и минеральных веществ. В этот период очень важно наладить правильное питание. Необходимо включить в рацион чеснок, лук, кисломолочные продукты. Рекомендуется каждый день употреблять по 100 – 200 грамм моркови, а также съедать по 1 банану. Бананы содержат в себе алкалоид харман, основу которого составляет так называемый «наркотик счастья» — мескалин. В этом состоянии важно знать, что успокаивают, снимают напряжение витамины А, В, С, Е, кальций, глюкоза. Вызывает прилив энергии, бодрость: магний, марганец, незаменимые аминокислоты (метионин, фенилаланин, триптофан). Побалуйте себя кистью винограда, горстью изюма или 2-3 персиками, абрикосами – такое угощение благодаря высокому содержанию калия укрепляет нервную систему и добавляет положительные эмоции. Употребляя продукты содержащие йод (фейхуа, плоды ирги, цветная капуста, устрицы, моллюски), вы укрепляете психический иммунитет.
В этом состоянии важно знать, что успокаивают, снимают напряжение витамины А, В, С, Е, кальций, глюкоза. Вызывает прилив энергии, бодрость: магний, марганец, незаменимые аминокислоты (метионин, фенилаланин, триптофан). Побалуйте себя кистью винограда, горстью изюма или 2-3 персиками, абрикосами – такое угощение благодаря высокому содержанию калия укрепляет нервную систему и добавляет положительные эмоции. Употребляя продукты содержащие йод (фейхуа, плоды ирги, цветная капуста, устрицы, моллюски), вы укрепляете психический иммунитет.
Если вы находитесь в состоянии психологического напряжения, то старайтесь помочь своему организму: выбирайте продукты, которые приятны вам и полезны. Вместо конфет и сахара возьмите сладкие фрукты, а булочки и торты замените хлебом с отрубями и намажьте его качественным маргарином, обогащенным витаминами.
Снять состояние нервного перенапряжения вам помогут обтирания холодной водой с добавлением поваренной соли (1 ч.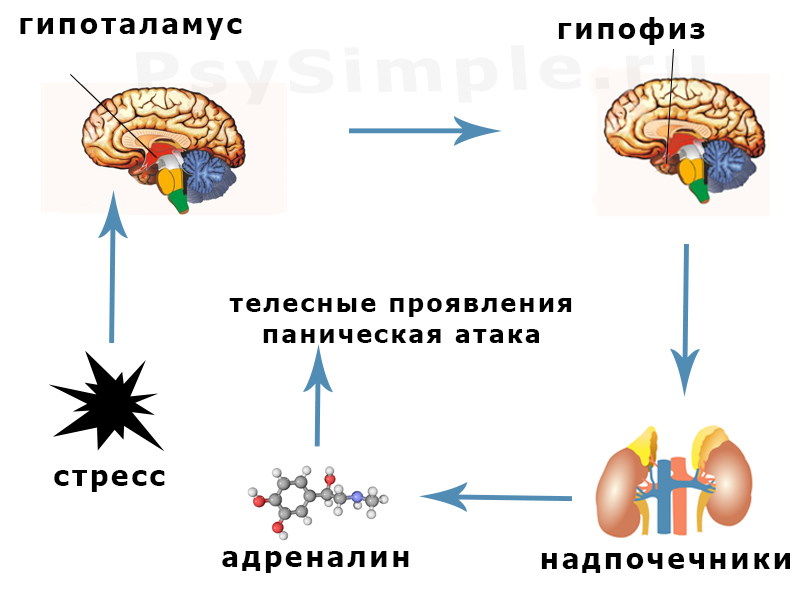 л. на 0,5 л. воды) утром и вечером. Полезны также баня и ванны с лекарственными травами.
л. на 0,5 л. воды) утром и вечером. Полезны также баня и ванны с лекарственными травами.
Непременно возьмите на вооружение ароматерапию. При вдыхании эфирного масла (масла пихты, лаванды, базилика, бергамота) стимулирует умственную активность, снимают стрессовые состояния. Современная ароматерапия предлагает применять эфирные масла при массаже, в ванных и саунах.
Пионером метода, получившего названия «аниматерапия», является нью-йоркский врач Б.Левинсон, который открыл метод лечения с помощью животных. Он взял себе в помощники кошку, а потом поместил в приемной аквариум с яркими тропическими рыбками. Доказано, что биоэнергетика некоторых животных может оказывать положительное влияние на больные органы человека. Четвероногий друг может спасти вас от гиподинамии, а сеансы соловьиных трелей используются при лечении болезней сердца.
Необходимо понять, что никто за вас не силах изменить приоритеты вашего образа жизни. Следовательно, как можно меньше бесплодных эмоций и как можно больше здравого смысла, настойчивости, упорства.
причины, симптомы, лечение, полезен или нет
- направления
Неврология Нейрореабилитационный центр Эпилептологический центр Реабилитация и физиотерапия Лечение головной боли Гинекология Ортопедия Психиатрия Функциональная диагностика Педиатрия Ультразвуковая диагностика
Психология Процедурный кабинет Отоларингология Терапия Эндокринология Кардиология Ревматология Урология Аллергология Ботулинотерапия Нефрология
- услуги и цены
- специалисты
- клиника
- О клинике
- Новости
- Отзывы
- Вопрос-ответ
- Лицензии
- Реквизиты
- Надзорные органы
- Политика конфиденциальности
- контакты
Стресс – состояние психологического и физического напряжения в ответ на внешнее воздействие. Его способны вызвать затруднительные ситуации, монотонная деятельность и эмоциональные факторы. Стресс помогает адаптироваться к изменчивой окружающей среде, но может стать причиной отрицательных для здоровья последствий.
Его способны вызвать затруднительные ситуации, монотонная деятельность и эмоциональные факторы. Стресс помогает адаптироваться к изменчивой окружающей среде, но может стать причиной отрицательных для здоровья последствий.
Полезен стресс или нет?
Кратковременный разовый стресс обладает положительным воздействием. В ответ на стимул организм вырабатывает три гормона: кортизон, адреналин, норадреналин и активирует работу клеток иммунной системы.
Благодаря этому у человека на небольшой временной промежуток:
-
улучшается память;
-
повышается уровень иммунитета;
-
увеличивается скорость регенерации тканей;
-
активируются интеллектуальные способности;
-
повышается выносливость нервной системы;
-
улучшается работа органов чувств.

Если человек систематически подвергается воздействию стрессового фактора, все его органы и системы напряженно работают. В результате организм интенсивно растрачивает силы, проходя через три стадии процесса.
Первая стадия вступает в силу в момент воздействия стрессового фактора, и длится несколько минут. За ней наступает вторая продолжительностью от нескольких часов до нескольких суток, на протяжении которых человек ищет решение проблемы или благополучный выход из ситуации.
Если действие фактора продолжается, организм истощает адаптивную способность и перестает минимизировать вредное воздействия стрессора. Именно на стадии дистресса у человека возникают перегрузки, психологические расстройства, признаки соматических заболеваний.
Причины стресса
Выделяют системный и психический тип воздействия стрессового фактора. Системный тип – это ответная реакция организма на инфекционное заболевание, воспаление, травму, свет, высокую или низкую температуру. Психический тип – проявляется на эмоциональной и психической сфере, следом на биологическом уровне.
Психический тип – проявляется на эмоциональной и психической сфере, следом на биологическом уровне.
К группе психических причин возникновения стресса относятся:
-
профессиональная деятельность, связанная с повышенной ответственностью;
-
сложные взаимоотношения в семье;
-
конфликты, фобии, проблемы в общении, угрозы разного характера, трудноразрешимые проблемы, неблагополучные социальные отношения в коллективе;
-
нереализованные потребности, заниженная самооценка, перфекционизм;
-
смена места жительства или работы, монотонный вид деятельности, развод, смерть близкого человека;
-
информационная перегруженность;
-
отсутствие отдыха достаточного для восстановления психики;
-
психоэмоциональная напряженность, вызванная риском, цейтнотом, повышенной нагрузкой, новизной ситуации или ее неопределенностью.

Последствия длительного стресса у мужчин и женщин одинаковы – депрессия и соматические заболевания. Поэтому важно своевременно отметить признаки психофизического напряжения, выявить его причины и устранить.
Признаки стресса
Продолжительное воздействие стрессового фактора вызывает серьезное напряжение всего организма, заметно ухудшая общий настрой и самочувствие человека.
Частые симптомы развивающегося стресса:
-
Мышечное напряжение в области головы, шеи, плеч, спины.
-
Повышенная тревожность.
-
Раздражительность по малейшему поводу.
-
Сниженная работоспособность.
-
Подавленность, апатия.
-
Нарушения сна.

-
Рассеянность, ухудшение памяти и способности к концентрации внимания, замедление темпа мыслительных процессов.
-
Хроническая усталость, пессимизм, желание дистанцироваться от социума.
-
Головная боль, необъяснимые боли в груди.
-
Расстройство аппетита, нарушение пищеварительной функции.
Нередко человек приобретает навязчивую привычку, например, покусывать губы, вращать шеей, поправлять волосы. Его начинают беспокоить боли в области живота, учащенное сердцебиение, кожный зуд или другие негативные проявления.
Терапия при стрессе
Мнение, что стресс не требует лечения – опасное заблуждение. Хроническое состояние напряжения способно привести к депрессии, посттравматическому синдрому, неврозу, нейродермиту, язвенным заболеваниям желудочно-кишечного тракта, бронхиальной астме.
Если вас беспокоит эмоциональный дискомфорт, нарастает выраженность симптоматики, более того появились соматические реакции, запишитесь на прием к врачу-психотерапевту. Врач определит стадию стресса, поможет найти неосознаваемые стрессовые факторы, подберет метод успешного лечения, которое убережет от серьезных осложнений.
Наши специалисты
ПахомоваЛидия Евгеньевна
Психолог
Стаж: 17 лет
Лечение заболевания «Cтресс» в нашем центре
| group | Номенклатура | Номенклатура | Цена | Цена |
|---|
Все цены
Запишитесь на прием
имеются противопоказания необходима консультация специалиста
Записаться на прием
Записаться на прием
Условия соглашения
Я согласен на обработку личных данных
Задать вопрос
Спасибо 🙂
Ваша заявка принята!
В ближайшее время сотрудник центра свяжется с вами
Произошла ошибка!
Повторите запрос позже!
Или сообщите администртору сайта
Профилактика стресса
Термин «стресс» произошел от французского слова «estresse», что означает «угнетенность», «подавленность». Стресс – это состояние повышенного физического или психического напряжения, возникающее под влиянием того или иного фактора.
Стресс – это состояние повышенного физического или психического напряжения, возникающее под влиянием того или иного фактора.
Канадский ученый Ганс Селье является создателем теории стресса. Он считал, что организм, сталкиваясь с разного рода факторами, такими как боль, холод, страх, опасность, быстрый бег, эмоциональное потрясение, потеря крови и т. д., включает специальные механизмы защиты от стресса, отвечая на раздражители не только защитной реакцией, но и однотипным физиологическим процессом. Этот процесс представляет собой полную мобилизацию, приспособление к неожиданной ситуации. Это требует от организма большого напряжения и затраты огромного количества сил. Г. Селье предложил гипотезу, согласно которой старение организма происходит в результате воздействия на него всех стрессов, с которыми ему приходилось сталкиваться в течение жизни. Любой, особенно травматический стресс вызывает необратимые изменения в химическом балансе организма. Накапливаясь, эти изменения запускают механизм старения. Постоянный стресс особенно опасен для клеток мозга и нервной системы. Г. Селье подчеркивал, что профилактика психоэмоционального стресса очень важна для здоровья и долголетия.
Постоянный стресс особенно опасен для клеток мозга и нервной системы. Г. Селье подчеркивал, что профилактика психоэмоционального стресса очень важна для здоровья и долголетия.
Виды стресса
В психологии выделяют следующие виды стресса: физиологический и психологический. Психологический стресс подразделяют еще на два вида: эмоциональный и информационный.
- Физиологический стресс возникает в результате чрезмерных физических нагрузок, боли, повышенной или пониженной температуре.
- Психологический стресс провоцируется ощущением угрозы, обидой, страхом, гневом и другими негативными эмоциями.
- Эмоциональный стресс представляет собой примерно то же, что и психологический.
- Информационный стресс возникает при информационных перегрузках, когда человек сталкивается с необходимостью перерабатывать большой объем информации за короткое время.
Все виды стресса негативно сказываются на здоровье и психологическом состоянии человека.
Чем опасен стресс?
Стрессовые ситуации негативно влияют не только на психологические механизмы, но и на весь организм в целом, приводя к ряду проблем. Стресс вызывает следующие нарушения в организме:
- повышает риск возникновения заболевания нервной, сердечно-сосудистой, пищеварительной системы;
- снижает иммунитет и сопротивляемость различным заболеваниям;
- вызывает нарушения сна, хроническую усталость, нервозность, раздражительность, ухудшает общее состояние;
- провоцирует появление спазмов в мышцах и фантомных болей в суставах, головные боли;
- вызывает ухудшение аппетита или, наоборот, желание «заесть» стресс, употребляя большое количество пищи;
- разрушает многие витамины, нарушает обменные процессы;
- вызывает ухудшение памяти и эмоциональную неустойчивость;
- способствует появлению депрессии, апатии, утрате интереса к жизни.
Способы профилактики стресса
Стресс, как и болезнь, легче предотвратить, чем лечить. Поэтому важно научиться предотвращать появление стресса, своевременно избавляясь от негативных эмоций, физического и психологического переутомления.
Поэтому важно научиться предотвращать появление стресса, своевременно избавляясь от негативных эмоций, физического и психологического переутомления.
Какие же методы профилактики стресса существуют?
- Отдых. Регулярный отдых играет большую роль в нормальном функционировании организма. Даже самый занятый человек должен всегда находить время для отдыха. Важно отдыхать не только телом, но и душой. Можно погулять на свежем воздухе, почитать интересную книгу, посмотреть увлекательный фильм, пообщаться с друзьями, поиграть с детьми или домашними животными. Каждый человек может найти массу интересных занятий, которые расслабят его и поднимут настроение.
- Полноценный сон. Здоровый сон – это хорошая защита от стресса. Выспавшийся человек имеет более высокую стрессоустойчивость. Чтобы сон был крепким, нужно приучить себя ложится в одно и то же время, не засиживаться допоздна, не принимать пищу за три часа до сна, не употреблять перед сном чая, кофе, алкоголя.
 Перед сном можно прогуляться в течение получаса или хотя бы просто немного постоять возле открытого окна или на балконе. Спальню желательно проветрить, чтобы воздух был свежим. Полноценный сон – это хорошая профилактика экзаменационного стресса, который часто возникает у студентов и школьников во время сдачи экзаменов.
Перед сном можно прогуляться в течение получаса или хотя бы просто немного постоять возле открытого окна или на балконе. Спальню желательно проветрить, чтобы воздух был свежим. Полноценный сон – это хорошая профилактика экзаменационного стресса, который часто возникает у студентов и школьников во время сдачи экзаменов. - Правильное питание. При стрессе в организме происходят различные сбои. Сбалансированное питание насыщает его всеми необходимыми витаминами и микроэлементами. Это повышает иммунитет, делая организм более выносливым и стрессоустойчивым.
- Спорт. Спортивные занятия являются отличным способом преодоления стресса. Каждый человек может выбрать себе наиболее подходящий вид спорта, исходя из своих предпочтений и физических возможностей. Спорт можно заменить танцами. Танцы особенно полезны для женщин, потому что не только укрепляют тело и развивают пластику, но и способствуют раскрытию женственности и повышению самооценки.

- Массаж. Массаж благоприятно воздействует на организм, помогая снять усталость и мышечное напряжение, что в свою очередь способствует эмоциональному расслаблению. Это настоящая антистрессовая релаксация.
- Водные процедуры. Вода благоприятно влияет на организм человека и помогает бороться со стрессами. Расслабляющие ванны с ароматическими маслами, регулярное посещение бассейна, купание в природных водоемах полезны для физического и психического здоровья и являются простыми и действенными способами релаксации.
Человек не выбирает свою болезнь, но он выбирает стресс — и именно стресс выбирает болезнь.
Кицанюк С.Э.- ф.-валеолог.
Использовались материалы интернет-ресурсов
учреждение здравоохранения городская клиническая
больница
Оценить качество услуг
Реакции нейронов на физиологический стресс
Введение
Стресс является неотъемлемым компонентом мира природы, применимым практически ко всем биологическим системам. Биологический стресс означает любое состояние, которое вынуждает живые системы отходить от физиологического устойчивого состояния, и его воздействие тесно связано с природой элементов, формирующих живые организмы. Поскольку стресс может применяться ко многим различным уровням биологической организации, этот термин до сих пор использовался во многих различных контекстах. «Физиологический стресс» называется первичным биологическим стрессом и может быть определен как любое внешнее или внутреннее состояние, которое нарушает гомеостаз клетки или организма. Принимая во внимание различные возможные источники биологического стресса, мы можем представить себе три различных аспекта физиологического стресса: стресс окружающей среды, внутренний стресс развития и старение (рис. 1).
Биологический стресс означает любое состояние, которое вынуждает живые системы отходить от физиологического устойчивого состояния, и его воздействие тесно связано с природой элементов, формирующих живые организмы. Поскольку стресс может применяться ко многим различным уровням биологической организации, этот термин до сих пор использовался во многих различных контекстах. «Физиологический стресс» называется первичным биологическим стрессом и может быть определен как любое внешнее или внутреннее состояние, которое нарушает гомеостаз клетки или организма. Принимая во внимание различные возможные источники биологического стресса, мы можем представить себе три различных аспекта физиологического стресса: стресс окружающей среды, внутренний стресс развития и старение (рис. 1).
Рисунок 1. Различные аспекты физиологического стресса . Старение и стресс окружающей среды присутствуют на протяжении всей жизни, тогда как внутренний стресс развития проявляется только во время эмбрионального и постэмбрионального развития.
Экологический стресс
Биологические системы предназначены для развития и жизни в различных меняющихся условиях окружающей среды. В ходе эволюции было выработано множество различных приспособлений, обеспечивающих организмам способность не только выживать, но и размножаться в различных, часто враждебных условиях. Такие адаптации связаны с определенными структурами и поведением, адаптированным к конкретной среде. На молекулярном уровне существуют различные стратегии, которые используются клетками и системами для реагирования и адаптации к изменениям окружающей среды, таким как изменения доступности кислорода и колебания температуры. Изменения окружающей среды, превышающие определенные уровни, определяют «экологический стресс».
Внутренний стресс развития
Дополнительная причина физиологического стресса может быть связана с событиями развития. По мере развития живых организмов они сталкиваются с множеством проблем, связанных с морфогенезом и изменениями внутренней химии. Действительно, быстрое развитие зародышей вызывает массовые внутренние изменения организма по мере его роста и изменения морфологии. Различные события развития могут вызывать различные стрессовые состояния, причем некоторые из них более суровые, чем другие. Следовательно, адаптация к стрессу развития одинаково важна для выживания особей и видов.
Действительно, быстрое развитие зародышей вызывает массовые внутренние изменения организма по мере его роста и изменения морфологии. Различные события развития могут вызывать различные стрессовые состояния, причем некоторые из них более суровые, чем другие. Следовательно, адаптация к стрессу развития одинаково важна для выживания особей и видов.
Старение
Когда развитие завершается и достигается созревание организма, стресс окружающей среды является лишь одним из аспектов физиологического стресса, который бросает вызов индивидуумам. Старение представляет собой еще одно бремя, с которым живые организмы должны справляться в течение своей жизни. Несмотря на то, что старение часто рассматривается как неблагоприятный результат различных стрессов, его также можно рассматривать как дополнительный уровень стресса на протяжении всей жизни из-за термодинамических свойств биологических материалов, которые со временем приводят к стохастическому накоплению молекулярных повреждений. Способность каждого организма справляться со старением и другими стрессами определяет его долголетие. Таким образом, функциональное снижение в результате старения, происходящее даже в физиологически совершенных условиях окружающей среды, может частично являться следствием воздействия энтропии на организмы и выявлять возможные несовершенства гомеостатических механизмов.
Способность каждого организма справляться со старением и другими стрессами определяет его долголетие. Таким образом, функциональное снижение в результате старения, происходящее даже в физиологически совершенных условиях окружающей среды, может частично являться следствием воздействия энтропии на организмы и выявлять возможные несовершенства гомеостатических механизмов.
Роль нейронов
Многолетние исследования показали, что нейроны играют главную роль в реакциях на стресс. Нейроны не только получают и обрабатывают информацию из окружающей среды, но и оказывают важное непосредственное влияние на различные аспекты реакции на стресс (рис. 2). Для того чтобы нейроны выполняли свои роли в реакциях на стресс, определенные молекулы регулируются во времени в ответ на изменения внутренних или внешних условий.
Рисунок 2. Стресс запускает биологические реакции на разных уровнях организации . Различные вовлеченные молекулы диктуют изменения, необходимые для адаптации и, следовательно, для выживания и размножения. ТФ, факторы транскрипции.
ТФ, факторы транскрипции.
Цель обзора
Целью этого обзора является предоставление примеров, демонстрирующих важную роль нейронов в реакциях на физиологический стресс, а также влияние физиологического стресса на нейроны на межклеточном, клеточном и молекулярном уровне.
Нейрональные реакции
Стресс окружающей среды и нейронные цепи
Гипоксия
Сенсорные нейроны образуют клеточные сети, через которые обрабатывается информация из окружающей среды. У низших организмов эти сети относительно просты и стереотипны, и поэтому они представляют собой привлекательные модели для изучения влияния физиологического стресса на обработку нейронной информации. Из исследований C. elegans , в которых была картирована вся нейронная схема (White et al., 1986), было обнаружено, что стресс может изменять обработку сенсорной информации. В частности, при гипоксии латентный контур занимается обработкой вкусовой информации, которая обычно не используется в нормоксических условиях (Pocock, Hobert, 2010). Напротив, нейронная цепь аэротаксиса становится упрощенной и менее гибкой после гипоксического инсульта в том же организме (Chang and Bargmann, 2008). Интересно, что пищевое зондирование и O 2 -сенсорные цепи у C. elegans могут быть изменены естественной генной вариацией, подчеркивающей специфическую адаптацию нейронных цепей различных штаммов в разнообразных локальных условиях (Cheung et al., 2005). Описанная здесь пластичность изменяет поведенческие реакции, которые могут дать организму преимущества в условиях стресса. У высших организмов, где нейронные сети чрезвычайно сложны, отсутствует информация о том, может ли стресс аналогичным образом изменить поток информации через альтернативные нейронные сети. Однако у крыс и других животных наблюдался так называемый «перекрестно-диафрагмальный феномен», когда латентный дыхательный двигательный путь активируется гипоксией, что способствует более быстрому восстановлению после травмы позвоночника (Zhou et al., 2001). Вместе эти примеры показывают функциональную пластичность нейронных цепей и то, как они могут изменять обработку информации в ответ на стресс окружающей среды.
Напротив, нейронная цепь аэротаксиса становится упрощенной и менее гибкой после гипоксического инсульта в том же организме (Chang and Bargmann, 2008). Интересно, что пищевое зондирование и O 2 -сенсорные цепи у C. elegans могут быть изменены естественной генной вариацией, подчеркивающей специфическую адаптацию нейронных цепей различных штаммов в разнообразных локальных условиях (Cheung et al., 2005). Описанная здесь пластичность изменяет поведенческие реакции, которые могут дать организму преимущества в условиях стресса. У высших организмов, где нейронные сети чрезвычайно сложны, отсутствует информация о том, может ли стресс аналогичным образом изменить поток информации через альтернативные нейронные сети. Однако у крыс и других животных наблюдался так называемый «перекрестно-диафрагмальный феномен», когда латентный дыхательный двигательный путь активируется гипоксией, что способствует более быстрому восстановлению после травмы позвоночника (Zhou et al., 2001). Вместе эти примеры показывают функциональную пластичность нейронных цепей и то, как они могут изменять обработку информации в ответ на стресс окружающей среды.
Предварительное кондиционирование
Функциональность нейронных цепей в суровых условиях окружающей среды также может зависеть от предшествующего воздействия различных стрессов (Robertson, 2004). Нейроны, которые ранее подвергались острому сублетальному стрессу, по-видимому, сохраняют память, которая позволяет им выживать и реагировать на более высокие дозы этого стресса, чем до их первоначального воздействия. Это явление называется «прекондиционирования» или «нейрогормезис» (Mattson and Cheng, 2006). Характерными примерами являются повышенная термотолерантность нейронов при предшествующем тепловом шоке у Drosophila (Karunanithi et al., 1999), у саранчовых (Dawson-Scully and Meldrum Robertson, 1998; Wu et al., 2001) и у C. elegans (Kourtis et al., 2012). Другие примеры включают нейропротекцию за счет предшествующего гипоксического воздействия на последующие ишемические состояния у мышей (Miller et al., 2001), песчанок (Kitagawa et al., 1991) и в культуре нейронов (Bruer et al. , 1997). Недавно было показано, что у поросят ишемическое прекондиционирование отдаленной устойчивой к ишемии ткани защищает мозг от ишемического повреждения, явление, которое называется «дистанционное ишемическое прекондиционирование» и подчеркивает сложность механизмов прекондиционирования (Jensen et al., 2011). Интересно, что прекондиционирование нейронов также может быть достигнуто низкими дозами токсинов, естественным образом присутствующих во фруктах и овощах (Mattson and Cheng, 2006). Кроме того, воздействие стресса может вызвать толерантность к другому стрессу, явление, которое называется «перекрестной толерантностью». Например, у саранчи предварительное воздействие аноксии индуцирует термотолерантность в нейронах, контролирующих полет (Wu et al., 2002). У крыс предварительное воздействие высокой температуры повышает толерантность к ишемии спинного мозга (Zhang et al., 2000). Наконец, тепловой стресс в культурах клеток коры головного мозга мышей повышает толерантность к комбинированному лишению кислорода и глюкозы (Snider et al.
, 1997). Недавно было показано, что у поросят ишемическое прекондиционирование отдаленной устойчивой к ишемии ткани защищает мозг от ишемического повреждения, явление, которое называется «дистанционное ишемическое прекондиционирование» и подчеркивает сложность механизмов прекондиционирования (Jensen et al., 2011). Интересно, что прекондиционирование нейронов также может быть достигнуто низкими дозами токсинов, естественным образом присутствующих во фруктах и овощах (Mattson and Cheng, 2006). Кроме того, воздействие стресса может вызвать толерантность к другому стрессу, явление, которое называется «перекрестной толерантностью». Например, у саранчи предварительное воздействие аноксии индуцирует термотолерантность в нейронах, контролирующих полет (Wu et al., 2002). У крыс предварительное воздействие высокой температуры повышает толерантность к ишемии спинного мозга (Zhang et al., 2000). Наконец, тепловой стресс в культурах клеток коры головного мозга мышей повышает толерантность к комбинированному лишению кислорода и глюкозы (Snider et al. , 19).98). Прекондиционирования нейронных цепей состоит из адаптивного механизма, который использует предыдущий опыт, чтобы лучше противостоять враждебным условиям. Кроме того, перекрестная толерантность к стрессу является естественной демонстрацией существования общих механизмов реакции на различные стрессы, такие как высокая температура и недостаток кислорода.
, 19).98). Прекондиционирования нейронных цепей состоит из адаптивного механизма, который использует предыдущий опыт, чтобы лучше противостоять враждебным условиям. Кроме того, перекрестная толерантность к стрессу является естественной демонстрацией существования общих механизмов реакции на различные стрессы, такие как высокая температура и недостаток кислорода.
Ремоделирование/пластичность синаптической и нейронной сети
Еще один способ, которым нейроны реагируют на физиологический стресс, заключается в изменении их синаптической силы (функциональная пластичность) и/или характера связности (структурная пластичность) таким образом, который способствует адаптации. В отличие от таких организмов, как C. elegans , где связь нейронов между отдельными особями представляется стереотипной (White et al., 1986), мозг взрослых высших животных демонстрирует замечательный уровень пластичности, а нейронные сети определенных областей могут изменяться в различных условиях в течение жизни. и после их развития (Pascual-Leone et al., 2011). Хотя это явление в основном связано с обучением и памятью, оно также может возникать как реакция на внешние раздражители и способствовать гомеостазу нервной системы. Например, сенсорный опыт способствует синаптической интеграции новых нейронов в обонятельные цепи у мышей (Arenkiel et al., 2011). Более того, хроническая перемежающаяся гипоксия изменяет синаптические свойства центральной сенсорной цепи у крыс (Kline et al., 2007) и периферических хеморецепторных клеток у моллюсков Lymnaea stagnalis развивают синапсы in vitro , которые проявляют форму кратковременной синаптической пластичности в ответ на гипоксию (Bell et al., 2007). Наконец, характерно и то, что кратковременная пластичность синапсов сильно зависит от температуры (Клячко, Стивенс, 2006). Эти примеры показывают функциональную и структурную пластичность нервной системы в ответ на внешние раздражители.
и после их развития (Pascual-Leone et al., 2011). Хотя это явление в основном связано с обучением и памятью, оно также может возникать как реакция на внешние раздражители и способствовать гомеостазу нервной системы. Например, сенсорный опыт способствует синаптической интеграции новых нейронов в обонятельные цепи у мышей (Arenkiel et al., 2011). Более того, хроническая перемежающаяся гипоксия изменяет синаптические свойства центральной сенсорной цепи у крыс (Kline et al., 2007) и периферических хеморецепторных клеток у моллюсков Lymnaea stagnalis развивают синапсы in vitro , которые проявляют форму кратковременной синаптической пластичности в ответ на гипоксию (Bell et al., 2007). Наконец, характерно и то, что кратковременная пластичность синапсов сильно зависит от температуры (Клячко, Стивенс, 2006). Эти примеры показывают функциональную и структурную пластичность нервной системы в ответ на внешние раздражители.
Экологический стресс и отдельные нейроны
Гипоксия
В дополнение к разным реакциям, которые нейроны проявляют при определенных стрессах, они также проявляют различные фенотипы, связанные со стрессом. Поскольку нейроны являются высокоактивными клетками, им требуется большое количество кислорода, чтобы выжить и функционировать. Таким образом, гипоксия может иметь огромное влияние на физиологию мозга животных. Ограниченная доступность кислорода во время развития (Lipton, 1999), при рождении (Arpino et al., 2005; Gozzo et al., 2009) и в более позднем возрасте (Lipton, 1999) может вызвать необратимое повреждение нейронной ткани. Гипоксия также может влиять на разрастание аксонов в линии нейронов крысы (O’Driscoll and Gorman, 2005). Кроме того, конкретные in vivo дефекты развития отдельных нейронов, вызванные гипоксией, были продемонстрированы у C. elegans . В этой модели ведение аксонов и миграция нейронов нарушены в специфических типах нейронов в условиях гипоксии в результате стабилизации фактора, индуцируемого гипоксией-1 (HIF)-1 (Pocock and Hobert, 2008). Недавнее исследование также показало, что сходные дефекты наблюдаются в центральной нервной системе рыбок данио по сходному пути, что дает убедительные доказательства того, что этот механизм консервативен (Stevenson et al.
Поскольку нейроны являются высокоактивными клетками, им требуется большое количество кислорода, чтобы выжить и функционировать. Таким образом, гипоксия может иметь огромное влияние на физиологию мозга животных. Ограниченная доступность кислорода во время развития (Lipton, 1999), при рождении (Arpino et al., 2005; Gozzo et al., 2009) и в более позднем возрасте (Lipton, 1999) может вызвать необратимое повреждение нейронной ткани. Гипоксия также может влиять на разрастание аксонов в линии нейронов крысы (O’Driscoll and Gorman, 2005). Кроме того, конкретные in vivo дефекты развития отдельных нейронов, вызванные гипоксией, были продемонстрированы у C. elegans . В этой модели ведение аксонов и миграция нейронов нарушены в специфических типах нейронов в условиях гипоксии в результате стабилизации фактора, индуцируемого гипоксией-1 (HIF)-1 (Pocock and Hobert, 2008). Недавнее исследование также показало, что сходные дефекты наблюдаются в центральной нервной системе рыбок данио по сходному пути, что дает убедительные доказательства того, что этот механизм консервативен (Stevenson et al. , 2012). Таким образом, гипоксия может оказывать плейотропное воздействие на разные нейроны разных организмов.
, 2012). Таким образом, гипоксия может оказывать плейотропное воздействие на разные нейроны разных организмов.
Реакция на тепловой шок
Известно также, что повышение температуры (гипертермия) влияет на многие типы клеток. Однако нейроны особенно чувствительны к повышению температуры, и гибель организма при высокой температуре может быть результатом нарушения работы нейронов до того, как другие клетки откажут (Robertson, 2004). Высокая температура в основном вызывает неправильный фолдинг белков, что запускает клеточные автономные и клеточно-неавтономные ответы (Ramirez et al., 1999). Определенные сенсорные нейроны отвечают за определение оптимальной температуры у свободно движущихся животных, а также за опосредование термоноцицепции (Clark et al., 2007; Liu et al., 2012). Интересное исследование в C. elegans показал, что такие сенсорные нейроны играют критическую роль в неавтономной клеточной реакции соматических клеток на тепловой шок (Prahlad et al., 2008). Кроме того, было показано, что эти нейроны регулируют ответ на хронический стресс, вызванный внутриклеточным накоплением белков с неправильной укладкой в отдаленных соматических клетках (Prahlad and Morimoto, 2011). Наконец, реснитчатые хемосенсорные нейроны ASI в том же самом организме дистанционно регулируют решение о пролиферации или дифференцировке в гонадах путем секреции DAF-7/TGFβ при благоприятных условиях окружающей среды (Dalfo et al., 2012). Таким образом, сенсорные нейроны регулируют системный стресс неклеточно автономно, интегрируя входные данные из окружающей среды.
Наконец, реснитчатые хемосенсорные нейроны ASI в том же самом организме дистанционно регулируют решение о пролиферации или дифференцировке в гонадах путем секреции DAF-7/TGFβ при благоприятных условиях окружающей среды (Dalfo et al., 2012). Таким образом, сенсорные нейроны регулируют системный стресс неклеточно автономно, интегрируя входные данные из окружающей среды.
Реакция на повреждение ДНК
Генотоксические факторы, такие как УФ и другие электромагнитные излучения, также могут вызывать серьезные повреждения нейронов, повреждая как их ядерную (Ide et al., 2000), так и митохондриальную ДНК (LeDoux et al., 2007). В отличие от других типов клеток, которые подвергаются остановке контрольных точек клеточного цикла при повреждении ДНК, нейроны, по-видимому, задействуют компоненты механизма клеточного цикла в ответ на такие повреждения (Park et al., 1997), а также в ответ на другие стрессы, такие как ишемическая гипоксия (Li et al., 1997; Тимсит и др., 1999). Такое вступление нейронов в клеточный цикл при стрессе коррелирует с апоптотической гибелью после обширного повреждения ДНК (Park et al. , 1998; Herrup et al., 2004; Kruman et al., 2004). Более того, вступление нейронов в клеточный цикл также коррелирует с гибелью нейронов как ранним процессом, связанным с заболеванием (Herrup, 2012).
, 1998; Herrup et al., 2004; Kruman et al., 2004). Более того, вступление нейронов в клеточный цикл также коррелирует с гибелью нейронов как ранним процессом, связанным с заболеванием (Herrup, 2012).
Большая часть информации о различных механизмах репарации ДНК, доступных в клетках, получена в результате исследований ненейрональных клеточных систем млекопитающих. Несмотря на существование различных путей репарации ДНК, эксцизионная репарация оснований (BER) и эксцизионная репарация нуклеотидов (NER) являются основными механизмами, ответственными за восстановление индуцированных окислением и УФ-индуцированных повреждений, соответственно, как в ядерной, так и в митохондриальной ДНК (Seeberg et al. , 1995; Лагерверф и др., 2011). Детали путей NER (Lagerwerf et al., 2011) и BER (Robertson et al., 2009) были недавно рассмотрены. О постепенном созревании таких механизмов восстановления в нейронах свидетельствует тот факт, что зрелые нейроны оказываются более устойчивыми к повреждению ДНК, вызванному УФ- и ИК-излучением, чем их более молодые аналоги (Romero et al. , 2003; Shirai et al., 2006). . Нейроны также более устойчивы к апоптозу, индуцированному ИР, по сравнению с клетками-предшественниками нейронов (Kameyama and Inouye, 1994) и другими типами клеток (Li et al., 19).96). Это подчеркивает важность эффективных механизмов ответа на повреждение ДНК (DDR) для поддержания зрелых постмитотических клеток, таких как нейроны, которые не могут быть восполнены (Romero et al., 2003). ИК-облучение также влияет на множественные поведенческие реакции разных видов, воздействуя на нейроны (Sakashita et al., 2010 и ссылки здесь). В частности, у C. elegans IR по-разному влияет на подтипы нейронов (Sakashita et al., 2010), что также может свидетельствовать о том, что эффективность репарации ДНК различается между типами нейронов. Эндогенное повреждение ДНК также происходит в нейронах. Нейроны представляют собой высокоактивные клетки, продуцирующие высокие уровни активных форм кислорода (АФК), что приводит к повышенному повреждению ядерной и митохондриальной ДНК (LeDoux et al.
, 2003; Shirai et al., 2006). . Нейроны также более устойчивы к апоптозу, индуцированному ИР, по сравнению с клетками-предшественниками нейронов (Kameyama and Inouye, 1994) и другими типами клеток (Li et al., 19).96). Это подчеркивает важность эффективных механизмов ответа на повреждение ДНК (DDR) для поддержания зрелых постмитотических клеток, таких как нейроны, которые не могут быть восполнены (Romero et al., 2003). ИК-облучение также влияет на множественные поведенческие реакции разных видов, воздействуя на нейроны (Sakashita et al., 2010 и ссылки здесь). В частности, у C. elegans IR по-разному влияет на подтипы нейронов (Sakashita et al., 2010), что также может свидетельствовать о том, что эффективность репарации ДНК различается между типами нейронов. Эндогенное повреждение ДНК также происходит в нейронах. Нейроны представляют собой высокоактивные клетки, продуцирующие высокие уровни активных форм кислорода (АФК), что приводит к повышенному повреждению ядерной и митохондриальной ДНК (LeDoux et al. , 2007; Barzilai et al., 2008). Ответы на повреждение эндогенной ДНК имеют решающее значение для обеспечения правильного развития нейронов и последующего поддержания нейронов (LeDoux et al., 2007; Lee and McKinnon, 2007; Barzilai et al., 2008). Важность DDR в отсутствие внешних мутагенных факторов также подтверждается генетическими условиями у людей, вызывающими дефекты развития (O’Driscoll, Jeggo, 2006; Barzilai et al., 2008). Наконец, нейроны могут удаленно защищать другие ткани от повреждений, таких как ионизирующее облучение. Ярким примером является C. elegans , где апоптоз, вызванный повреждением ДНК в гонадах червей, отрицательно регулируется путем, включающим HIF-1. В частности, HIF-1 действует в сенсорных нейронах амфид ASJ, активируя члена семейства тирозиназ TYR-2. TYR-2 впоследствии секретируется из этих нейронов и подавляет CEP-1, гомолог p53, в гонадах, тем самым подавляя радиационно-индуцированный апоптоз (Sendoel et al., 2010). Таким образом, ясно, что нейроны особенно восприимчивы как к экзогенным, так и к эндогенным генотоксическим реагентам, и клетки могут реагировать как автономно, так и неклеточно автономно, чтобы способствовать выживанию.
, 2007; Barzilai et al., 2008). Ответы на повреждение эндогенной ДНК имеют решающее значение для обеспечения правильного развития нейронов и последующего поддержания нейронов (LeDoux et al., 2007; Lee and McKinnon, 2007; Barzilai et al., 2008). Важность DDR в отсутствие внешних мутагенных факторов также подтверждается генетическими условиями у людей, вызывающими дефекты развития (O’Driscoll, Jeggo, 2006; Barzilai et al., 2008). Наконец, нейроны могут удаленно защищать другие ткани от повреждений, таких как ионизирующее облучение. Ярким примером является C. elegans , где апоптоз, вызванный повреждением ДНК в гонадах червей, отрицательно регулируется путем, включающим HIF-1. В частности, HIF-1 действует в сенсорных нейронах амфид ASJ, активируя члена семейства тирозиназ TYR-2. TYR-2 впоследствии секретируется из этих нейронов и подавляет CEP-1, гомолог p53, в гонадах, тем самым подавляя радиационно-индуцированный апоптоз (Sendoel et al., 2010). Таким образом, ясно, что нейроны особенно восприимчивы как к экзогенным, так и к эндогенным генотоксическим реагентам, и клетки могут реагировать как автономно, так и неклеточно автономно, чтобы способствовать выживанию.
Внутренний стресс развития и нервная система
Стрессовые состояния во внутренней соматической микросреде организма могут быть вызваны развитием (Simon and Keith, 2008). Несмотря на то, что развитие было признано дополнительным уровнем стресса, сведения о том, как оно влияет на нервную систему, ограничены. Стресс развития уникален по своей природе, будучи стереотипным во время эмбриональной и постэмбриональной жизни. Следовательно, ответы на этот стресс должны быть встроены в нейроны и в некоторых случаях могут служить необходимой частью их развития. Наиболее хорошо изученным стрессором во время развития является внутренняя гипоксия. В развивающемся эмбрионе гипоксические области естественным образом возникают в результате ограниченного содержания О 2 (Simon and Keith, 2008), где основной регулятор гипоксии, HIF-1, играет важную роль (Dunwoodie, 2009). Интересно, что низкие уровни кислорода во время развития важны для дифференцировки многих клеток и тканей (Morriss and New, 1979; Maltepe and Simon, 1998; Simon et al. , 2002), и исследования в культуре нейронов предполагают, что это также может быть верно для нейроны (Morrison et al., 2000; Studer et al., 2000). Следовательно, кажется, что развитие использует врожденное стрессовое состояние, такое как эмбриональная гипоксия, в качестве сигнала для формирования различных структур. Таким образом, было высказано предположение, что O 2 функционирует как морфоген развития (Simon and Keith, 2008). Кроме того, наблюдаемая толерантность к гипоксии незрелых в развитии нейронов по сравнению со зрелыми нейронами указывает на адаптацию нейронов к гипоксии, возникающей в процессе развития (Bickler and Buck, 1998).
, 2002), и исследования в культуре нейронов предполагают, что это также может быть верно для нейроны (Morrison et al., 2000; Studer et al., 2000). Следовательно, кажется, что развитие использует врожденное стрессовое состояние, такое как эмбриональная гипоксия, в качестве сигнала для формирования различных структур. Таким образом, было высказано предположение, что O 2 функционирует как морфоген развития (Simon and Keith, 2008). Кроме того, наблюдаемая толерантность к гипоксии незрелых в развитии нейронов по сравнению со зрелыми нейронами указывает на адаптацию нейронов к гипоксии, возникающей в процессе развития (Bickler and Buck, 1998).
Нейроны также могут помочь эмбриону преодолеть стресс, связанный с развитием, на поведенческом уровне. У прудовой улитки Helisoma trivolvis вращательное поведение ранних эмбрионов, управляемое ресничками, облегчает газообмен с окружающей жидкостью и регулируется парой серотонинергических сенсорно-моторных клеток, которые воспринимают уровни кислорода (Kuang and Goldberg, 2001; Kuang et al. ., 2002). Такое эмбриональное поведение наблюдалось и у других видов, например, у прудовика 9.0041 Lymnaea stagnalis (Byrne et al., 2009). Во время развития могут присутствовать и другие стрессоры. Например, окислительный стресс возникает в результате рутинного нейрогенеза у взрослых (Walton et al., 2012). Развивающийся мозг применяет различные защитные механизмы против окислительного стресса, обусловленного развитием (Ikonomidou and Kaindl, 2011), такие как дифференциальная экспрессия антиоксидантных систем во время развития мозга (Aspberg and Tottmar, 1992). Наконец, нервная система подвергается механическому стрессу из-за движения и увеличения массы мозга в процессе развития (Van Essen, 19).97; Бенард и Хоберт, 2009). Этот вызванный развитием механический стресс приводит к разнообразным реакциям нейронов на разных уровнях (Benard and Hobert, 2009). Приведенные выше примеры описывают существование стресса развития как важного аспекта биологии развития и стресса. Нейроны не только адаптируются к стрессу, но и требуют специфических стрессоров для правильного развития.
., 2002). Такое эмбриональное поведение наблюдалось и у других видов, например, у прудовика 9.0041 Lymnaea stagnalis (Byrne et al., 2009). Во время развития могут присутствовать и другие стрессоры. Например, окислительный стресс возникает в результате рутинного нейрогенеза у взрослых (Walton et al., 2012). Развивающийся мозг применяет различные защитные механизмы против окислительного стресса, обусловленного развитием (Ikonomidou and Kaindl, 2011), такие как дифференциальная экспрессия антиоксидантных систем во время развития мозга (Aspberg and Tottmar, 1992). Наконец, нервная система подвергается механическому стрессу из-за движения и увеличения массы мозга в процессе развития (Van Essen, 19).97; Бенард и Хоберт, 2009). Этот вызванный развитием механический стресс приводит к разнообразным реакциям нейронов на разных уровнях (Benard and Hobert, 2009). Приведенные выше примеры описывают существование стресса развития как важного аспекта биологии развития и стресса. Нейроны не только адаптируются к стрессу, но и требуют специфических стрессоров для правильного развития.
Старение и нервная система
Старение воспринимается как разрушительное воздействие времени на различные структуры живых организмов, и на сегодняшний день разработано множество теорий, объясняющих, как старение развивалось у разных организмов (Kirkwood and Austad, 2000). Ранние исследования показали связь между сенсорными нейронами и продолжительностью жизни (Apfeld and Kenyon, 19).99). Было обнаружено, что различные типы сенсорных нейронов регулируют продолжительность жизни C. elegans как положительным, так и отрицательным образом, что подчеркивает сложность, лежащую в основе такой регуляции (Alcedo and Kenyon, 2004; Bishop and Guarente, 2007; Lee and Kenyon, 2009; Shen). и др., 2010а,б). Нейроны могут влиять на продолжительность жизни не клеточно-автономным образом. Например, при специфичном для нейронов митохондриальном стрессе сигнал от нервной системы у C. elegans индуцирует митохондриально-специфический ответ развернутого белка в клетках кишечника, тем самым увеличивая продолжительность жизни животных (Durieux et al. , 2011). Кроме того, нейропротекция играет решающую роль в долголетии и старении (Murakami, 2007), а регуляция старения с помощью нейронов, по-видимому, консервативна в Drosophila (Parkes et al., 1999; Libert et al., 2007). Эта связь между сенсорными нейронами и долголетием показывает внеклеточное автономное влияние сигналов окружающей среды на старение организма.
, 2011). Кроме того, нейропротекция играет решающую роль в долголетии и старении (Murakami, 2007), а регуляция старения с помощью нейронов, по-видимому, консервативна в Drosophila (Parkes et al., 1999; Libert et al., 2007). Эта связь между сенсорными нейронами и долголетием показывает внеклеточное автономное влияние сигналов окружающей среды на старение организма.
Также известно, что старение влияет на отдельные нейроны. Помимо патологических состояний, таких как болезнь Альцгеймера и болезнь Паркинсона, которые были хорошо задокументированы на протяжении многих лет (Yankner et al., 2008; Hung et al., 2010), нейроны претерпевают важные морфологические и функциональные изменения при нормальном старении. Модели беспозвоночных широко использовались и выявили ряд возрастных нейронных событий. Например, Сенсорный рецептор C. elegans и холинергические нейроны обнаруживают зависящие от возраста морфологические дефекты, такие как дезорганизация цитоскелета, утолщение аксонов и дефасцикуляция (Pan et al. , 2011). Более того, неожиданное эктопическое ветвление нейритов недавно наблюдалось в нейронах C. elegans в результате старения (Tank et al., 2011). Хотя это ветвление связано с нарушением механосенсорного восприятия и снижением подвижности, оно, по-видимому, регулируется независимо от продолжительности жизни организма (Tank et al., 2011). Основываясь на этом представлении, мы могли бы предположить, что ветвление нейронов играет роль выживания старых червей в дикой природе, но не в лабораторных условиях, и что это не просто результат старения. Эта гипотеза также объясняет, почему ветвление регулируется возрастными путями, такими как Jun kinase и пути инсулина/IGF-1 (Tank et al., 2011). Поскольку известно, что эти пути влияют на пластичность нейронов у разных видов (Sherrin et al., 2011; Antoniou and Borsello, 2012; Fernandez and Torres-Aleman, 2012), неудивительно, что они также влияют на C. elegans Ветвление нейритов. Наконец, защита нейронов от старения в значительной степени зависит от общего образа жизни людей, например от диеты и физических упражнений, что еще больше подчеркивает сложность механизмов старения (Stranahan and Mattson, 2012).
, 2011). Более того, неожиданное эктопическое ветвление нейритов недавно наблюдалось в нейронах C. elegans в результате старения (Tank et al., 2011). Хотя это ветвление связано с нарушением механосенсорного восприятия и снижением подвижности, оно, по-видимому, регулируется независимо от продолжительности жизни организма (Tank et al., 2011). Основываясь на этом представлении, мы могли бы предположить, что ветвление нейронов играет роль выживания старых червей в дикой природе, но не в лабораторных условиях, и что это не просто результат старения. Эта гипотеза также объясняет, почему ветвление регулируется возрастными путями, такими как Jun kinase и пути инсулина/IGF-1 (Tank et al., 2011). Поскольку известно, что эти пути влияют на пластичность нейронов у разных видов (Sherrin et al., 2011; Antoniou and Borsello, 2012; Fernandez and Torres-Aleman, 2012), неудивительно, что они также влияют на C. elegans Ветвление нейритов. Наконец, защита нейронов от старения в значительной степени зависит от общего образа жизни людей, например от диеты и физических упражнений, что еще больше подчеркивает сложность механизмов старения (Stranahan and Mattson, 2012).
У высших организмов нормальное старение влияет на разные части мозга с разной скоростью (Woodruff-Pak et al., 2010) и влияет на синаптическую связность определенных областей мозга. Например, в обонятельной луковице у мышей синаптическая плотность обонятельных сенсорных нейронов уменьшается с возрастом в клубочковом слое, но не во внешнем плексиформном слое (Richard et al., 2010). Интересно, что другие характеристики нейронов, а также популяции нейронов в той же области не изменяются при старении (Richard et al., 2010). Такой избирательный эффект старения на разные синаптические популяции изучен недостаточно. Тем не менее, синаптическая дисфункция при старении сохраняется и наблюдалась у разных видов обезьян (Page et al., 2002; Duan et al., 2003) и у крыс, у которых исследование показало снижение числа аксодендритических синапсов на 27 %. средний молекулярный слой зубчатой извилины у 25-месячных особей по сравнению с 3-месячными (Бондарефф и Гейнисман, 1976). Связь между фенотипами нейронов, связанными со старением, и когнитивными нарушениями также не ясна. Интересное исследование дрозофилы недавно установило функциональную связь между потерей памяти и нарушением в специфических нейронах при нормальном старении (Tonoki and Davis, 2012). Авторы также смогли восстановить утраченные из-за старения воспоминания путем предварительной стимуляции этих нейронов (Tonoki and Davis, 2012). Несмотря на большое количество различных дефектов нейронов, связанных со старением, при нормальном старении погибает относительно небольшое количество нейронов (Herndon et al., 2002; Burke and Barnes, 2006). Однако недавнее исследование показало, что при старении в коре головного мозга нормального человеческого мозга происходит значительная и специфическая потеря гиперплоидных нейронов (нейронов, содержащих более чем диплоидное число хромосом) (Fischer et al., 2012). Такая специфическая потеря нейронов еще не показала, способствует ли она возрастным нарушениям. В целом, упадок нейронов, а не потеря нейронов, по-видимому, ответственен за негативные проявления нормального старения, такие как потеря памяти.
Интересное исследование дрозофилы недавно установило функциональную связь между потерей памяти и нарушением в специфических нейронах при нормальном старении (Tonoki and Davis, 2012). Авторы также смогли восстановить утраченные из-за старения воспоминания путем предварительной стимуляции этих нейронов (Tonoki and Davis, 2012). Несмотря на большое количество различных дефектов нейронов, связанных со старением, при нормальном старении погибает относительно небольшое количество нейронов (Herndon et al., 2002; Burke and Barnes, 2006). Однако недавнее исследование показало, что при старении в коре головного мозга нормального человеческого мозга происходит значительная и специфическая потеря гиперплоидных нейронов (нейронов, содержащих более чем диплоидное число хромосом) (Fischer et al., 2012). Такая специфическая потеря нейронов еще не показала, способствует ли она возрастным нарушениям. В целом, упадок нейронов, а не потеря нейронов, по-видимому, ответственен за негативные проявления нормального старения, такие как потеря памяти.
Причина изменений нейронов при старении до конца не изучена. Общим подозрением является повышенный окислительный стресс, что соответствует «теории старения окислительного стресса» (Gerschman et al., 1954; Harman, 1956; Cadet, 1988). Окислительный стресс представляет собой негативное влияние АФК на различные аспекты клеточной функции и может привести к молекулярным дефектам, таким как повреждение ДНК и митохондрий. Характерно, что гены, связанные с реакцией на стресс и репарацией ДНК, активируются в стареющем человеческом мозге (Lu et al., 2004). При нормальном старении образование АФК повышено из-за изменений в нейрональной обработке кальция и изменений в перекисном окислении липидов (Stranahan and Mattson, 2012). Эти молекулярные события могут приводить к подавлению нейрогенеза у взрослых и реализации альтернативных механизмов пластичности для компенсации поврежденной ткани (Stranahan and Mattson, 2012). Нейроны особенно уязвимы к окислительному стрессу, который может привести к гибели нейронных клеток, связанной со многими возрастными нейродегенеративными заболеваниями (Coyle and Puttfarcken, 19). 93; Андерсен, 2004). Тем не менее, недавние исследования ставят под сомнение роль окислительного стресса в старении (Doonan et al., 2008; Yen et al., 2009; Van Raamsdonk and Hekimi, 2010, 2012; Hekimi et al., 2011). Кроме того, хотя неизвестно, вовлечены ли какие-либо нейроны, умеренное повышение АФК может способствовать увеличению продолжительности жизни у C. elegans (Lee et al., 2010).
93; Андерсен, 2004). Тем не менее, недавние исследования ставят под сомнение роль окислительного стресса в старении (Doonan et al., 2008; Yen et al., 2009; Van Raamsdonk and Hekimi, 2010, 2012; Hekimi et al., 2011). Кроме того, хотя неизвестно, вовлечены ли какие-либо нейроны, умеренное повышение АФК может способствовать увеличению продолжительности жизни у C. elegans (Lee et al., 2010).
Таким образом, в целом старение активно регулируется нервной системой, а старение, в свою очередь, влияет на свойства нейронов. Природа старения как стрессора, по-видимому, выходит за рамки стресса окружающей среды и может распространяться на неизбежное снижение механизмов репарации, возможно, из-за физической энтропии.
Нейрональный гомеостаз
Способность нервной системы выполнять свою роль во многом зависит от ее гомеостатической способности. Этот процесс известен как «гомеостаз» и определяется как «поддержание постоянства внутренней среды» (Turrigiano and Nelson, 2004). Независимо от изменений в окружающей среде структурная и функциональная целостность нейронов должна сохраняться на протяжении всей жизни. Когда гомеостатические механизмы выходят из строя, нейроны угасают и становятся неспособными реагировать на внешние возмущения. Это приводит ко многим возрастным нейродегенеративным заболеваниям, а также к другим дефектам нейронов (Ramocki and Zoghbi, 2008). Во время развития нейроны и нейронные сети задействуют множество регуляторных механизмов, чтобы поддерживать свою функцию, несмотря на изменения в их микроокружении (Turrigiano and Nelson, 2004). Нервная система также подвергается различным физическим нагрузкам на протяжении всей жизни. Например, добавление новых клеток во взрослые нейронные цепи во время нейрогенеза имеет тенденцию дестабилизировать функциональность цепей и диктует гомеостатическую адаптацию на разных уровнях (Meltzer et al., 2005). Нейроны также могут подвергаться воздействию физических движений тела, мышечных сокращений и травм, и всем этим должны противостоять гомеостатические механизмы (Benard and Hobert, 2009).
Независимо от изменений в окружающей среде структурная и функциональная целостность нейронов должна сохраняться на протяжении всей жизни. Когда гомеостатические механизмы выходят из строя, нейроны угасают и становятся неспособными реагировать на внешние возмущения. Это приводит ко многим возрастным нейродегенеративным заболеваниям, а также к другим дефектам нейронов (Ramocki and Zoghbi, 2008). Во время развития нейроны и нейронные сети задействуют множество регуляторных механизмов, чтобы поддерживать свою функцию, несмотря на изменения в их микроокружении (Turrigiano and Nelson, 2004). Нервная система также подвергается различным физическим нагрузкам на протяжении всей жизни. Например, добавление новых клеток во взрослые нейронные цепи во время нейрогенеза имеет тенденцию дестабилизировать функциональность цепей и диктует гомеостатическую адаптацию на разных уровнях (Meltzer et al., 2005). Нейроны также могут подвергаться воздействию физических движений тела, мышечных сокращений и травм, и всем этим должны противостоять гомеостатические механизмы (Benard and Hobert, 2009). ). С этой целью нейроны используют компоненты внеклеточного матрикса, молекулы клеточной адгезии и белки цитоскелета для поддержания архитектурной целостности (Benard and Hobert, 2009). Таким образом, гомеостатические механизмы, по-видимому, действуют в направлении, противоположном старению и болезням, сложным и динамичным образом.
). С этой целью нейроны используют компоненты внеклеточного матрикса, молекулы клеточной адгезии и белки цитоскелета для поддержания архитектурной целостности (Benard and Hobert, 2009). Таким образом, гомеостатические механизмы, по-видимому, действуют в направлении, противоположном старению и болезням, сложным и динамичным образом.
Ключевые задействованные молекулы
Регуляция экспрессии белка в условиях стресса является сложной и включает такие механизмы, как регуляция эпигенетического гена, регуляция транскрипции и посттранскрипционная регуляция. Сообщалось, что многие молекулы у многих различных видов опосредуют клеточные реакции на стресс. Однако лишь часть из них играет специфическую роль в нейронах во время этих ответов (таблица 1). Мы суммируем здесь исследования некоторых ключевых молекул, участвующих в реакции нейронов на стресс.
Таблица 1 . молекулы, участвующие в нейрональных реакциях на различные стрессы в различных организмах .
Факторы транскрипции
Факторы, индуцируемые гипоксией
Факторы, индуцируемые гипоксией, являются ключевыми модуляторами реакций на гипоксический стресс. Они функционируют как гетеродимеры, состоящие из α, регулируемого кислородом, и стабильной β -субъединицы. Гетеродимер HIF связывается с промотором генов-мишеней через элементы реакции на гипоксию (HRE) с консенсусной последовательностью G/ACGTG (рис. 3А; Majmundar et al., 2010). Эти мишени регулируют огромный набор процессов, которые позволяют адаптации клеток к гипоксии. HIFα в первую очередь регулируется кислородзависимыми ферментами домена пролилгидроксилазы (PHD), которые приводят к его деградации с помощью белка-супрессора опухоли фон Хиппеля-Линдау (VHL) в условиях нормоксии (Epstein et al., 2001). В гипоксических условиях активность PHD уменьшается, а HIFα стабилизируется (рис. 3а; Epstein et al., 2001; Majmundar et al., 2010). Недавнее исследование в C. elegans также вовлекает гомолог сульфгидрилаз/цистеина (CYSL-1) в стабилизацию HIF-1α в нейронах через EGL-9, гомолог PHD червей, в ответ на внутриклеточный сероводород, полученный в результате гипоксии (H 2 S; рисунок 3A; Ma et al. , 2012).
, 2012).
Рисунок 3. Схематическое изображение различных основных молекулярных путей, участвующих в реакции нейронов на стресс . Подробное описание смотрите в тексте. (A) Роль HIF в реакции на гипоксию. (B) Роль HSF-1 в реакции на стресс. (C) Биогенез микроРНК. (D) Основные сигнальные пути, опосредующие реакцию нейронов на различные стрессы. Легенда: стрелки указывают путь потока и/или положительное влияние одного элемента на другой. Тупые стрелки указывают на ингибирование. Знак вопроса означает отсутствие информации. Ub, убиквитин; ТФ, факторы транскрипции.
Различные исследования показали особую роль HIF-1 в нейронах. Истощение HIF-1α в мозге мышей и в культурах нейрональных клеток вызывает повышенное повреждение клеток и снижение выживаемости после церебральной ишемии (Baranova et al., 2007). В нейронах коры головного мозга крыс HIF-1α, по-видимому, играет защитную роль на ранних стадиях реакции на умеренную гипоксию (Lopez-Hernandez et al. , 2012). Недавно было показано, что HIF-1α регулирует экспрессию прионного белка в нейрональных клетках гиппокампа для защиты от повреждения клеток (Jeong et al., 2012). Кроме того, неясно, играет ли HIF-1α центральную роль в гипоксическом прекондиционировании, как утверждают различные исследования (Grimm et al., 2005; Shao et al., 2007; Ara et al., 2011) или против (Li et al. ., 2011) такую роль. Хотя HIF-1 сохраняет нейропротекторные и антиапоптотические свойства, существуют экспериментальные данные, указывающие на неблагоприятное воздействие стабилизированного HIF-1α на нейрональную ткань. Например, стабилизация HIF-1 вызывает дефекты направления аксонов и миграции нейронов в C. elegans (Pocock and Hobert, 2008) и способствует нейродегенерации в мозге новорожденных крыс (Jiang et al., 2012). Кроме того, HIF-1 в C. elegans отрицательно регулирует увеличение продолжительности жизни за счет диетических ограничений, действуя на серотонинергические нейроны ADF и NSM (Chen et al.
, 2012). Недавно было показано, что HIF-1α регулирует экспрессию прионного белка в нейрональных клетках гиппокампа для защиты от повреждения клеток (Jeong et al., 2012). Кроме того, неясно, играет ли HIF-1α центральную роль в гипоксическом прекондиционировании, как утверждают различные исследования (Grimm et al., 2005; Shao et al., 2007; Ara et al., 2011) или против (Li et al. ., 2011) такую роль. Хотя HIF-1 сохраняет нейропротекторные и антиапоптотические свойства, существуют экспериментальные данные, указывающие на неблагоприятное воздействие стабилизированного HIF-1α на нейрональную ткань. Например, стабилизация HIF-1 вызывает дефекты направления аксонов и миграции нейронов в C. elegans (Pocock and Hobert, 2008) и способствует нейродегенерации в мозге новорожденных крыс (Jiang et al., 2012). Кроме того, HIF-1 в C. elegans отрицательно регулирует увеличение продолжительности жизни за счет диетических ограничений, действуя на серотонинергические нейроны ADF и NSM (Chen et al. , 2009). Однако исследования других групп сообщают, что в одном и том же организме HIF-1 способствует долголетию (Mehta et al., 2009; Zhang et al., 2009; Lee et al., 2010). Это несоответствие было рассмотрено в двух более поздних исследованиях, где было показано, что HIF-1 регулирует продолжительность жизни в зависимости от температуры (Hwang and Lee, 2011; Leiser et al., 2011). Таким образом, возможно, что роль HIF-1 в долголетии зависит от контекста и может вовлекать разные нейроны или другие клетки в разных условиях. Пока C. Elegans Нейроны также были обнаружены, которые ощущают и реагируют на гипоксию независимым от HIF (Park et al., 2012), HIF, по-видимому, являются основными факторами, опосредующими нейрональными реакциями на гипоксию посредством регуляции многих нисходящих потери эффекторы. И это несмотря на то, что нейропротекторные свойства HIF могут вызывать побочные эффекты в других аспектах физиологии нейронов.
, 2009). Однако исследования других групп сообщают, что в одном и том же организме HIF-1 способствует долголетию (Mehta et al., 2009; Zhang et al., 2009; Lee et al., 2010). Это несоответствие было рассмотрено в двух более поздних исследованиях, где было показано, что HIF-1 регулирует продолжительность жизни в зависимости от температуры (Hwang and Lee, 2011; Leiser et al., 2011). Таким образом, возможно, что роль HIF-1 в долголетии зависит от контекста и может вовлекать разные нейроны или другие клетки в разных условиях. Пока C. Elegans Нейроны также были обнаружены, которые ощущают и реагируют на гипоксию независимым от HIF (Park et al., 2012), HIF, по-видимому, являются основными факторами, опосредующими нейрональными реакциями на гипоксию посредством регуляции многих нисходящих потери эффекторы. И это несмотря на то, что нейропротекторные свойства HIF могут вызывать побочные эффекты в других аспектах физиологии нейронов.
Коэффициенты теплового шока и белки теплового шока
Коэффициенты теплового шока (HSF) являются индуцируемыми стрессом факторами транскрипции, которые при индукции положительно регулируют экспрессию белков теплового шока (HSP) посредством прямого связывания с их промоторами, содержащими элементы теплового шока (HSE; НГААН; Шамовский, Нудлер, 2008). Основным регулятором реакции теплового шока является HSF-1, который в нормальных условиях находится в мономерной неактивной форме (Shamovsky and Nudler, 2008). При различных условиях стресса HSF-1 образует активную тример, которая попадает в ядро для активации HSP (рис. 3B; Shamovsky and Nudler, 2008). Регуляция HSP с помощью HSF высококонсервативна от дрожжей до млекопитающих (Liu et al., 19).97). HSP функционируют как молекулярные шапероны, облегчающие правильное сворачивание других клеточных белков. Неправильный фолдинг белка может возникать в нормальных клеточных условиях и при различных стрессах. Также было показано, что чрезмерное возбуждение двигательных нейронов может вызывать неправильный фолдинг белков в постсинаптических мышечных клетках у C. elegans (Garcia et al., 2007). Индукция HSF в нейронах и других типах клеток стимулируется не только гипертермией, как следует из ее названия, но и другими стрессами, такими как гипоксия, изменения внутриклеточной окислительно-восстановительной среды и воздействие тяжелых металлов и аналогов аминокислот.
Основным регулятором реакции теплового шока является HSF-1, который в нормальных условиях находится в мономерной неактивной форме (Shamovsky and Nudler, 2008). При различных условиях стресса HSF-1 образует активную тример, которая попадает в ядро для активации HSP (рис. 3B; Shamovsky and Nudler, 2008). Регуляция HSP с помощью HSF высококонсервативна от дрожжей до млекопитающих (Liu et al., 19).97). HSP функционируют как молекулярные шапероны, облегчающие правильное сворачивание других клеточных белков. Неправильный фолдинг белка может возникать в нормальных клеточных условиях и при различных стрессах. Также было показано, что чрезмерное возбуждение двигательных нейронов может вызывать неправильный фолдинг белков в постсинаптических мышечных клетках у C. elegans (Garcia et al., 2007). Индукция HSF в нейронах и других типах клеток стимулируется не только гипертермией, как следует из ее названия, но и другими стрессами, такими как гипоксия, изменения внутриклеточной окислительно-восстановительной среды и воздействие тяжелых металлов и аналогов аминокислот. Моримото и др., 1997). Также было показано, что HSP активируются при ишемическом прекондиционировании (Liu et al., 1993; Kato et al., 1995). Нейропротекторные свойства HSF-1, основного регулятора реакции теплового шока у C. elegans , были продемонстрированы в двух недавних исследованиях, в которых активация HSF-1 подавляла дефектные фенотипы нейронов мутантной модели болезни Мачадо-Джозефа (Teixeira -Castro et al., 2011) и HSF-1, а также небольшой белок теплового шока HSP-16.1 опосредуют цитопротекцию путем термического прекондиционирования (Kourtis et al., 2012). Помимо HSPs, HSFs могут индуцировать транскрипцию др. белков с различными функциями (Akerfelt et al., 2010). Некоторые из них обладают нейропротекторными функциями при стрессе. Например, при тепловом шоке в Drosophila , HSF индуцируют экспрессию фермента синтеза NAD, никотинамидмононуклеотидаденилилтрансферазы (NMNAT), который имеет решающее значение для поддержания нейронов в условиях стресса (Ali et al., 2011).
Моримото и др., 1997). Также было показано, что HSP активируются при ишемическом прекондиционировании (Liu et al., 1993; Kato et al., 1995). Нейропротекторные свойства HSF-1, основного регулятора реакции теплового шока у C. elegans , были продемонстрированы в двух недавних исследованиях, в которых активация HSF-1 подавляла дефектные фенотипы нейронов мутантной модели болезни Мачадо-Джозефа (Teixeira -Castro et al., 2011) и HSF-1, а также небольшой белок теплового шока HSP-16.1 опосредуют цитопротекцию путем термического прекондиционирования (Kourtis et al., 2012). Помимо HSPs, HSFs могут индуцировать транскрипцию др. белков с различными функциями (Akerfelt et al., 2010). Некоторые из них обладают нейропротекторными функциями при стрессе. Например, при тепловом шоке в Drosophila , HSF индуцируют экспрессию фермента синтеза NAD, никотинамидмононуклеотидаденилилтрансферазы (NMNAT), который имеет решающее значение для поддержания нейронов в условиях стресса (Ali et al., 2011).
Экспрессия HSF-1 в нейронах строго контролируется (Dirks et al., 2010), а повышенная восприимчивость нейронов к воздействию теплового шока связана с отсроченным началом экспрессии HSF-1 (Batulan et al., 2003; Керн и др., 2010). Однако HSP могут играть более специфичную для нейронов роль в нормальных условиях, поскольку некоторые HSP конститутивно более сильно экспрессируются в нейронах, чем в других клетках (Chen and Brown, 2007). Недавно была признана полезная роль экспрессии HSP (Rordorf et al., 19).91) и может индуцироваться химическими соединениями, служащими лекарственными средствами против различных дегенеративных заболеваний (Katsuno et al., 2005; Chow, Brown, 2007). Многие HSFs и HSP также регулируются вверх и вниз во время нормального развития разных видов (Akerfelt et al., 2010), что может свидетельствовать о защитной роли этих белков в отношении внутреннего стресса развития. Более того, HSP связаны с нормальным и аномальным эмбриональным развитием (Evans et al., 2005; Brown et al. , 2007), и было показано, что экспрессия HSP зависит от фазы и ткани (Loones et al., 19).97; Масуда и др., 1998). HSF и HSP также участвуют в старении. Было показано, что Hsp22 при сверхэкспрессии в двигательных нейронах увеличивает продолжительность жизни Drosophila на 30% (Morrow et al., 2004), а мухи дольше сохраняют свою двигательную активность и становятся более устойчивыми к окислительному стрессу и гипертермии (Morrow et al. др., 2004). У C. elegans HSF-1 способствует долголетию, действуя на нейроны и другие ткани (Lithgow et al., 1995; Hsu et al., 2003; Morley and Morimoto, 2004). Наконец, реакция теплового шока термосенсорных нейронов AFD и AIY в C. elegans включает активацию белка Hsp70 (Prahlad et al., 2008). Таким образом, очевидно, что HSF и HSP участвуют в основных механизмах ответа на множество различных стрессов, имеющих особое значение для функции нервных клеток.
, 2007), и было показано, что экспрессия HSP зависит от фазы и ткани (Loones et al., 19).97; Масуда и др., 1998). HSF и HSP также участвуют в старении. Было показано, что Hsp22 при сверхэкспрессии в двигательных нейронах увеличивает продолжительность жизни Drosophila на 30% (Morrow et al., 2004), а мухи дольше сохраняют свою двигательную активность и становятся более устойчивыми к окислительному стрессу и гипертермии (Morrow et al. др., 2004). У C. elegans HSF-1 способствует долголетию, действуя на нейроны и другие ткани (Lithgow et al., 1995; Hsu et al., 2003; Morley and Morimoto, 2004). Наконец, реакция теплового шока термосенсорных нейронов AFD и AIY в C. elegans включает активацию белка Hsp70 (Prahlad et al., 2008). Таким образом, очевидно, что HSF и HSP участвуют в основных механизмах ответа на множество различных стрессов, имеющих особое значение для функции нервных клеток.
Сигнальные молекулы
Митоген-активируемые протеинкиназы
Митоген-активированные протеинкиназы (MAP) являются важными молекулами передачи сигнала, которые опосредуют ответ на сигналы окружающей среды практически во всех типах клеток и играют ключевые роли в клеточных функциях, таких как дифференцировка, клеточная выживаемость и апоптоз (Gehart et al. , 2010). Эта и другие общие роли некоторых МАР-киназ в нейронах были продемонстрированы несколько лет назад (Fukunaga and Miyamoto, 19).98). На сегодняшний день известны подсемейства МАРК, такие как киназы, регулируемые внеклеточными сигналами (ERK1/2), ERK5 (также известные как BMK1 или MAPK7), амино-концевые киназы Jun (JNK) 1–3 и p38. киназы (p38α, β, γ и δ; Gehart et al., 2010). Точное содержание и особенности различных путей MAPK описаны в другом месте (Dhillon et al., 2007). Однако общая схема передачи сигналов MAPK следует последовательности «стимул — G-белок — MAPKKK — MAPKK — MAPK-конечный ответ» (Dhillon et al., 2007). Пути MAPK, активируемые стрессом, по существу представляют собой киназы JNK и p38 (Fig. 3D; Dhillon et al., 2007).
, 2010). Эта и другие общие роли некоторых МАР-киназ в нейронах были продемонстрированы несколько лет назад (Fukunaga and Miyamoto, 19).98). На сегодняшний день известны подсемейства МАРК, такие как киназы, регулируемые внеклеточными сигналами (ERK1/2), ERK5 (также известные как BMK1 или MAPK7), амино-концевые киназы Jun (JNK) 1–3 и p38. киназы (p38α, β, γ и δ; Gehart et al., 2010). Точное содержание и особенности различных путей MAPK описаны в другом месте (Dhillon et al., 2007). Однако общая схема передачи сигналов MAPK следует последовательности «стимул — G-белок — MAPKKK — MAPKK — MAPK-конечный ответ» (Dhillon et al., 2007). Пути MAPK, активируемые стрессом, по существу представляют собой киназы JNK и p38 (Fig. 3D; Dhillon et al., 2007).
Путь JNK может быть индуцирован окислительным и осмотическим стрессом, УФ-излучением и другими агентами, повреждающими ДНК, для модуляции белка-активатора-1 (AP1) и других факторов транскрипции, таких как HSF-1 и HIF-1 (Park and Liu, 2001; Antoniou and Borsello, 2012) для регуляции клеточных реакций на стресс. Апоптоз нейронов после стресса положительно регулируется путем JNK (Weston and Davis, 2002; Biteau et al., 2011), и передача сигналов JNK/MAPK также участвует в регенерации аксонов после повреждения в C. elegans (Hammarlund et al., 2009; Yan et al., 2009; Li et al., 2012). Более того, путь JNK в нейронах способствует долголетию организма за счет активации нейропротекторных механизмов у Drosophila (Lee et al., 2009; Biteau et al., 2011; Takahama et al., 2012) и у C. elegans (Oh и др., 2005). Наконец, путь JNK может действовать, модулируя факторы транскрипции FOXO и противодействуя факторам инсулина/ИФР-1, чтобы регулировать различные аспекты стрессоустойчивости и старения (Wang et al., 2005; Neumann-Haefelin et al., 2008).
Апоптоз нейронов после стресса положительно регулируется путем JNK (Weston and Davis, 2002; Biteau et al., 2011), и передача сигналов JNK/MAPK также участвует в регенерации аксонов после повреждения в C. elegans (Hammarlund et al., 2009; Yan et al., 2009; Li et al., 2012). Более того, путь JNK в нейронах способствует долголетию организма за счет активации нейропротекторных механизмов у Drosophila (Lee et al., 2009; Biteau et al., 2011; Takahama et al., 2012) и у C. elegans (Oh и др., 2005). Наконец, путь JNK может действовать, модулируя факторы транскрипции FOXO и противодействуя факторам инсулина/ИФР-1, чтобы регулировать различные аспекты стрессоустойчивости и старения (Wang et al., 2005; Neumann-Haefelin et al., 2008).
Киназный путь р38 может индуцироваться стрессами, такими как гипоксия, окислительный стресс, ИК- и УФ-облучение, и он в основном участвует в индукции апоптоза нейронов при различных стрессах (Horstmann et al., 1998; Namgung and Xia, 2000; Чой и др. , 2004; Го и Бхат, 2007). Путь p38, по-видимому, также играет роль в нейропротекции против ишемии после прекондиционирования изофлураном (Zheng and Zuo, 2004). Однако путь р38 играет в нейронах другие роли, помимо реакции на стресс (Takeda and Ichijo, 2002).
, 2004; Го и Бхат, 2007). Путь p38, по-видимому, также играет роль в нейропротекции против ишемии после прекондиционирования изофлураном (Zheng and Zuo, 2004). Однако путь р38 играет в нейронах другие роли, помимо реакции на стресс (Takeda and Ichijo, 2002).
Мишень рапамицина
Мишень рапамицина (TOR) представляет собой эволюционно консервативную серин/треонинкиназу, играющую важную роль преимущественно в регуляции роста и пролиферации клеток, с последствиями во многих различных аспектах развития, старения и болезней (Wullschleger et al., 2006). ). TOR функционирует как датчик внеклеточных сигналов, включая стрессоры, такие как гипоксия и лишение питательных веществ, и обнаруживается в двух функционально различных комплексах, а именно TORC1 и TORC2 (рис. 3D). Ингибирование передачи сигналов TOR увеличивает продолжительность жизни многих организмов, включая мышей и Drosophila , частично за счет снижения трансляции мРНК (Harrison et al., 2009; Bjedov et al., 2010). Несмотря на то, что TOR млекопитающих экспрессируется повсеместно, он играет обширную роль в развитии и пластичности нейронов (Jaworski and Sheng, 2006; Chong et al., 2010; Hoeffer and Klann, 2010). Также недавно было обнаружено, что TOR важен для синаптического гомеостаза у Drosophila (Penney et al., 2012) и для синаптической пластичности после ишемии у крыс (Ghiglieri et al., 2010). mTOR может также участвовать в регуляции HIF-1alpha в развивающемся мозге крыс с гипоксией-ишемией (Chen et al., 2012). Однако роль передачи сигналов TOR в опосредовании стрессовых реакций в нейронах до конца не выяснена.
Несмотря на то, что TOR млекопитающих экспрессируется повсеместно, он играет обширную роль в развитии и пластичности нейронов (Jaworski and Sheng, 2006; Chong et al., 2010; Hoeffer and Klann, 2010). Также недавно было обнаружено, что TOR важен для синаптического гомеостаза у Drosophila (Penney et al., 2012) и для синаптической пластичности после ишемии у крыс (Ghiglieri et al., 2010). mTOR может также участвовать в регуляции HIF-1alpha в развивающемся мозге крыс с гипоксией-ишемией (Chen et al., 2012). Однако роль передачи сигналов TOR в опосредовании стрессовых реакций в нейронах до конца не выяснена.
Передача сигналов инсулина/ИФР-1. Путь инсулина/ИФР-1 — это хорошо изученный путь, который регулирует старение и продолжительность жизни у многих различных видов (van Heemst et al., 2005). Сложность пути передачи сигналов Insulin/IGF-1 (IIS) сильно возросла в ходе эволюции (van Heemst et al., 2005). У нематоды C. elegans , у которой участие этого пути в старении было впервые обнаружено и широко изучено, рецептор инсулиноподобного фактора роста DAF-2 активируется инсулиноподобными пептидами (ILP; 40 кодируется в геноме червя). которые в основном экспрессируются в нейронах (Pierce et al., 2001; Li et al., 2003; Husson et al., 2007; Cornils et al., 2011). После связывания лиганда сигнал передается непосредственно или через белок-1, гомолог субстрата инсулинового рецептора (IST-1), на фосфатидилинозитол-3-киназу (PI-3K), состоящую из каталитической субъединицы AGE-1 (изменение старения-1) и регуляторная субъединица ААР-1 (субъединица фосфоинозитидкиназы AdAPter), которая превращает фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) в фосфатидилинозитол 3,4,5-трифосфат (PIP 3 ; van Heemst, 2010). PIP 3 активирует 3-фосфоинозитид-зависимую протеинкиназу-1 (PDK1) и протеинкиназы B (известную как AKT-1/2), что приводит к фосфорилированию DAF-16, гомолога семейства FoxO млекопитающих факторы транскрипции (van Heemst, 2010). Фосфорилированный DAF-16 остается в цитоплазме, в то время как нефосфорилированный DAF-16 проникает в ядро, чтобы регулировать набор генов реакции на стресс (рис. 3D; Lin et al.
которые в основном экспрессируются в нейронах (Pierce et al., 2001; Li et al., 2003; Husson et al., 2007; Cornils et al., 2011). После связывания лиганда сигнал передается непосредственно или через белок-1, гомолог субстрата инсулинового рецептора (IST-1), на фосфатидилинозитол-3-киназу (PI-3K), состоящую из каталитической субъединицы AGE-1 (изменение старения-1) и регуляторная субъединица ААР-1 (субъединица фосфоинозитидкиназы AdAPter), которая превращает фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) в фосфатидилинозитол 3,4,5-трифосфат (PIP 3 ; van Heemst, 2010). PIP 3 активирует 3-фосфоинозитид-зависимую протеинкиназу-1 (PDK1) и протеинкиназы B (известную как AKT-1/2), что приводит к фосфорилированию DAF-16, гомолога семейства FoxO млекопитающих факторы транскрипции (van Heemst, 2010). Фосфорилированный DAF-16 остается в цитоплазме, в то время как нефосфорилированный DAF-16 проникает в ядро, чтобы регулировать набор генов реакции на стресс (рис. 3D; Lin et al. , 2001; Lee et al., 2003a; Murphy et al., 2003). .
, 2001; Lee et al., 2003a; Murphy et al., 2003). .
Хотя рецептор инсулина экспрессируется в нервной ткани (Havrankova et al., 1978; Unger et al., 1989) и его распределение, по-видимому, повышено в определенных областях мозга (Schulingkamp et al., 2000), его роль в нейронах не ясно. Поскольку нейроны могут поглощать глюкозу без участия инсулина или рецептора инсулина, эти клетки считались «нечувствительными к инсулину». Клайн и его коллеги предоставили первое доказательство in vivo того, что путь инсулина регулирует функцию нейронной цепи и поддержание синапсов в центральной нервной системе 9.0041 головастиков Xenopus (Chiu et al., 2008). Предыдущие исследования также продемонстрировали роль передачи сигналов инсулина в регуляции продолжительности жизни в нейронах C. elegans (Kenyon et al., 1993; Kimura et al., 1997; Apfeld and Kenyon, 1998; Wolkow et al., 2000). , в нейроэндокринных клетках дрозофилы (Tatar et al., 2001) и в мозге млекопитающих (Kappeler et al. , 2008). Ряд других исследований выявил роль нейронального инсулинового пути в энергетическом гомеостазе (Konner et al., 2011; Freude et al., 2012), синаптической пластичности (Oda et al., 2011; Costello et al., 2012), и апоптоз нейронов после гипоксического инсульта (Liu et al., 2011). Интересно, что IIS также регулирует обучение хемотаксису солей у C. elegans (Tomioka et al., 2006). Инсулиновый путь может также автономно действовать на неклеточные нейроны, чтобы регулировать старение нейронов (Pan et al., 2011), а также было показано, что он действует на нейроны, подавляя выживание организма в условиях гипоксии (Scott et al., 2002). В целом, роль инсулинового пути в нейронных тканях многих организмов может варьироваться от регуляции старения до чувствительности к гипоксии.
, 2008). Ряд других исследований выявил роль нейронального инсулинового пути в энергетическом гомеостазе (Konner et al., 2011; Freude et al., 2012), синаптической пластичности (Oda et al., 2011; Costello et al., 2012), и апоптоз нейронов после гипоксического инсульта (Liu et al., 2011). Интересно, что IIS также регулирует обучение хемотаксису солей у C. elegans (Tomioka et al., 2006). Инсулиновый путь может также автономно действовать на неклеточные нейроны, чтобы регулировать старение нейронов (Pan et al., 2011), а также было показано, что он действует на нейроны, подавляя выживание организма в условиях гипоксии (Scott et al., 2002). В целом, роль инсулинового пути в нейронных тканях многих организмов может варьироваться от регуляции старения до чувствительности к гипоксии.
Оксид азота
Оксид азота (NO) представляет собой свободный радикал, играющий важную роль в передаче сигналов клетками и выполняющий ряд физиологических функций, таких как синаптическая пластичность и нейротрансмиссия. Фермент, ответственный за продукцию NO в нейронах, представляет собой нейрональную синтазу оксида азота (nNOS), которая опосредует генерацию L -цитруллин из L -аргинина (рис. 3D; Zhou and Zhu, 2009). nNOS реагирует на уровни кислорода и активируется гипоксией в различных нейронах (AbuSoud et al., 1996; Prabhakar et al., 1996). NO регулирует различные факторы транскрипции, связанные со стрессом, такие как HIF-1 и NF-kB (Contestabile, 2008; Keswani et al., 2011), и может приводить к гибели нейронов при различных стрессовых условиях (Brown, 2010). Интересно, что NO в нейронах также может индуцироваться крайне низкочастотными магнитными полями (ELF-MF) в мозгу крыс, обычным стрессором, исходящим от электрических устройств (Cho et al., 2012). Таким образом, NO, по-видимому, является важной неорганической молекулой для реакции нейронов на стресс.
Фермент, ответственный за продукцию NO в нейронах, представляет собой нейрональную синтазу оксида азота (nNOS), которая опосредует генерацию L -цитруллин из L -аргинина (рис. 3D; Zhou and Zhu, 2009). nNOS реагирует на уровни кислорода и активируется гипоксией в различных нейронах (AbuSoud et al., 1996; Prabhakar et al., 1996). NO регулирует различные факторы транскрипции, связанные со стрессом, такие как HIF-1 и NF-kB (Contestabile, 2008; Keswani et al., 2011), и может приводить к гибели нейронов при различных стрессовых условиях (Brown, 2010). Интересно, что NO в нейронах также может индуцироваться крайне низкочастотными магнитными полями (ELF-MF) в мозгу крыс, обычным стрессором, исходящим от электрических устройств (Cho et al., 2012). Таким образом, NO, по-видимому, является важной неорганической молекулой для реакции нейронов на стресс.
МикроРНК
МикроРНК (миРНК) представляют собой небольшие некодирующие молекулы РНК длиной примерно 22 нуклеотида, которые действуют как посттранскрипционные регуляторы экспрессии генов (Ebert and Sharp, 2012). Они обладают способностью точно настраивать экспрессию, чтобы гарантировать стабильность при внезапных внешних или внутренних возмущениях или, при необходимости, обеспечивать выполнение новой программы экспрессии генов, которая позволяет организму выдерживать новую среду (Ebert and Sharp, 2012). miRNAs транскрибируются, в основном, РНК-полимеразой II (Pol II) в виде кэпированных и полиаденилированных первичных miRNAs (pri-miRNAs), которые складываются в удлиненные шпилечные структуры. pri-miRNAs расщепляются в ядре ферментом RNase III Drosha, создавая более короткие предшественники miRNA (pre-miRNA; Lee et al., 2003b). Пре-миРНК транспортируется экспортином-5 (XPO5) через нуклеопорный комплекс (NPC; Yi et al., 2003) из ядра (Lee et al., 2011), где далее процессируется ферментом РНКазой II, Dicer. , и включается в Argonaute-содержащий РНК-индуцированный комплекс молчания (RISC; Lee et al., 2002). В комплексе RISC миРНК связывается со специфической мРНК-мишенью путем несовершенного спаривания оснований с ее 3′-UTR и опосредует посттранскрипционную репрессию (PTR) или распад специфических мРНК-мишеней (рис.
Они обладают способностью точно настраивать экспрессию, чтобы гарантировать стабильность при внезапных внешних или внутренних возмущениях или, при необходимости, обеспечивать выполнение новой программы экспрессии генов, которая позволяет организму выдерживать новую среду (Ebert and Sharp, 2012). miRNAs транскрибируются, в основном, РНК-полимеразой II (Pol II) в виде кэпированных и полиаденилированных первичных miRNAs (pri-miRNAs), которые складываются в удлиненные шпилечные структуры. pri-miRNAs расщепляются в ядре ферментом RNase III Drosha, создавая более короткие предшественники miRNA (pre-miRNA; Lee et al., 2003b). Пре-миРНК транспортируется экспортином-5 (XPO5) через нуклеопорный комплекс (NPC; Yi et al., 2003) из ядра (Lee et al., 2011), где далее процессируется ферментом РНКазой II, Dicer. , и включается в Argonaute-содержащий РНК-индуцированный комплекс молчания (RISC; Lee et al., 2002). В комплексе RISC миРНК связывается со специфической мРНК-мишенью путем несовершенного спаривания оснований с ее 3′-UTR и опосредует посттранскрипционную репрессию (PTR) или распад специфических мРНК-мишеней (рис. 3C; Lee et al., 2002, 2003b). , 2011; Паскинелли, 2012). Надежность в системах, которые контролируют клеточную судьбу, переходы в развитии и реакцию на стресс, требуется в изменяющихся условиях, поскольку колебания внутренней или внешней среды могут быть фатальными для организма. miRNAs могут генерировать быстрые и обратимые ответы и, таким образом, являются идеальными молекулами для опосредования ответов на стресс. Как делеция отдельных микроРНК (Miska et al., 2007) или целых семейств микроРНК в C. elegans (Alvarez-Saavedra and Horvitz, 2010) практически не влияет на жизнеспособность и развитие, и, поскольку большинство мышей с нокаутом микроРНК не проявляют каких-либо выраженных фенотипов (Park et al., 2010), полагают, что основная функция miRNAs может заключаться в буферизации экспрессии генов, когда организм подвергается стрессовым воздействиям. Поддерживая эту идею, Zhang et al. показали, что делеция mir-71 нарушает долговременное выживание нематод во время индуцированной голоданием диапаузы L1 (Zhang et al.
3C; Lee et al., 2002, 2003b). , 2011; Паскинелли, 2012). Надежность в системах, которые контролируют клеточную судьбу, переходы в развитии и реакцию на стресс, требуется в изменяющихся условиях, поскольку колебания внутренней или внешней среды могут быть фатальными для организма. miRNAs могут генерировать быстрые и обратимые ответы и, таким образом, являются идеальными молекулами для опосредования ответов на стресс. Как делеция отдельных микроРНК (Miska et al., 2007) или целых семейств микроРНК в C. elegans (Alvarez-Saavedra and Horvitz, 2010) практически не влияет на жизнеспособность и развитие, и, поскольку большинство мышей с нокаутом микроРНК не проявляют каких-либо выраженных фенотипов (Park et al., 2010), полагают, что основная функция miRNAs может заключаться в буферизации экспрессии генов, когда организм подвергается стрессовым воздействиям. Поддерживая эту идею, Zhang et al. показали, что делеция mir-71 нарушает долговременное выживание нематод во время индуцированной голоданием диапаузы L1 (Zhang et al. , 2011b). Кроме того, было показано, что миР-7 необходима для поддержания регуляторной стабильности при температурном стрессе во время развития Орган чувств дрозофилы (Li et al., 2009b). miRNAs обильно экспрессируются в нервной системе, и связь между miRNAs и реакциями нейронов на стресс была продемонстрирована в различных модельных системах. Совсем недавно mir-71 также был связан с увеличением продолжительности жизни у C. elegans (Boulias and Horvitz, 2012). Это исследование показало, что экспрессия mir-71 только в нейронах была достаточной для стимулирования долголетия, опосредованного зародышевой линией, и предложила модель, в которой mir-71 опосредует сигналы, увеличивающие продолжительность жизни, через транскрипционный фактор DAF-16/FOXO в нервной системе. Прямой механизм, с помощью которого нейроны воспринимают внутреннее напряжение, не ясен; однако было показано, что функция миР-71 частично зависит от экспрессии TCER-1 (Boulias and Horvitz, 2012), фактора элонгации транскрипции, который, как было показано, способствует транскрипционной активности DAF-16 в кишечнике (Ghazi et al.
, 2011b). Кроме того, было показано, что миР-7 необходима для поддержания регуляторной стабильности при температурном стрессе во время развития Орган чувств дрозофилы (Li et al., 2009b). miRNAs обильно экспрессируются в нервной системе, и связь между miRNAs и реакциями нейронов на стресс была продемонстрирована в различных модельных системах. Совсем недавно mir-71 также был связан с увеличением продолжительности жизни у C. elegans (Boulias and Horvitz, 2012). Это исследование показало, что экспрессия mir-71 только в нейронах была достаточной для стимулирования долголетия, опосредованного зародышевой линией, и предложила модель, в которой mir-71 опосредует сигналы, увеличивающие продолжительность жизни, через транскрипционный фактор DAF-16/FOXO в нервной системе. Прямой механизм, с помощью которого нейроны воспринимают внутреннее напряжение, не ясен; однако было показано, что функция миР-71 частично зависит от экспрессии TCER-1 (Boulias and Horvitz, 2012), фактора элонгации транскрипции, который, как было показано, способствует транскрипционной активности DAF-16 в кишечнике (Ghazi et al. , 2009). Системный стресс также может быть вызван алкоголем, и было показано, что адаптация нейронов к этому стрессу вызывает быстрое увеличение миР-9.экспрессия в нейронах (Pietrzykowski et al., 2008). Это привело к транскрипции активируемой напряжением изоформы калиевого канала, связанной с повышением толерантности к алкоголю. Этот процесс может представлять собой общий механизм адаптации нейронов к алкоголю и предполагает, что miR-9 играет важную роль в пластичности нейронов (Pietrzykowski et al., 2008). Исследование первичных нейрональных клеток гиппокампа крысы также показало, что при гипоксии семейство miR-130 сильно экспрессируется (Saito et al., 2011). В частности, miR-130a, по-видимому, снижает уровни белка DDX6, нормальная функция которого заключается в ограничении мРНК HIF 1α (HIF-1α) P-тельцами нейрональных клеток гиппокампа мышей (Saito et al., 2011). При гипоксии из этих очагов высвобождается мРНК HIF-1α, и этот белок может регулировать кислородный гомеостаз (Saito et al., 2011).
, 2009). Системный стресс также может быть вызван алкоголем, и было показано, что адаптация нейронов к этому стрессу вызывает быстрое увеличение миР-9.экспрессия в нейронах (Pietrzykowski et al., 2008). Это привело к транскрипции активируемой напряжением изоформы калиевого канала, связанной с повышением толерантности к алкоголю. Этот процесс может представлять собой общий механизм адаптации нейронов к алкоголю и предполагает, что miR-9 играет важную роль в пластичности нейронов (Pietrzykowski et al., 2008). Исследование первичных нейрональных клеток гиппокампа крысы также показало, что при гипоксии семейство miR-130 сильно экспрессируется (Saito et al., 2011). В частности, miR-130a, по-видимому, снижает уровни белка DDX6, нормальная функция которого заключается в ограничении мРНК HIF 1α (HIF-1α) P-тельцами нейрональных клеток гиппокампа мышей (Saito et al., 2011). При гипоксии из этих очагов высвобождается мРНК HIF-1α, и этот белок может регулировать кислородный гомеостаз (Saito et al., 2011). Также было показано, что экспрессия miRNAs в ответ на стресс является клеточно-специфичной. В анализе на основе первичных клеточных культур астроциты и нейроны подвергались кислородно-глюкозной депривации для имитации ишемии, которая является важным признаком черепно-мозговых травм (Ziu et al., 2011). В этой модели разные панели miRNAs активировались в двух типах клеток, что указывает на то, что разные нейроны используют разные биохимические пути для ответа на физиологический стресс (Ziu et al., 2011). Вместе эти исследования показывают, что miRNAs вовлечены в реакции нейронов на стресс. Однако ожидается, что дальнейшие исследования ответят на дополнительные вопросы о том, как miRNAs регулируют реакцию нейронов на стресс и определят их влияние на гомеостаз организма.
Также было показано, что экспрессия miRNAs в ответ на стресс является клеточно-специфичной. В анализе на основе первичных клеточных культур астроциты и нейроны подвергались кислородно-глюкозной депривации для имитации ишемии, которая является важным признаком черепно-мозговых травм (Ziu et al., 2011). В этой модели разные панели miRNAs активировались в двух типах клеток, что указывает на то, что разные нейроны используют разные биохимические пути для ответа на физиологический стресс (Ziu et al., 2011). Вместе эти исследования показывают, что miRNAs вовлечены в реакции нейронов на стресс. Однако ожидается, что дальнейшие исследования ответят на дополнительные вопросы о том, как miRNAs регулируют реакцию нейронов на стресс и определят их влияние на гомеостаз организма.
Обсуждение
Физический мир построен на принципах, определяющих использование и управление энергией. Все эти принципы связаны основными законами физики и подчиняются одним и тем же основным ограничениям и ограничениям. Мы можем думать о живых организмах как о биологических двигателях, использующих свои структуры для использования энергии, чтобы выжить и размножаться в определенной среде. Негативное биологическое воздействие стресса на живые системы заключается в неспособности последних функционировать и продолжать использовать энергию при определенных условиях. Это может отражать либо ограниченность некоторых основных принципов, когда, например, никакая жизнь не может развиваться при температуре абсолютного нуля (-273 °C), либо отсутствие адаптации конкретного организма к данной среде, когда, например, слон не может выжить в Антарктиде, а белый медведь не может выжить в африканской саванне. Помимо таких крайних несоответствий между жизнью и условиями окружающей среды, есть более мягкие, которые определяют стресс, как мы обсуждаем здесь. Стрессовые условия часто различаются между организмами, поскольку разные виды адаптировались к разным условиям. Степень, в которой каждый вид принял механизмы защиты от стрессоров, может отражать степень наличия соответствующих условий в ходе эволюции.
Мы можем думать о живых организмах как о биологических двигателях, использующих свои структуры для использования энергии, чтобы выжить и размножаться в определенной среде. Негативное биологическое воздействие стресса на живые системы заключается в неспособности последних функционировать и продолжать использовать энергию при определенных условиях. Это может отражать либо ограниченность некоторых основных принципов, когда, например, никакая жизнь не может развиваться при температуре абсолютного нуля (-273 °C), либо отсутствие адаптации конкретного организма к данной среде, когда, например, слон не может выжить в Антарктиде, а белый медведь не может выжить в африканской саванне. Помимо таких крайних несоответствий между жизнью и условиями окружающей среды, есть более мягкие, которые определяют стресс, как мы обсуждаем здесь. Стрессовые условия часто различаются между организмами, поскольку разные виды адаптировались к разным условиям. Степень, в которой каждый вид принял механизмы защиты от стрессоров, может отражать степень наличия соответствующих условий в ходе эволюции.
Внутренний стресс, связанный с развитием, и старение также могут считаться селективными факторами для генов, дающих преимущество в выживании в ходе эволюции, точно так же, как это делает внешний стресс окружающей среды. Стресс, вызванный развитием, мог побудить организмы принять определенные программы развития, которые привели к окончательным структурам; и старение, возможно, выбрало молекулярные пути, которые приводят различные организмы к достижению продолжительности здоровья, соответствующей их экологической роли. Учитывая клеточные свойства нейронов и их задокументированное участие в реакциях на стресс, нервная система может представлять собой «горячую точку» для эволюционной адаптации организмов к различным стрессам. В этом смысле стресс можно рассматривать как движущую силу биоразнообразия в долгосрочной перспективе, которая, возможно, особенно применялась на разных уровнях нейронной организации для отбора разнообразных механизмов адаптации к стрессу, которые мы здесь представили. Однако роль нейронов в старении высших организмов еще недостаточно изучена. Большая часть наших знаний в этой области основана на моделях беспозвоночных, для которых характерно, что долгоживущие мутанты животных проявляют устойчивость к различным стрессам (Kourtis and Tavernarakis, 2011). Тем не менее, явно существует дополнительный уровень активной регуляции старения и долголетия нейронами, который выходит за рамки простой устойчивости к стрессу окружающей среды.
Однако роль нейронов в старении высших организмов еще недостаточно изучена. Большая часть наших знаний в этой области основана на моделях беспозвоночных, для которых характерно, что долгоживущие мутанты животных проявляют устойчивость к различным стрессам (Kourtis and Tavernarakis, 2011). Тем не менее, явно существует дополнительный уровень активной регуляции старения и долголетия нейронами, который выходит за рамки простой устойчивости к стрессу окружающей среды.
В течение жизни организма стрессовые условия создают нагрузку, с которой необходимо бороться и преодолевать ее, чтобы выжить и размножаться. Мы описали механизмы, разработанные для этой цели; однако стресс часто приводит к болезни и смерти. Этот стресс можно назвать «патофизиологическим стрессом», и он выходит за рамки данного обзора. Более того, бактериальные и другие инфекции представляют собой форму экологического стресса, который приводит к нейронным входам иммунных ответов, которые обсуждались в другом месте (Rosas-Ballina and Tracey, 2009). ).
).
Несмотря на множество суровых условий жизни организма, живые системы прекрасно справляются с внутренними и внешними стрессами и сохраняют гомеостатический баланс. Большая часть этой способности зависит от нервной системы, как мы описали в этом обзоре. Поскольку нейроны ощущают колебания условий, они используют эту информацию для организации соответствующих защитных и адаптационных реакций на разных уровнях (рис. 2). Кроме того, нейроны могут системно воздействовать на другие клетки, регулируя их реакцию на стресс. Важность роли нервной системы в реакциях на стресс просто подчеркивается хорошо известной способностью нейронов быстро реагировать на изменения окружающей среды. Эта способность интегрирует внешние данные в несколько различных линий защиты, от защиты клеток до поведенческих стратегий. О степени адаптации нейронов к различным стрессам в процессе своего развития также свидетельствует тот факт, что незрелые в развитии нейроны более устойчивы к гипоксии (Romero et al., 2003; Shirai et al. , 2006), чем их зрелые аналоги, тогда как зрелые нейроны более устойчивы к УФ и ИК, чем незрелые (Биклер и Бак, 1998). Эта устойчивость нейронов к разным стрессам на разных стадиях развития может отражать подверженность организмов этим стрессам в течение их жизни.
, 2006), чем их зрелые аналоги, тогда как зрелые нейроны более устойчивы к УФ и ИК, чем незрелые (Биклер и Бак, 1998). Эта устойчивость нейронов к разным стрессам на разных стадиях развития может отражать подверженность организмов этим стрессам в течение их жизни.
Природным системам также присущ элемент стресса, связанный со старением. Независимо от того, насколько совершенна окружающая среда и насколько хорошо организм приспособлен к этой среде, в конечном итоге организм функционально угасает. Вместо того, чтобы рассматривать старение как событие, которое наступает позже в биологическом «уравнении» живых систем, мы предлагаем рассматривать старение как дополнительный уровень стресса, который действует на протяжении всей жизни и связан с физической энтропией (рис. 1). Поскольку энергия не может быть преобразована из одной формы в другую без качественных потерь (второй закон термодинамики), каждая отдельная химическая реакция, осуществляемая клеткой, может способствовать старению. Подобные идеи были поддержаны другими (Hayflick, 2007 и ссылки в нем).
Подобные идеи были поддержаны другими (Hayflick, 2007 и ссылки в нем).
В настоящее время старение определяется как пострепродуктивный процесс, препятствующий отбору и передаче соответствующих генов следующему поколению. Однако ряд исследований в настоящее время показал, что многие молекулярные пути влияют на продолжительность жизни организма и что эти пути законсервированы среди видов. Наша гипотеза о том, что старение происходит до, во время и после размножения, может стать основой для эволюции генетической программы, регулирующей старение. В то же время стохастический характер старения из-за физической энтропии может объяснить различия в продолжительности жизни и экспрессии биомаркеров старения между генетически идентичными особями, например, в клонированных популяциях червей (Herndon et al., 2002). Однако для таких вариаций были предложены и другие объяснения, такие как эпигенетические модификации, происходящие в раннем развитии и во взрослом возрасте (Bell and Spector, 2011; Steves et al. , 2012).
, 2012).
В дополнение к активной реакции нейронов при определенных стрессах нейроны могут испытывать несколько побочных эффектов в стрессовых условиях. Различие между активным ответом нейронов и дефектом нейронов, вызванным стрессом, часто неясно. В лабораторных условиях потенциальное полезное преимущество нейронального фенотипа при воздействии стрессора может быть упущено из-за отсутствия условия, при котором этот фенотип способствует выживанию, и которое присутствует в естественной среде обитания организма. Однако во многих случаях, как мы описали, можно распознать сильное разрушающее воздействие напряжения на различные структуры.
Изучение внутреннего стресса, связанного с развитием, и его значения для развития эмбрионов и нейронов, по общему признанию, технически сложно. Очень немногие исследования четко показали влияние такого стресса на нормальное развитие (Zhang et al., 2011a), и меньшее их количество было посвящено нейронам (Benard and Hobert, 2009). Тем не менее, информация, полученная в результате этих исследований, обеспечивает основу для дальнейших исследований и дает первое представление о важности различных аспектов внутреннего стресса, связанного с развитием, для нормального развития.
В области биологии человека и мышей «стресс» в основном связан с психологической реакцией человека на стрессовые внешние раздражители и связан с центральной нервной системой, которая порождает такие чувства, как страх и тревога. Хотя это составляет очень важный аспект биологии «стресса», он чрезвычайно сложен по своему происхождению и проявлению. Поэтому мы считаем, что изучение первичного «напряжения» в редукционистской манере с использованием таких моделей, как C. elegans предоставит нам более подробную информацию о том, как нейроны выживают и реагируют на «стресс», и как он на них влияет. В пользу этого подхода свидетельствует множество примеров, когда психологический стресс включает механизм, аналогичный другим более основным аспектам стресса (Yao et al., 2007).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить А. Подоска из лаборатории Pocock за критическое прочтение рукописи. К. К. также благодарит Л. Релла и К. Коллина за полезные обсуждения. Эта работа финансировалась Европейским исследовательским советом (ERC), стартовый грант с номером 260807 для RP
References
Abraham, RT (2001). Передача сигналов контрольной точки клеточного цикла через киназы ATM и ATR. Гены Дев. 15, 2177–2196.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
AbuSoud, H.M., Rousseau, D.L., and Stuehr, D.J. (1996). Связывание оксида азота с гем нейрональной синтазы оксида азота связывает его активность с изменениями напряжения кислорода. Дж. Биол. хим. 271, 32515–32518.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Акерфельт, М., Моримото, Р. И., и Систонен, Л. (2010). Факторы теплового шока: интеграторы клеточного стресса, развития и продолжительности жизни. Нац. Преподобный Мол. Клеточная биол. 11, 545–555.
Нац. Преподобный Мол. Клеточная биол. 11, 545–555.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Альседо, Дж., и Кеньон, К. (2004). Регуляция продолжительности жизни C. elegans специфическими вкусовыми и обонятельными нейронами. Нейрон 41, 45–55.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Али, Ю. О., Маккормак, Р., Дарр, А., и Чжай, Р. Г. (2011). Никотинамидмононуклеотидаденилилтрансфераза представляет собой белок реакции на стресс, регулируемый путем фактора теплового шока/гипокси-индуцируемого фактора 1альфа. Дж. Биол. хим. 286, 19089–19099.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Альварес-Сааведра, Э., и Хорвиц, Х. Р. (2010). Многие семейства микроРНК C. elegans не являются необходимыми для развития или жизнеспособности. Курс. биол. 20, 367–373.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ан, Дж. Х., и Блэквелл, Т. К. (2003). SKN-1 связывает мезэнтодермальную спецификацию C. elegans с законсервированной реакцией на окислительный стресс. Гены Дев. 17, 1882–1893 гг.
Х., и Блэквелл, Т. К. (2003). SKN-1 связывает мезэнтодермальную спецификацию C. elegans с законсервированной реакцией на окислительный стресс. Гены Дев. 17, 1882–1893 гг.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Andersen, JK (2004). Окислительный стресс при нейродегенерации: причина или следствие? Нац. Мед. 10(Прил.), S18–S25.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Антониу, X., и Борселло, Т. (2012). Путь передачи сигналов JNK в головном мозге. Фронт. Бионауч. (Элитное издание) 4, 21:10–21:20.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Антониу, X., Гассманн, М., и Огуншола, О. О. (2011). Cdk5 взаимодействует с Hif-1alpha в нейронах: новый гипоксический сигнальный механизм? Мозг Res. 1381, 1–10.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Апфельд, Дж. , и Кеньон, К. (1998). Неавтономность клеток C. elegans daf-2 в регуляции диапаузы и продолжительности жизни. Сотовый 95, 199–210.
, и Кеньон, К. (1998). Неавтономность клеток C. elegans daf-2 в регуляции диапаузы и продолжительности жизни. Сотовый 95, 199–210.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Апфельд, Дж., и Кеньон, К. (1999). Регуляция продолжительности жизни посредством сенсорного восприятия у Caenorhabditis elegans. Природа 402, 804–809.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ара Дж., Фекете С., Франк М., Голден Дж. А., Удовольствие Д. и Валенсия И. (2011). Гипоксическое прекондиционирование индуцирует нейропротекцию против гипоксии-ишемии в головном мозге новорожденных поросят. Нейробиол. Дис. 43, 473–485.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Arenkiel, B.R., Hasegawa, H., Yi, J.J., Larsen, R.S., Wallace, M.L., Philpot, B.D., et al. (2011). Индуцированное активностью ремоделирование микросхем обонятельных луковиц, выявленное с помощью моносинаптической трассировки. PLoS ONE 6, e29423. doi:10.1371/journal.pone.0029423
PLoS ONE 6, e29423. doi:10.1371/journal.pone.0029423
CrossRef Полный текст
Арпино К., Д’Ардженцио Л., Тиккони К., Ди Паоло А., Стеллин В., Лопес Л. и др. др. (2005). Поражение головного мозга у недоношенных детей: этиологические пути. Энн. Ист. Супер. Санита 41, 229–237.
Опубликован Аннотация | Полный текст в публикации
Аспберг А. и Тоттмар О. (1992). Развитие антиоксидантных ферментов в мозге крысы и в реагрегационной культуре клеток головного мозга плода. Мозг Res. Дев. Мозг Res. 66, 55–58.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Баранова О., Миранда Л. Ф., Пичиуле П., Драгацис И., Джонсон Р. С. и Чавес Дж. К. (2007). Нейрон-специфическая инактивация индуцируемого гипоксией фактора 1 альфа увеличивает повреждение головного мозга в мышиной модели транзиторной фокальной церебральной ишемии. Дж. Неврологи. 27, 6320–6332.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Барзилай, А. , Битон, С., и Шайло, Ю. (2008). Роль реакции на повреждение ДНК в развитии, организации и поддержании нейронов. Восстановление ДНК (Amst.) 7, 1010–1027.
, Битон, С., и Шайло, Ю. (2008). Роль реакции на повреждение ДНК в развитии, организации и поддержании нейронов. Восстановление ДНК (Amst.) 7, 1010–1027.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Batulan, Z., Shinder, G.A., Minotti, S., He, B.P., Doroudchi, M., Nalbantoglu, J., et al. (2003). Высокий порог индукции стрессового ответа в мотонейронах связан с неспособностью активировать HSF1. Дж. Неврологи. 23, 5789–5798.
Опубликован Аннотация | Полный текст в публикации
Белл, Х.Дж., Иноуэ, Т., Шум, К., Лук, К., и Сайед, Н.И. (2007). Периферические чувствительные к кислороду клетки напрямую модулируют выход идентифицированного нейрона, генерирующего респираторный центральный паттерн. евро. Дж. Нейроски. 25, 3537–3550.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Белл, Дж. Т., и Спектор, Т. Д. (2011). Двойной подход к разгадке эпигенетики. Тенденции Жене. 27, 116–125.
27, 116–125.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Benard, C., and Hobert, O. (2009). Глядя дальше развития: поддержание архитектуры нервной системы. Курс. Верхний. Дев. биол. 87, 175–194.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Benard, C.Y., Boyanov, A., Hall, D.H., and Hobert, O. (2006). DIG-1, новый гигантский белок, неавтономно опосредует поддержание архитектуры нервной системы. Разработка 133, 3329–3340.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Bickler, P.E., and Buck, L.T. (1998). Адаптации нейронов позвоночных к гипоксии и аноксии: поддержание критических концентраций Са2+. Дж. Экспл. биол. 201, 1141–1152.
Опубликован Аннотация | Полный текст в публикации
Бишоп, Н.А., и Гуаренте, Л. (2007). Два нейрона опосредуют продолжительность жизни C. elegans, вызванную ограничением диеты. Природа 447, 545–549.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бито, Б., Карпак, Дж., Хванбо, Д., и Джаспер, Х. (2011). Регуляция продолжительности жизни дрозофилы с помощью передачи сигналов JNK. Экспл. Геронтол. 46, 349–354.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Бьедов И., Тойвонен Дж. М., Керр Ф., Слэк С., Якобсон Дж., Фоли А. и др. (2010). Механизмы увеличения продолжительности жизни рапамицином плодовой мушки Drosophila melanogaster. Метаб. клеток 11, 35–46.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Bondareff, W., and Geinisman, Y. (1976). Потеря синапсов в зубчатой извилине стареющей крысы. утра. Дж. Анат. 145, 129–136.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Boulias, K., and Horvitz, HR (2012). МикроРНК mir-71 C. elegans действует в нейронах, способствуя опосредованному зародышевой линией долголетию посредством регуляции DAF-16/FOXO. Метаб. клеток 15, 439–450.
Метаб. клеток 15, 439–450.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Brown, GC (2010). Оксид азота и гибель нейронов. Оксид азота 23, 153–165.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Брюер У., Вейх М.К., Исаев Н.К., Майзель А., Рушер К., Бергк А. и др. (1997). Индукция толерантности в корковых нейронах крысы: гипоксическое прекондиционирование. ФЭБС Письмо. 414, 117–121.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Берк, С. Н., и Барнс, Калифорния (2006). Нейронная пластичность в стареющем мозге. Нац. Преподобный Нейроски. 7, 30–40.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Burket, C.T., Higgins, C.E., Hull, L.C., Berninsone, P.M., and Ryder, E.F. (2006). Ген dig-1 C. elegans кодирует гигантский член суперсемейства иммуноглобулинов, который способствует фасцикуляции нейронных отростков. Дев. биол. 299, 193–205.
Дев. биол. 299, 193–205.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Браун, Д. Д., Кристин, К. С., Шоуэлл, К., и Конлон, Ф. Л. (2007). Небольшой белок теплового шока hsp27 необходим для правильного формирования сердечной трубки. Бытие 45, 667–678.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бирн, Р. А., Рандл, С. Д., Смиртуэйт, Дж. Дж., и Спайсер, Дж. И. (2009). Эмбриональное вращательное поведение у прудовика Lymnaea stagnalis: влияние кислорода окружающей среды и стадии развития. Зоология (Йена) 112, 471–477.
Опубликован Аннотация | Полный текст в публикации
Cadet, JL (1988). Свободнорадикальные механизмы в центральной нервной системе: обзор. Междунар. Дж. Нейроски. 40, 13–18.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чанг, А.Дж., и Баргманн, К.И. (2008). Гипоксия и путь транскрипции HIF-1 реорганизуют нейронную цепь для кислородозависимого поведения у Caenorhabditis elegans. Проц. Натл. акад. науч. США 105, 7321–7326.
Проц. Натл. акад. науч. США 105, 7321–7326.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Chechlacz, M., Vemuri, M.C., and Naegele, JR (2001). Роль ДНК-зависимой протеинкиназы в выживании нейронов. Дж. Нейрохим. 78, 141–154.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чен Д., Томас Э. Л. и Капахи П. (2009). HIF-1 модулирует опосредованное диетическими ограничениями увеличение продолжительности жизни посредством IRE-1 у Caenorhabditis elegans. Генетика PLoS. 5, е1000486. doi:10.1371/journal.pgen.1000486
CrossRef Full Text
Chen, H., Xiong, T., Qu, Y., Zhao, F., Ferriero, D., and Mu, D. (2012). mTOR активирует индуцируемый гипоксией фактор-1альфа и ингибирует апоптоз нейронов в развивающемся мозге крыс на ранней стадии после гипоксии-ишемии. Неврологи. лат. 507, 118–123.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чен, С. , и Браун, И. Р. (2007). Нейрональная экспрессия конститутивных белков теплового шока: значение для нейродегенеративных заболеваний. Шапероны клеточного стресса 12, 51–58.
, и Браун, И. Р. (2007). Нейрональная экспрессия конститутивных белков теплового шока: значение для нейродегенеративных заболеваний. Шапероны клеточного стресса 12, 51–58.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Cheng, I.H., Lin, Y.C., Hwang, E., Huang, H.T., Chang, W.H., Liu, Y.L., et al. (2011). Коллаген VI защищает от апоптоза нейронов, вызванного ультрафиолетовым облучением, посредством сигнального пути Akt/фосфатидилинозитол-3-киназы. Неврология 183, 178–188.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Чунг, Б.Х., Коэн, М., Роджерс, К., Албайрам, О., и Де Боно, М. (2005). Зависимая от опыта модуляция поведения C. elegans кислородом окружающей среды. Курс. биол. 15, 905–917.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чиу, С.Л., Чен, К.М., и Клайн, Х.Т. (2008). Передача сигналов инсулинового рецептора регулирует количество синапсов, пластичность дендритов и функцию цепи in vivo. Нейрон 58, 708–719.
Нейрон 58, 708–719.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Чо, С.И., Нам, Ю.С., Чу, Л.Ю., Ли, Дж.Х., Банг, Дж.С., Ким, Х.Р., и др. (2012). Чрезвычайно низкочастотные магнитные поля модулируют передачу сигналов оксида азота в мозгу крыс. Биоэлектромагнетизм 33, 568–574.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Choi, W.S., Eom, D.S., Han, B.S., Kim, W.K., Han, B.H., Choi, E.J., et al. (2004). Фосфорилирование p38 MAPK, вызванное окислительным стрессом, связано с активацией обоих путей апоптоза, опосредованных каспазой-8 и 9, в дофаминергических нейронах. Дж. Биол. хим. 279, 20451–20460.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чонг, З.З., Шанг, Ю.К., Чжан, Л., Ван, С., и Майезе, К. (2010). Млекопитающие-мишень рапамицина: попадание в яблочко для неврологических расстройств. Оксид. Мед. Клетка. Лонгев. 3, 374–391.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чоу, А. М., и Браун, И. Р. (2007). Индукция белков теплового шока в дифференцированных нейронах человека и грызунов целастролом. Шапероны клеточного стресса 12, 237–244.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Clark, D.A., Gabel, C.V., Gabel, H., and Samuel, A.D. (2007). Паттерны временной активности в термосенсорных нейронах свободно перемещающихся Caenorhabditis elegans кодируют пространственные температурные градиенты. Дж. Неврологи. 27, 6083–6090.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Contestabile, A. (2008). Регуляция факторов транскрипции оксидом азота в нейронах и опухолевых клетках нервного происхождения. Прог. Нейробиол. 84, 317–328.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Корнилс А., Глек М., Чен З., Чжан Ю. и Альседо Дж. (2011). Специфические инсулиноподобные пептиды кодируют сенсорную информацию для регулирования различных процессов развития. Разработка 138, 1183–1193.
и Альседо Дж. (2011). Специфические инсулиноподобные пептиды кодируют сенсорную информацию для регулирования различных процессов развития. Разработка 138, 1183–1193.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Костелло, Д. А., Кларет, М., Аль-Кассаб, Х., Платтнер, Ф., Ирвин, Э. Э., Чоудхури, А. И., и др. (2012). Делеция субстрата 2 рецептора инсулина в мозге нарушает синаптическую пластичность и метапластичность гиппокампа. PLoS One 7, e31124. doi:10.1371/journal.pone.0031124
CrossRef Full Text
Coyle, J.T., and Puttfarcken, P. (1993). Окислительный стресс, глутамат и нейродегенеративные расстройства. Наука 262, 689–695.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Culmsee, C., and Mattson, MP (2005). p53 в апоптозе нейронов. Биохим. Биофиз. Рез. коммун. 331, 761–777.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Далфо, Д. , Майклсон, Д., и Хаббард, Э. Дж. (2012). Сенсорная регуляция зародышевой линии C. elegans посредством TGF-бета-зависимой передачи сигналов в нише. Курс. биол. 22, 712–719.
, Майклсон, Д., и Хаббард, Э. Дж. (2012). Сенсорная регуляция зародышевой линии C. elegans посредством TGF-бета-зависимой передачи сигналов в нише. Курс. биол. 22, 712–719.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Доусон-Скалли, К., и Мелдрам Робертсон, Р. (1998). Тепловой шок защищает синаптическую передачу в двигательных схемах полета саранчи. Нейроотчет 9, 2589–2593.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Дакка, А., Вишванат, В., и Патапутян, А. (2006). Ионные каналы Trp и температурная чувствительность. год. Преподобный Нейроски. 29, 135–161.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Диллон А.С., Хаган С., Рат О. и Колх В. (2007). Сигнальные пути MAP-киназы при раке. Онкоген 26, 3279–3290.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Диркс, Р. П., Ван Гил, Р., Хенсен, С. М., Ван Дженесен, С. Т., и Лубсен, Н. Х. (2010). Манипулирование фактором теплового шока-1 у головастиков Xenopus: нейрональные ткани невосприимчивы к экзогенной экспрессии. PLoS ONE 5, e10158. doi:10.1371/journal.pone.0010158
П., Ван Гил, Р., Хенсен, С. М., Ван Дженесен, С. Т., и Лубсен, Н. Х. (2010). Манипулирование фактором теплового шока-1 у головастиков Xenopus: нейрональные ткани невосприимчивы к экзогенной экспрессии. PLoS ONE 5, e10158. doi:10.1371/journal.pone.0010158
CrossRef Full Text
Доманска-Яник К., Бонг П., Брониш-Ковальчик А., Заяц Х. и Заблока Б. (1999). Активация транскрипционного фактора AP1 и ее связь с апоптозом пирамидных нейронов CA1 гиппокампа после транзиторной ишемии у песчанок. J. Neurosci. Рез. 57, 840–846.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Дунан, Р., МакЭлви, Дж. Дж., Маттиссенс, Ф., Уокер, Г. А., Хаутхуфд, К., Бэк, П., и др. (2008). Против теории окислительного повреждения старения: супероксиддисмутазы защищают от окислительного стресса, но мало или совсем не влияют на продолжительность жизни Caenorhabditis elegans. Гены Дев. 22, 3236–3241.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Duan, H. , Wearne, S.L., Rocher, A.B., Macedo, A., Morrison, JH, and Hof, P.R. (2003). Возрастные изменения дендритов и шипов в кортикокортикально выступающих нейронах у макак. Церебр. Кортекс 13, 950–961.
, Wearne, S.L., Rocher, A.B., Macedo, A., Morrison, JH, and Hof, P.R. (2003). Возрастные изменения дендритов и шипов в кортикокортикально выступающих нейронах у макак. Церебр. Кортекс 13, 950–961.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Dunwoodie, SL (2009). Роль гипоксии в развитии зародыша млекопитающих. Дев. Ячейка 17, 755–773.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Durieux, J., Wolff, S., and Dillin, A. (2011). Неавтономная клеточная природа долголетия, опосредованного цепью переноса электронов. сотовый 144, 79–91.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Эберт, М.С., и Шарп, П.А. (2012). Роль микроРНК в придании устойчивости биологическим процессам. Сотовый 149, 515–524.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Эмото, К., Пэрриш, Дж. З., Ян, Л. Ю., и Ян, Ю. Н. (2006). Опухолевой супрессор Hippo действует с киназами NDR на мозаичную структуру дендритов и их поддержание. Природа 443, 210–213.
Н. (2006). Опухолевой супрессор Hippo действует с киназами NDR на мозаичную структуру дендритов и их поддержание. Природа 443, 210–213.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Эпштейн, А. С. Р., Глидл, Дж. М., Макнейл, Л. А., Хьюитсон, К. С., О’Рурк, Дж., Моул, Д. Р., и др. (2001). C-elegans EGL-9 и гомологи млекопитающих определяют семейство диоксигеназ, которые регулируют HIF путем гидроксилирования пролила. Сотовый 107, 43–54.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Эванс, Т. Г., Ямамото, Ю., Джеффри, В. Р., и Кроун, П. Х. (2005). Рыбкам данио Hsp70 необходим для формирования хрусталика эмбриона. Шапероны клеточного стресса 10, 66–78.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Фернандес, А. М., и Торрес-Алеман, И. (2012). Многоликая передача сигналов инсулиноподобным пептидом в головном мозге. Нац. Преподобный Нейроски. 13, 225–239.
13, 225–239.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Фишер Х.Г., Моравски М., Брукнер М.К., Миттаг А., Тарнок А. и Арендт Т. (2012). Изменение состава ДНК нейронов в головном мозге человека при старении. Ячейка старения 11, 628–633.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Freude, S., Schilbach, K., Hettich, M.M., Bronneke, H.S., Zemva, J., Krone, W., et al. (2012). Нейрон-специфическая делеция одной копии гена рецептора инсулиноподобного фактора роста-1 уменьшает накопление жира при старении. Горм. Метаб. Рез. 44, 99–104.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Фукунага К. и Миямото Э. (1998). Роль MAP-киназы в нейронах. Мол. Нейробиол. 16, 79–95.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ган, Л., и Маке, Л. (2008). Пути конвергенции: сиртуины при старении и нейродегенерации. Нейрон 58, 10–14.
Нейрон 58, 10–14.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Гарсия С.М., Казануева М.О., Сильва М.С., Амарал М.Д. и Моримото Р.И. (2007). Передача сигналов нейронами модулирует белковый гомеостаз в постсинаптических мышечных клетках Caenorhabditis elegans. Гены Дев. 21, 3006–3016.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Гехарт, Х., Кумпф, С., Иттнер, А., и Риччи, Р. (2010). Передача сигналов MAPK в клеточном метаболизме: стресс или здоровье? EMBO Rep. 11, 834–840.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Гершман, Р., Гилберт, Д.Л., Най, С.В., Двайер, П., и Фенн, У.О. (1954). Кислородное отравление и рентгеновское облучение: общий механизм. Наука 119, 623–626.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Гази А., Хенис-Коренблит С. и Кеньон К. (2009). Фактор удлинения транскрипции, который связывает сигналы от репродуктивной системы с увеличением продолжительности жизни у Caenorhabditis elegans. Генетика PLoS. 5, е1000639. doi:10.1371/journal.pgen.1000639
(2009). Фактор удлинения транскрипции, который связывает сигналы от репродуктивной системы с увеличением продолжительности жизни у Caenorhabditis elegans. Генетика PLoS. 5, е1000639. doi:10.1371/journal.pgen.1000639
CrossRef Полный текст
Гильери, В., Пендолино, В., Багетта, В., Сгобио, К., Калабрези, П., и Пиккони, Б. (2010). Ингибитор mTOR рапамицин подавляет стриарную постишемическую LTP. Экспл. Нейрол. 226, 328–331.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Gozzo, Y., Vohr, B., Lacadie, C., Hampson, M., Katz, K.H., Maller-Kesselman, J., et al. (2009). Изменения в нейронных связях у недоношенных детей в школьном возрасте. Нейроизображение 48, 458–463.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Гримм К., Герман Д. М., Богданова А., Хотоп С., Килич У., Венцель А. и др. (2005). Нейропротекция путем гипоксического прекондиционирования: HIF-1 и эритропоэтин защищают от дегенерации сетчатки. Семин. Сотовый Дев. биол. 16, 531–538.
Семин. Сотовый Дев. биол. 16, 531–538.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Го, Г., и Бхат, Н. Р. (2007). p38alpha MAP-киназа опосредует индуцированную гипоксией гибель двигательных нейронов: потенциальная мишень нейропротекторного действия миноциклина. Нейрохим. Рез. 32, 2160–2166.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Halterman, M.W., Gill, M., Dejesus, C., Ogihara, M., Schor, N.F., and Federoff, HJ (2010). Фактор стрессовой реакции эндоплазматического ретикулума CHOP-10 защищает от гибели нейронов, вызванной гипоксией. Дж. Биол. хим. 285, 21329–21340.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E.M., and Bastiani, M. (2009). Для регенерации аксонов требуется консервативный путь киназы MAP. Наука 323, 802–806.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Harman, D. (1956). Старение: теория, основанная на свободнорадикальной и радиационной химии. Дж. Геронтол. 11, 298–300.
(1956). Старение: теория, основанная на свободнорадикальной и радиационной химии. Дж. Геронтол. 11, 298–300.
Опубликован Аннотация | Полный текст в публикации
Harrison, D.E., Strong, R., Sharp, Z.D., Nelson, J.F., Astle, C.M., Flurkey, K., et al. (2009). Рапамицин, вводимый в конце жизни, увеличивает продолжительность жизни генетически гетерогенных мышей. Природа 460, 392–395.
Опубликован Аннотация | Полный текст в публикации
Хавранкова Дж., Рот Дж. и Браунштейн М. (1978). Рецепторы инсулина широко распространены в центральной нервной системе крыс. Природа 272, 827–829.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хейфлик, Л. (2007). Энтропия объясняет старение, генетический детерминизм объясняет долголетие, а неопределенная терминология объясняет непонимание обоих. Генетика PLoS. 3, е220. doi:10.1371/journal.pgen.0030220
CrossRef Full Text
Hekimi, S., Lapointe, J. , and Wen, Y. (2011). Взгляните «хорошо» на свободные радикалы в процессе старения. Trends Cell Biol. 21, 569–576.
, and Wen, Y. (2011). Взгляните «хорошо» на свободные радикалы в процессе старения. Trends Cell Biol. 21, 569–576.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Henderson, CE (1996). Роль нейротрофических факторов в развитии нейронов. Курс. мнение Нейробиол. 6, 64–70.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Herndon, L.A., Schmeissner, P.J., Dudaronek, J.M., Brown, P.A., Listner, K.M., Sakano, Y., et al. (2002). Стохастические и генетические факторы влияют на тканеспецифическое снижение старения C. elegans. Природа 419, 808–814.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Херруп, К. (2012). Вклад незапланированных событий нейронального клеточного цикла в гибель нейронов при болезни Альцгеймера. Фронт. Бионауч. (Элитное издание) 4, 2101–2109.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Херруп, К. , Нив, Р., Акерман, С.Л., и Копани, А. (2004). Разделяйся и умирай: события клеточного цикла как триггеры гибели нервных клеток. J. Neurosci. 24, 9232–9239.
, Нив, Р., Акерман, С.Л., и Копани, А. (2004). Разделяйся и умирай: события клеточного цикла как триггеры гибели нервных клеток. J. Neurosci. 24, 9232–9239.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хоффер, К.А., и Кланн, Э. (2010). Сигнализация mTOR: на перекрестке пластичности, памяти и болезней. Trends Neurosci. 33, 67–75.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Хуземанс, Дж. Дж., и Шепер, В. (2012). Эндоплазматический ретикулум: реакция развернутого белка связана с нейродегенерацией. Междунар. Дж. Биохим. Клеточная биол. 44, 1295–1298.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Horstmann, S., Kahle, P.J., и Borasio, G.D. (1998). Ингибиторы митоген-активируемой протеинкиназы p38 способствуют выживанию нейронов in vitro. J. Neurosci. Рез. 52, 483–490.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Хсу, А. Л., Мерфи, К.Т., и Кеньон, К. (2003). Регуляция старения и возрастных заболеваний с помощью DAF-16 и фактора теплового шока. Наука 300, 1142–1145.
Л., Мерфи, К.Т., и Кеньон, К. (2003). Регуляция старения и возрастных заболеваний с помощью DAF-16 и фактора теплового шока. Наука 300, 1142–1145.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хунг, К.В., Чен, Ю.К., Се, В.Л., Чиоу, С.Х., и Као, К.Л. (2010). Старение и нейродегенеративные заболевания. Сопротивление старению. Ред. 9 (Приложение 1), S36–S46.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хассон, С. Дж., Мертенс, И., Янссен, Т., Линдеманс, М., и Шофс, Л. (2007). Нейропептидергическая передача сигналов у нематоды Caenorhabditis elegans. Прог. Нейробиол. 82, 33–55.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Хванг, А.Б., и Ли, С.Дж. (2011). Регуляция продолжительности жизни митохондриальным дыханием: связь HIF-1 и АФК. Старение (Олбани, штат Нью-Йорк) 3, 304–310.
Опубликован Аннотация | Pubmed Full Text
Идэ Ф. , Иида Н., Накацуру Ю., Ода Х., Никайдо О. и Исикава Т. (2000). Обнаружение ультрафиолетовых фотопродуктов in vivo и их репарация в клетках Пуркинье. Лаб. Инвестировать. 80, 465–470.
, Иида Н., Накацуру Ю., Ода Х., Никайдо О. и Исикава Т. (2000). Обнаружение ультрафиолетовых фотопродуктов in vivo и их репарация в клетках Пуркинье. Лаб. Инвестировать. 80, 465–470.
Опубликован Аннотация | Полный текст публикации
Икономиду, К., и Кайндл, А.М. (2011). Гибель нейронов и окислительный стресс в развивающемся мозге. Антиоксидант. Окислительно-восстановительный сигнал. 14, 1535–1550.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Изуми, Н., Ямасита, А., и Оно, С. (2012). Комплексная регуляция PIKK-опосредованных стрессовых реакций с помощью AAA+ белков RUVBL1 и RUVBL2. Ядро 3, 29–43.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Яворски, Дж., и Шэн, М. (2006). Растущая роль mTOR в развитии и пластичности нейронов. Мол. Нейробиол. 34, 205–219.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Jensen, H. A., Loukogeorgakis, S., Yannopoulos, F., Rimpilainen, E., Petzold, A., Tuominen, H., et al. (2011). Дистанционное ишемическое прекондиционирование защищает мозг от повреждения после гипотермической остановки кровообращения. Тираж 123, 714–721.
A., Loukogeorgakis, S., Yannopoulos, F., Rimpilainen, E., Petzold, A., Tuominen, H., et al. (2011). Дистанционное ишемическое прекондиционирование защищает мозг от повреждения после гипотермической остановки кровообращения. Тираж 123, 714–721.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Чон, Дж. К., Сео, Дж. С., Мун, М. Х., Ли, Ю. Дж., Сеол, Дж. В., и Пак, С. Ю. (2012). Индуцируемый гипоксией фактор-1 альфа регулирует экспрессию прионного белка для защиты от повреждения нейронных клеток. Нейробиол. Старение 33, 1006 e1001–1010.
CrossRef Full Text
Jiang, H., Huang, Y., Xu, H., Sun, Y., Han, N., and Li, Q. F. (2012). Индуцируемый гипоксией фактор-1альфа участвует в нейродегенерации, индуцированной изофлураном в головном мозге новорожденных крыс. J. Нейрохим. 120, 453–460.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Джонсон, Р. П., и Крамер, Дж. М. (2012). Нейронная роль поддержания матричного рецептора дистрогликана и комплекса ядерного крепления у Caenorhabditis elegans. Генетика 190, 1365–1377.
Нейронная роль поддержания матричного рецептора дистрогликана и комплекса ядерного крепления у Caenorhabditis elegans. Генетика 190, 1365–1377.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Джолли С., Журниак Н., Ноде Ф., Гаутерон В., Мариани Дж. и Верне-Дер Гарабедян Б. (2011). Клеточно-автономные и неклеточно-автономные нейропротекторные функции ROR-альфа в нейронах и астроцитах при гипоксии. Дж. Неврологи. 31, 14314–14323.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Камеяма Ю. и Иноуэ М. (1994). Радиационное поражение развивающейся нервной системы: механизмы повреждения нейронов. Нейротоксикология 15, 75–80.
Опубликован Аннотация | Pubmed Full Text
Kappeler, L., Filho, C.D.M., Dupont, J., Leneuve, P., Cervera, P., Perin, L., et al. (2008). Мозговые рецепторы IGF-1 контролируют рост и продолжительность жизни млекопитающих посредством нейроэндокринного механизма. PLoS Биол. 6, е254. doi:10.1371/journal.pbio.0060254
PLoS Биол. 6, е254. doi:10.1371/journal.pbio.0060254
CrossRef Full Text
Karunanithi, S., Barclay, J.W., Robertson, R.M., Brown, I.R., and Atwood, H.L. (1999). Нейропротекция в синапсах дрозофилы, обеспечиваемая предшествующим тепловым шоком. J. Neurosci. 19, 4360–4369.
Опубликован Аннотация | Полный текст публикации
Като Х., Араки Т., Итояма Ю., Когуре К. и Като К. (1995). Иммуногистохимическое исследование белка теплового шока-27 в гиппокампе на модели церебральной ишемии и толерантности к ишемии у песчанок. Неврология 68, 65–71.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Кацуно, М., Санг, К., Адачи, Х., Минамияма, М., Ваза, М., Танака, Ф., и др. (2005). Фармакологическая индукция белков теплового шока облегчает заболевание двигательных нейронов, опосредованное полиглутамином. Проц. Натл. акад. науч. США 102, 16801–16806.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Кеньон, К. , Чанг, Дж., Генш, Э., Руднер, А., и Табтианг, Р. (1993). Мутант C-elegans, который живет в два раза дольше, чем дикий тип. Природа 366, 461–464.
, Чанг, Дж., Генш, Э., Руднер, А., и Табтианг, Р. (1993). Мутант C-elegans, который живет в два раза дольше, чем дикий тип. Природа 366, 461–464.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Керн, А., Акерманн, Б., Клемент, А. М., Дюрк, Х., и Бел, К. (2010). Контролируемая HSF1 и связанная с возрастом способность шаперонов в нейронах и мышечных клетках C. elegans. PLoS ONE 5, e8568. doi:10.1371/journal.pone.0008568
CrossRef Полный текст
Кесвани, С. К., Бош-Марс, М., Рид, Н., Фишер, А., Семенза, Г. Л., и Хок, А. (2011). Оксид азота предотвращает дегенерацию аксонов, индуцируя HIF-1-зависимую экспрессию эритропоэтина. Проц. Натл. акад. науч. США 108, 4986–4990.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Кимура, К.Д., Тиссенбаум, Х.А., Лю, Ю.С., и Рувкун, Г. (1997). daf-2, ген, подобный рецептору инсулина, который регулирует продолжительность жизни и диапаузу у Caenorhabditis elegans. Наука 277, 942–946.
Наука 277, 942–946.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Кирквуд, Т.Б.Л., и Остад, С.Н. (2000). Почему мы стареем? Природа 408, 233–238.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Китагава К., Мацумото М., Кувабара К., Тагая М., Оцуки Т., Хата Р. и др. (1991). Феномен толерантности к ишемии обнаружен в различных областях головного мозга. Мозг Res. 561, 203–211.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Клайн, Д. Д., Рамирес-Наварро, А., и Кунце, Д. Л. (2007). Адаптивная депрессия синаптической передачи в ядре одиночного тракта после хронической перемежающейся гипоксии in vivo: свидетельство гомеостатической пластичности. Дж. Неврологи. 27, 4663–4673.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Клячко В.А. и Стивенс К.Ф. (2006). Температурно-зависимый сдвиг баланса между компонентами кратковременной пластичности в синапсах гиппокампа. J. Neurosci. 26, 6945–6957.
J. Neurosci. 26, 6945–6957.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Коннер, А. К., Хесс, С., Товар, С., Месарос, А., Санчес-Лашерас, К., Эверс, Н., и др. (2011). Роль передачи сигналов инсулина в катехоламинергических нейронах в контроле энергетического гомеостаза. Метаб. клеток 13, 720–728.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Куртис, Н., Николетопулу, В., и Тавернаракис, Н. (2012). Небольшие белки теплового шока защищают от нейродегенерации, связанной с тепловым ударом. Природа 490, 213–218.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куртис, Н., и Тавернаракис, Н. (2011). Пути клеточной реакции на стресс и старение: сложные молекулярные взаимосвязи. EMBO J. 30, 2520–2531.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Круман И.И., Версто Р.П., Кардозо-Пелаес Ф. , Смиленов Л., Чан С.Л., Хрест Ф.Дж. и др. (2004). Активация клеточного цикла связана с гибелью нейронов, вызванной повреждением ДНК. Нейрон 41, 549–561.
, Смиленов Л., Чан С.Л., Хрест Ф.Дж. и др. (2004). Активация клеточного цикла связана с гибелью нейронов, вызванной повреждением ДНК. Нейрон 41, 549–561.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куанг С. и Голдберг Дж. И. (2001). Лазерная абляция выявляет регуляцию активности ресничек серотонинергическими нейронами у эмбрионов моллюсков. J. Нейробиол. 47, 1–15.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Куанг, С. Х., Доран, С. А., Уилсон, Р. Дж. А., Госс, Г. Г., и Голдберг, Дж. И. (2002). Серотонинергические сенсорно-моторные нейроны опосредуют поведенческую реакцию на гипоксию у эмбрионов прудовика. Дж. Нейробиол. 52, 73–83.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lagerwerf, S., Vrouwe, M.G., Overmeer, R.M., Fousteri, M.I., and Mullenders, L.H. (2011). Реакция на повреждение ДНК и транскрипция. Восстановление ДНК (Amst. ) 10, 743–750.
) 10, 743–750.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Леду С.П., Дружина Н.М., Холленсворт С.Б., Харрисон Дж.Ф. и Уилсон Г.Л. (2007). Восстановление митохондриальной ДНК: важнейший игрок в ответе клеток ЦНС на генотоксические повреждения. Неврология 145, 1249–1259.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Lee, K.S., Iijima-Ando, K., Iijima, K., Lee, W.J., Lee, J.H., Yu, K., et al. (2009 г.). JNK/FOXO-опосредованная нейрональная экспрессия гомолога пероксиредоксина II у мух снижает окислительный стресс и увеличивает продолжительность жизни. Дж. Биол. хим. 284, 29454–29461.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lee, SJ, Hwang, A.B., and Kenyon, C. (2010). Подавление дыхания увеличивает продолжительность жизни C. elegans за счет активных форм кислорода, которые повышают активность HIF-1. Курс. биол. 20, 2131–2136.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Ли, С.Дж., Дзико, К., Ямасита, Э., и Цукихара, Т. (2011). Селективный ядерный механизм экспорта малых РНК. Курс. мнение Структура биол. 21, 101–108.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lee, SJ, and Kenyon, C. (2009). Регуляция реакции долголетия на температуру термосенсорными нейронами у Caenorhabditis elegans. Курс. биол. 19, 715–722.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Ли С.С., Кеннеди С., Толонен А.С. и Рувкун Г. (2003a). DAF-16 нацелен на гены, которые контролируют продолжительность жизни и метаболизм C-elegans. Наука 300, 644–647.
CrossRef Full Text
Lee, Y., Ahn, C., Han, J., Choi, H., Kim, J., Yim, J., et al. (2003б). Ядерная РНКаза III Drosha инициирует процессинг микроРНК. Природа 425, 415–419.
Полный текст CrossRef
Ли, Ю. , Чон, К., Ли, Дж. Т., Ким, С., и Ким, В. Н. (2002). Созревание микроРНК: пошаговый процессинг и субклеточная локализация. EMBO J. 21, 4663–4670.
, Чон, К., Ли, Дж. Т., Ким, С., и Ким, В. Н. (2002). Созревание микроРНК: пошаговый процессинг и субклеточная локализация. EMBO J. 21, 4663–4670.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lee, Y., and McKinnon, PJ (2007). Реагирование на двухцепочечные разрывы ДНК в нервной системе. Неврология 145, 1365–1374.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лейзер, С. Ф., Бегун, А., и Каберляйн, М. (2011). HIF-1 модулирует продолжительность жизни и продолжительность жизни в зависимости от температуры. Ячейка старения 10, 318–326.
Опубликовано Резюме | Опубликован полный текст | CrossRef Full Text
Li, C., Hisamoto, N., Nix, P., Kanao, S., Mizuno, T., Bastiani, M., et al. (2012). Фактор роста SVH-1 регулирует регенерацию аксонов у C. elegans через каскад JNK MAPK. Нац. Неврологи. 15, 551–557.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ли, Д. , Бай, Т., и Брорсон, Дж. Р. (2011). Адаптация к умеренной гипоксии защищает корковые нейроны от ишемически-реперфузионного повреждения и эксайтотоксичности независимо от HIF-1альфа. Экспл. Нейрол. 230, 302–310.
, Бай, Т., и Брорсон, Дж. Р. (2011). Адаптация к умеренной гипоксии защищает корковые нейроны от ишемически-реперфузионного повреждения и эксайтотоксичности независимо от HIF-1альфа. Экспл. Нейрол. 230, 302–310.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Li, J.L., Han, Y.R., Plummer, M.R., and Herrup, K. (2009a). Цитоплазматический АТМ в нейронах модулирует синаптическую функцию. Курс. биол. 19, 2091–2096.
CrossRef Full Text
Li, X., Cassidy, J.J., Reinke, C.A., Fischboeck, S., и Carthew, R.W. (2009b). МикроРНК придает устойчивость к колебаниям окружающей среды во время развития. Ячейка 137, 273–282.
CrossRef Полный текст
Ли, В. К., Кеннеди, С. Г., и Рувкун, Г. (2003). daf-28 кодирует член суперсемейства инсулина C-elegans, который регулируется сигналами окружающей среды и действует на сигнальный путь DAF-2. Гены Дев. 17, 844–858.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Li, Y. , Chopp, M., Powers, C., and Jiang, N. (1997). Иммунореактивность циклина D1/cdk4 в нейронах и олигодендроцитах после фокальной ишемии головного мозга у крыс. Дж. Цереб. Кровоток Метаб. 17, 846–856.
, Chopp, M., Powers, C., and Jiang, N. (1997). Иммунореактивность циклина D1/cdk4 в нейронах и олигодендроцитах после фокальной ишемии головного мозга у крыс. Дж. Цереб. Кровоток Метаб. 17, 846–856.
Опубликован Аннотация | Полный текст в публикации
Li, Y.Q., Guo, Y.P., Jay, V., Stewart, P.A., and Wong, C.S. (1996). Динамика радиационно-индуцированного апоптоза в спинном мозге взрослых крыс. Радиотер. Онкол. 39, 35–42.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Либерт С., Цвинер Дж., Чу X., Ванвурхис В., Роман Г. и Плетчер С. Д. (2007). Регуляция продолжительности жизни дрозофилы с помощью обоняния и пищевых запахов. Наука 315, 1133–1137.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лин, К., Синь, Х., Либина, Н., и Кеньон, К. (2001). Регуляция белка долголетия Caenorhabditis elegans DAF-16 с помощью инсулина/IGF-1 и передачи сигналов зародышевой линии. Нац. Жене. 28, 139–145.
Нац. Жене. 28, 139–145.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Lipton, P. (1999). Ишемическая гибель клеток в нейронах головного мозга. Физиол. Ред. 79, 1431–1568.
Опубликовано Резюме | Полный текст в публикации
Lithgow, GJ, White, T.M., Melov, S., and Johnson, T.E. (1995). Термотолерантность и увеличенная продолжительность жизни, обусловленные мутациями одного гена и вызванные тепловым стрессом. Проц. Натл. акад. науч. США 92, 7540–7544.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лю С., Шульце Э. и Баумайстер Р. (2012). Нейроны, чувствительные к температуре и прикосновению, объединяют активность каналов CNG и TRPV, чтобы контролировать избегание тепла у Caenorhabditis elegans. PLoS ONE 7, e32360. doi:10.1371/journal.pone.0032360
CrossRef Full Text
Liu, W., D’ercole, J.A., and Ye, P. (2011). Притупление экспрессии рецептора инсулиноподобного фактора роста 1 типа усугубляет апоптоз нейронов после гипоксического/ишемического повреждения. BMC Neurosci. 12, 64. doi:10.1186/1471-2202-12-64
BMC Neurosci. 12, 64. doi:10.1186/1471-2202-12-64
CrossRef Полный текст
Liu, X.D., Liu, P.C., Santoro, N., and Thiele, D.J. (1997). Сохранение реакции на стресс: транскрипционные факторы теплового шока человека функционально заменяют дрожжевой HSF. EMBO J. 16, 6466–6477.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лю Ю., Като Х., Наката Н. и Когуре К. (1993). Временной профиль синтеза белка теплового шока 70 при толерантности к ишемии, индуцированной прекондиционирующей ишемией в гиппокампе крыс. Неврология 56, 921–927.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лоунс, М.Т., Раллу, М., Мезгер, В., и Моранж, М. (1997). Экспрессия гена HSP и HSF2 в развитии мышей. Мол. ячейки Жизнь наук. 53, 179–190.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лопес-Эрнандес Б., Посадас И., Подлесный П., Абад М. А., Труллас Р. и Сина В. (2012). HIF-1альфа оказывает нейропротекторное действие на ранних фазах легкой гипоксии в нейронах коры головного мозга крыс. Экспл. Нейрол. 233, 543–554.
А., Труллас Р. и Сина В. (2012). HIF-1альфа оказывает нейропротекторное действие на ранних фазах легкой гипоксии в нейронах коры головного мозга крыс. Экспл. Нейрол. 233, 543–554.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Лу, Т., Пан, Ю., Као, С.Ю., Ли, К., Кохане, И., Чан, Дж., и др. (2004). Регуляция генов и повреждение ДНК в стареющем человеческом мозге. Природа 429, 883–891.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ма, Д.К., Воздек, Р., Бхатла, Н., и Хорвиц, Х.Р. (2012). CYSL-1 взаимодействует с O2-чувствительной гидроксилазой EGL-9, способствуя поведенческой пластичности, вызванной гипоксией, модулируемой h3S, у C. elegans. Нейрон 73, 925–940.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Маймундар, А. Дж., Вонг, В. Дж., и Саймон, М. К. (2010). Гипоксия-индуцируемые факторы и реакция на гипоксический стресс. Мол. Ячейка 40, 294–309.
Ячейка 40, 294–309.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Малтепе, Э., и Саймон, М.С. (1998). Кислород, гены и развитие: анализ роли регуляции гипоксических генов во время развития сосудов мышей. Дж. Мол. Мед. (Берл.) 76, 391–401.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Масса, П.Т., Алейасин, Х., Парк, Д.С., Мао, X., и Баргер, С.В. (2006). NFkappaB в нейронах? Принцип неопределенности в нейробиологии. J. Нейрохим. 97, 607–618.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Масуда, Х., Хосокава, Н., и Нагата, К. (1998). Экспрессия и локализация коллагенсвязывающего стрессового белка Hsp47 в развитии эмбриона мыши: сравнение с коллагеном I и II типов. Шапероны клеточного стресса 3, 256–264.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Mattson, MP, and Cheng, A.W. (2006). Нейрогорметические фитохимические вещества: низкие дозы токсинов, вызывающие адаптивные реакции нейронов на стресс. Тренды Неврологии. 29, 632–639.
Нейрогорметические фитохимические вещества: низкие дозы токсинов, вызывающие адаптивные реакции нейронов на стресс. Тренды Неврологии. 29, 632–639.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
McGahan, L., Hakim, A.M., Nakabeppu, Y., and Robertson, G.S. (1998). Индуцированной ишемией гибели нейронов CA1 предшествует повышенная экспрессия FosB и Jun и сниженные уровни NGFI-A и JunB. Мол. Мозг Res. 56, 146–161.
CrossRef Полный текст
Мехта, Р., Штайнкраус, К.А., Сутфин, Г.Л., Рамос, Ф.Дж., Шамиех, Л.С., Хух, А., и др. (2009). Протеасомная регуляция гипоксической реакции модулирует старение у C. elegans. Наука 324, 1196–1198.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Мельцер, Л. А., Ябалури, Р., и Дейссерот, К. (2005). Роль контурного гомеостаза во взрослом нейрогенезе. Trends Neurosci. 28, 653–660.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Миллер, Б. А., Перес, Р. С., Шах, А. Р., Гонсалес, Э. Р., Парк, Т. С., и Гиддей, Дж. М. (2001). Церебральная защита путем гипоксического прекондиционирования в мышиной модели фокальной ишемии-реперфузии. Нейроотчет 12, 1663–1669.
А., Перес, Р. С., Шах, А. Р., Гонсалес, Э. Р., Парк, Т. С., и Гиддей, Дж. М. (2001). Церебральная защита путем гипоксического прекондиционирования в мышиной модели фокальной ишемии-реперфузии. Нейроотчет 12, 1663–1669.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Miska, E.A., Alvarez-Saavedra, E., Abbott, A.L., Lau, N.C., Hellman, A.B., McGonagle, S.M., et al. (2007). Большинство микроРНК Caenorhabditis elegans по отдельности не являются существенными для развития или жизнеспособности. Генетика PLoS. 3, е215. doi:10.1371/journal.pgen.0030215
CrossRef Полный текст
Моримото Р.И., Клайн М.П., Бимстон Д.Н. и Котто Дж.Дж. (1997). Реакция на тепловой шок: регуляция и функция белков теплового шока и молекулярных шаперонов. Очерки биохимии. 32, 17–29.
Опубликован Аннотация | Полный текст в публикации
Морли, Дж. Ф., и Моримото, Р. И. (2004). Регуляция продолжительности жизни Caenorhabditis elegans с помощью фактора теплового шока и молекулярных шаперонов. Мол. биол. Ячейка 15, 657–664.
Мол. биол. Ячейка 15, 657–664.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Моррисон, С.Дж., Чете, М., Гровс, А.К., Мелега, В., Уолд, Б., и Андерсон, Д.Дж. (2000). Культивирование при пониженном уровне кислорода способствует клоногенной симпатоадреналовой дифференцировке с помощью изолированных стволовых клеток нервного гребня. Дж. Неврологи. 20, 7370–7376.
Опубликован Аннотация | Опубликован полный текст
Моррисс, Г.М., и Нью, Д.А. (1979). Влияние концентрации кислорода на морфогенез краниальных нервных складок и нервного гребня у культивируемых эмбрионов крыс. Дж. Эмбриол. Эксп. Морфол. 54, 17–35.
Опубликован Аннотация | Полный текст в публикации
Морроу, Г., Самсон, М., Мишо, С., и Тангуай, Р. М. (2004). Сверхэкспрессия небольшого митохондриального Hsp22 увеличивает продолжительность жизни дрозофилы и повышает устойчивость к окислительному стрессу. FASEB J. 18, 598–599.
Опубликован Аннотация | Полный текст в публикации
Мураками, С. (2007). Caenorhabditis elegans как модельная система для изучения старения обучения и памяти. Мол. Нейробиол. 35, 85–94.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Murphy, C.T., McCarroll, S.A., Bargmann, C.I., Fraser, A., Kamath, R.S., Ahringer, J., et al. (2003). Гены, которые действуют после DAF-16, влияют на продолжительность жизни Caenorhabditis elegans. Природа 424, 277–284.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Namgung, U., and Xia, Z.G. (2000). Индуцированный арсенитом апоптоз в нейронах коры опосредуется N-концевой протеинкиназой 3 c-Jun и митоген-активируемой протеинкиназой p38. J. Neurosci. 20, 6442–6451.
Опубликован Аннотация | Полный текст в публикации
Нойманн-Хефелин, Э., Ци, В., Финкбайнер, Э., Вальц, Г., Баумайстер, Р., и Хертвек, М. (2008). SHC-1/p52Shc воздействует на сигнальные пути инсулина/IGF-1 и JNK, чтобы модулировать продолжительность жизни и реакцию на стресс у C. elegans. Гены Дев. 22, 2721–2735.
elegans. Гены Дев. 22, 2721–2735.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ода С., Томиока М. и Иино Ю. (2011). Пластичность нейронов, регулируемая инсулиноподобным сигнальным путем, лежит в основе обучения солевому хемотаксису у Caenorhabditis elegans. J. Нейрофизиол. 106, 301–308.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
О’Дрисколл, К.М., и Горман, А.М. (2005). Гипоксия индуцирует рост нейритов в клетках PC12, который опосредуется через рецепторы аденозина A2A. Неврология 131, 321–329.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
О’Дрисколл, М., и Джегго, П.А. (2006). Роль репарации двухцепочечных разрывов — выводы из генетики человека. Нац. Преподобный Жене. 7, 45–54.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
О, С. В., Мухопадхьяй, А., Сврзикапа, Н., Цзян, Ф. , Дэвис, Р. Дж., и Тиссенбаум, Х. А. (2005). JNK регулирует продолжительность жизни Caenorhabditis elegans, модулируя ядерную транслокацию фактора транскрипции forkhead/DAF-16. Проц. Натл. акад. науч. США 102, 4494–4499.
, Дэвис, Р. Дж., и Тиссенбаум, Х. А. (2005). JNK регулирует продолжительность жизни Caenorhabditis elegans, модулируя ядерную транслокацию фактора транскрипции forkhead/DAF-16. Проц. Натл. акад. науч. США 102, 4494–4499.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Page, T.L., Einstein, M., Duan, H., He, Y., Flores, T., Rolshud, D., et al. (2002). Морфологические изменения в нейронах, образующих корково-кортикальные проекции в неокортексе старых обезьян Patas. Неврологи. лат. 317, 37–41.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Pan, C.L., Peng, C.Y., Chen, C.H., and McIntire, S. (2011). Генетический анализ возрастных дефектов сенсорных рецепторных нейронов Caenorhabditis elegans. Проц. Натл. акад. науч. США 108, 9274–9279.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Park, CY, Choi, YS, and McManus, MT (2010). Анализ нокаутов микроРНК у мышей. Гул. Мол. Жене. 19, Р169–Р175.
Гул. Мол. Жене. 19, Р169–Р175.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Парк Д.С., Левин Б., Феррари Г. и Грин Л.А. (1997). Ингибиторы циклинзависимой киназы и доминантно-отрицательная циклинзависимая киназа 4 и 6 способствуют выживанию симпатических нейронов, лишенных NGF. Дж. Неврологи. 17, 8975–8983.
Опубликован Аннотация | Полный текст Pubmed
Парк, Д.С., Моррис, Э.Дж., Падманабхан, Дж., Шелански, М.Л., Геллер, Х.М., и Грин, Л.А. (1998). Циклинзависимые киназы участвуют в гибели нейронов, вызванной агентами, повреждающими ДНК. J. Cell Biol. 143, 457–467.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Park, E.C., Ghose, P., Shao, Z.Y., Ye, Q., Kang, L.J., Xu, X.Z.S., et al. (2012). Гипоксия регулирует транспортировку глутаматных рецепторов посредством HIF-независимого механизма. EMBO J. 31, 1379–1393.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Park, J. , and Liu, A.Y. (2001). JNK фосфорилирует домен активации транскрипции HSF1: роль JNK в регуляции ответа на тепловой шок. Дж. Сотовый. Биохим. 82, 326–338.
, and Liu, A.Y. (2001). JNK фосфорилирует домен активации транскрипции HSF1: роль JNK в регуляции ответа на тепловой шок. Дж. Сотовый. Биохим. 82, 326–338.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Паркес, Т.Л., Хилликер, А.Дж., и Филлипс, Дж.П. (1999). Моторнейроны, реактивный кислород и продолжительность жизни дрозофилы. Нейробиол. Старение 20, 531–535.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Паскуаль-Леоне, А., Фрейтас, К., Оберман, Л., Хорват, Дж. К., Халко, М., Эльдаиф, М., и др. (2011). Характеристика пластичности коры головного мозга и сетевой динамики в зависимости от возраста в норме и при заболеваниях с помощью ТМС-ЭЭГ и ТМС-фМРТ. Топогр головного мозга. 24, 302–315.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Паскинелли, А. Э. (2012). Некодирующие РНК-микроРНК и их мишени: распознавание, регуляция и возникающие реципрокные отношения. Нац. Преподобный Жене. 13, 271–282.
Нац. Преподобный Жене. 13, 271–282.
Опубликован Аннотация | Pubmed Full Text
Penney, J., Tsurudome, K., Liao, E.H., Elazzouzi, F., Livingstone, M., Gonzalez, M., et al. (2012). TOR необходим для ретроградной регуляции синаптического гомеостаза в нервно-мышечном соединении дрозофилы. Нейрон 74, 166–178.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Пирс, С. Б., Коста, М., Визоцки, Р., Девадхар, С., Хомбургер, С. А., Бухман, А. Р., и др. (2001). Регуляция передачи сигналов рецептора DAF-2 человеческим инсулином и ins-1, членом необычно большого и разнообразного семейства генов инсулина C. elegans. Гены Дев. 15, 672–686.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Pietrzykowski, A.Z., Friesen, R.M., Martin, G.E., Puig, S.I., Nowak, C.L., Wynne, P.M., et al. (2008). Посттранскрипционная регуляция стабильности варианта сплайсинга BK-канала с помощью miR-9 лежит в основе нейроадаптации к алкоголю. Нейрон 59, 274–287.
Нейрон 59, 274–287.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Покок, Р., и Хоберт, О. (2008). Уровни кислорода влияют на направление аксонов и миграцию нейронов у Caenorhabditis elegans. Нац. Неврологи. 11, 894–900.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Покок, Р., и Хоберт, О. (2010). Гипоксия активирует латентный контур обработки вкусовой информации у C. elegans. Нац. Неврологи. 13, 610–614.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Potter, W.B., O’riordan, K.J., Barnett, D., Osting, S.M., Wagoner, M., Burger, C., et al. (2010). Метаболическая регуляция пластичности нейронов с помощью датчика энергии AMPK. PLoS ONE 5, e8996. doi:10.1371/journal.pone.0008996
CrossRef Full Text
Prabhakar, N.R., Pieramici, S.F., Premkumar, D.R.D., Kumar, G.K., and Kalaria, R.N. (1996). Активация экспрессии гена синтазы оксида азота при гипоксии в центральных и периферических нейронах. Мол. Мозг Res. 43, 341–346.
Мол. Мозг Res. 43, 341–346.
CrossRef Полный текст
Прахлад, В., Корнелиус, Т., и Моримото, Р. И. (2008). Регуляция клеточного ответа на тепловой шок у Caenorhabditis elegans термосенсорными нейронами. Наука 320, 811–814.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Прахлад, В., и Моримото, Р.И. (2011). Нейрональная схема регулирует реакцию Caenorhabditis elegans на неправильно свернутые белки. Проц. Натл. акад. науч. США 108, 14204–14209.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Qiu, J., Grafe, M.R., Schmura, S.M., Glasgow, J.N., Kent, T.A., Rassin, D.K., et al. (2001). Дифференциальная регуляция NF-каппа B экспрессии гена bcl-x в гиппокампе и базальных отделах переднего мозга в ответ на гипоксию. Дж. Неврологи. Рез. 64, 223–234.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Рамирес, Дж. М., Эльсен, Ф. П., и Робертсон, Р. М. (1999). Долгосрочные эффекты предшествующего теплового шока на токи калия в нейронах, зарегистрированные в новом препарате срезов ганглиев насекомых. J. Нейрофизиол. 81, 795–802.
П., и Робертсон, Р. М. (1999). Долгосрочные эффекты предшествующего теплового шока на токи калия в нейронах, зарегистрированные в новом препарате срезов ганглиев насекомых. J. Нейрофизиол. 81, 795–802.
Опубликован Аннотация | Полный текст в публикации
Рамоцкий, М.Б., и Зогби, Х.Ю. (2008). Нарушение нейронального гомеостаза приводит к распространенным нейропсихиатрическим фенотипам. Природа 455, 912–918.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ричард, М.Б., Тейлор, С.Р., и Грир, К.А. (2010). Индуцированное возрастом нарушение селективных синаптических цепей обонятельных луковиц. Проц. Натл. акад. науч. США 107, 15613–15618.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Робертсон, А.Б., Клунгланд, А., Рогнес, Т., и Лейрос, И. (2009). Репарация ДНК в клетках млекопитающих: эксцизионная репарация основания: длинное и короткое. Сотовый. Мол. Жизнь наук. 66, 981–993.
66, 981–993.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Робертсон, Р. М. (2004). Модуляция работы нейронной цепи предшествующим стрессом окружающей среды. Интегр. Комп. биол. 44, 21–27.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ромеро А.А., Гросс С.Р., Ченг К.Ю., Голдсмит Н.К. и Геллер Х.М. (2003). Возрастное повышение устойчивости к апоптотической гибели клеток, вызванной повреждением ДНК, связано с развитием механизмов репарации ДНК. J. Нейрохим. 84, 1275–1287.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Рордорф, Г., Корошец, В. Дж., и Бонвентре, Дж. В. (1991). Тепловой шок защищает культивируемые нейроны от глутаматной токсичности. Нейрон 7, 1043–1051.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Росас-Баллина, М., и Трейси, К. Дж. (2009). Неврология иммунной системы: нервные рефлексы регулируют иммунитет. Нейрон 64, 28–32.
Нейрон 64, 28–32.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Саха, Р. Н., Гош, А., Паленсия, К. А., Фунг, Ю. К., Дудек, С. М., и Пахан, К. (2009). Прекондиционирование TNF-альфа защищает нейроны за счет нейрон-специфической повышающей регуляции CREB-связывающего белка. Дж. Иммунол. 183, 2068–2078.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Сайто К., Кондо Э. и Мацусита М. (2011). Семейство микроРНК 130 регулирует ответный сигнал гипоксии через белок Р-тела DDX6. Рез. нуклеиновых кислот. 39, 6086–6099.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Сакашита Т., Таканами Т., Янасэ С., Хамада Н., Судзуки М., Кимура Т. и др. (2010). Радиационная биология Caenorhabditis elegans: реакция зародышевых клеток, старение и поведение. Дж. Радиат. Рез. 51, 107–121.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Sammeta, N. , and McClintock, TS (2010). Химический стресс индуцирует развернутый белковый ответ в обонятельных сенсорных нейронах. Дж. Комп. Нейрол. 518, 1825–1836 гг.
, and McClintock, TS (2010). Химический стресс индуцирует развернутый белковый ответ в обонятельных сенсорных нейронах. Дж. Комп. Нейрол. 518, 1825–1836 гг.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шулингкамп, Р. Дж., Пагано, Т. С., Хунг, Д., и Раффа, Р. Б. (2000). Рецепторы инсулина и действие инсулина в головном мозге: обзор и клинические последствия. Неврологи. Биоповедение. Ред. 24, 855–872.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шульц, Т.Дж., Зарс, К., Фойгт, А., Урбан, Н., Биррингер, М., и Ристоу, М. (2007). Ограничение потребления глюкозы продлевает продолжительность жизни Caenorhabditis elegans, индуцируя митохондриальное дыхание и усиливая окислительный стресс. Метаболизм клеток 6, 280–293.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Скотт, Б.А., Авидан, М.С., и Краудер, К.М. (2002). Регуляция гипоксической смерти у C. elegans гомологом рецептора инсулина/ИФР DAF-2. Наука 296, 2388–2391.
elegans гомологом рецептора инсулина/ИФР DAF-2. Наука 296, 2388–2391.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Сиберг Э., Эйде Л. и Бьорас М. (1995). Базовый путь эксцизионной репарации. Тенденции биохим. науч. 20, 391–397.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Сендоэль, А., Колер, И., Феллманн, К., Лоу, С.В., и Хенгартнер, М.О. (2010). HIF-1 противодействует р53-опосредованному апоптозу посредством секретируемой нейрональной тирозиназы. Природа 465, 577–583.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Шамовский И. и Нудлер Э. (2008). Новое понимание механизма активации реакции теплового шока. Сотовый. Мол. Жизнь наук. 65, 855–861.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Shao, G., Zhou, WH, Gao, C.Y., Zhang, R., and Lu, GW (2007). Влияние гипоксии, предваряющей отсутствие связывающей активности HIF-1, на HRE с ЭПО в гиппокампе мышей. Чжунго Ин Юн Шэн Ли Сюэ За Чжи 23, 1–4.
Чжунго Ин Юн Шэн Ли Сюэ За Чжи 23, 1–4.
Опубликован Аннотация | Pubmed Full Text
Shen, L., Hu, Y., Cai, T., Lin, X., and Wang, D. (2010a). Регуляция долголетия генами, необходимыми для функций интернейрона AIY у нематоды Caenorhabditis elegans. Мех. Старение Дев. 131, 732–738.
CrossRef Full Text
Shen, L.L., Du, M., Lin, X.F., Cai, T., and Wang, D.Y. (2010b). Гены, необходимые для функций обонятельных нейронов AWA, регулируют продолжительность жизни Caenorhabditis elegans в зависимости от передачи сигналов инсулином/IGF. Неврологи. Бык. 26, 91–103.
Полный текст CrossRef
Шеррин Т., Бланк Т. и Тодорович К. (2011). N-концевые киназы c-Jun в памяти и синаптической пластичности. Преподобный Neurosci. 22, 403–410.
Опубликован Аннотация | Pubmed Full Text
Ши А.Ю., Имбо С., Баракаускас В., Эрб Х., Цзян Л., Ли П. и др. (2005). Индукция Nrf2-управляемого антиоксидантного ответа обеспечивает нейропротекцию во время митохондриального стресса in vivo. Дж. Биол. хим. 280, 22925–22936.
Дж. Биол. хим. 280, 22925–22936.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Шираи К., Мизуи Т., Судзуки Ю., Кобаяши Ю., Накано Т. и Ширао Т. (2006). Дифференциальные эффекты рентгеновского облучения на незрелые и зрелые нейроны гиппокампа in vitro. Неврологи. лат. 399, 57–60.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Саймон, М. К., и Кит, Б. (2008). Роль доступности кислорода в эмбриональном развитии и функции стволовых клеток. Нац. Преподобный Мол. Клеточная биол. 9, 285–296.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Саймон М.С., Рамирез-Бержерон Д., Мак Ф., Ху С.Дж., Пан Ю. и Мэнсфилд К. (2002). Гипоксия, HIFs и развитие сердечно-сосудистой системы. Гавань Колд Спринг. Симп. Квант. биол. 67, 127–132.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Снайдер, Б.Дж., Лобнер, Д. , Ямада, К.А., и Чой, Д.В. (1998). Кондиционирующий тепловой стресс снижает эксайтотоксические и апоптотические компоненты гибели нейронов, вызванной кислородно-глюкозной депривацией in vitro. Дж. Нейрохим. 70, 120–129.
, Ямада, К.А., и Чой, Д.В. (1998). Кондиционирующий тепловой стресс снижает эксайтотоксические и апоптотические компоненты гибели нейронов, вызванной кислородно-глюкозной депривацией in vitro. Дж. Нейрохим. 70, 120–129.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Stevenson, T.J., Trinh, T., Kogelschatz, C., Fujimoto, E., Lush, M.E., Piotrowski, T., et al. (2012). Нарушение гипоксии поиска путей в ЦНС позвоночных через EphrinB2 устраняется магнием. Генетика PLoS. 8, е1002638. doi:10.1371/journal.pgen.1002638
CrossRef Полный текст
Steves, C.J., Spector, T.D., and Jackson, S.H. (2012). Старение, гены, окружающая среда и эпигенетика: что говорят нам исследования близнецов сейчас и в будущем. Возраст Старение 41, 581–586.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Странахан, А. М., и Маттсон, М. П. (2012). Рекрутинг адаптивных клеточных реакций на стресс для успешного старения мозга. Нац. Преподобный Нейроски. 13, 209–216.
Нац. Преподобный Нейроски. 13, 209–216.
Опубликован Аннотация | Pubmed Full Text
Studer, L., Csete, M., Lee, S.H., Kabbani, N., Walikonis, J., Wold, B., et al. (2000). Повышенная пролиферация, выживаемость и дофаминергическая дифференцировка предшественников ЦНС при пониженном уровне кислорода. J. Neurosci. 20, 7377–7383.
Опубликован Аннотация | Полный текст публикации
Такахама, К., Томита, Дж., Уэно, Т., Ямадзаки, М., Куме, С., и Куме, К. (2012). Паннейронный нокдаун N-концевой киназы c-Jun (JNK) приводит к сокращению сна и продолжительности жизни у дрозофилы. Биохим. Биофиз. Рез. коммун. 417, 807–811.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Такеда, К., и Ичидзё, Х. (2002). Нейрональная передача сигналов p38 MAPK: новый регулятор судьбы и функции клеток в нервной системе. Гены Клетки 7, 1099–1111.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Tank, E. M., Rodgers, K.E., and Kenyon, C. (2011). Спонтанное возрастное ветвление нейритов у Caenorhabditis elegans. Дж. Неврологи. 31, 9279–9288.
M., Rodgers, K.E., and Kenyon, C. (2011). Спонтанное возрастное ветвление нейритов у Caenorhabditis elegans. Дж. Неврологи. 31, 9279–9288.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Татар, М., Копельман, А., Эпштейн, Д., Ту, М.П., Инь, К.М., и Гарофало, Р.С. (2001). Мутантный гомолог инсулинового рецептора дрозофилы, увеличивающий продолжительность жизни и нарушающий нейроэндокринную функцию. Наука 292, 107–110.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Teixeira-Castro, A., Ailion, M., Jalles, A., Brignull, H.R., Vilaca, J.L., Dias, N., et al. (2011). Нейрон-специфическая протеотоксичность мутантного атаксина-3 у C. elegans: спасение путями DAF-16 и HSF-1. Гул. Мол. Жене. 20, 2996–3009.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Тиан, Б., Ян, К., и Мао, З. (2009). Фосфорилирование ATM с помощью Cdk5 опосредует передачу сигналов о повреждении ДНК и регулирует гибель нейронов. Нац. Клеточная биол. 11, 211–218.
Нац. Клеточная биол. 11, 211–218.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Timsit, S., Rivera, S., Ouaghi, P., Guischard, F., Tremblay, E., Ben-Ari, Y., et al. (1999). Повышение циклина D1 в уязвимых нейронах гиппокампа после ишемии и эпилепсии: модулятор запрограммированной гибели клеток in vivo? Евро. Дж. Нейроски. 11, 263–278.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Томиока М., Адачи Т., Судзуки Х., Кунитомо Х., Шафер В. Р. и Иино Ю. (2006). Путь инсулина/PI 3-киназы регулирует обучение солевому хемотаксису у Caenorhabditis elegans. Нейрон 51, 613–625.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Тоноки, А., и Дэвис, Р.Л. (2012). Старение ухудшает среднесрочную поведенческую память, нарушая след памяти дорсальных парных медиальных нейронов. Проц. Натл. акад. науч. США 109, 6319–6324.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Турриджано, Г. Г., и Нельсон, С.Б. (2004). Гомеостатическая пластичность в развивающейся нервной системе. Нац. Преподобный Нейроски. 5, 97–107.
Г., и Нельсон, С.Б. (2004). Гомеостатическая пластичность в развивающейся нервной системе. Нац. Преподобный Нейроски. 5, 97–107.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Унгер, Дж., Макнейл, Т. Х., Моксли, Р. Т. III, Уайт, М., Мосс, А., и Ливингстон, Дж. Н. (1989). Распределение инсулиноподобной иммунореактивности в переднем мозге крыс. Неврология 31, 143–157.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ван Эссен, округ Колумбия (1997). Основанная на напряжении теория морфогенеза и компактной проводки в центральной нервной системе. Природа 385, 313–318.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
van Heemst, D. (2010). Инсулин, ИФР-1 и долголетие. Старение Dis. 1, 147–157.
Опубликован Аннотация | Полный текст в публикации
van Heemst, D., Beekman, M., Mooijaart, S.P., Heijmans, B.T., Brandt, B. W., Zwaan, B.J., et al. (2005). Снижение передачи сигналов инсулина/ИФР-1 и увеличение продолжительности жизни человека. Ячейка старения 4, 79–85.
W., Zwaan, B.J., et al. (2005). Снижение передачи сигналов инсулина/ИФР-1 и увеличение продолжительности жизни человека. Ячейка старения 4, 79–85.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ван Рамсдонк, Дж. М., и Хекими, С. (2010). Активные формы кислорода и старение Caenorhabditis elegans: причинно-следственная или случайная связь? Антиоксидант. Окислительно-восстановительный сигнал. 13, 1911–1953 гг.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ван Рамсдонк, Дж. М., и Хекими, С. (2012). Супероксиддисмутаза необходима для нормальной продолжительности жизни животных. Проц. Натл. акад. науч. США 109, 5785–5790.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Уолтон, Н. М., Шин, Р., Таджинда, К., Хойснер, К. Л., Коган, Дж. Х., Мияке, С., и др. (2012). Взрослый нейрогенез временно вызывает окислительный стресс. PLoS ONE 7, e35264. doi:10.1371/journal.pone.0035264
doi:10.1371/journal.pone.0035264
CrossRef Full Text
Wang, M.C., Bohmann, D., and Jasper, H. (2005). JNK продлевает продолжительность жизни и ограничивает рост, противодействуя клеточным и общим реакциям организма на передачу сигналов инсулина. Сотовый 121, 115–125.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Вестон, С. Р., и Дэвис, Р. Дж. (2002). Путь передачи сигнала JNK. Курс. мнение Жене. Дев. 12, 14–21.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Уайт, Дж. Г., Саутгейт, Э., Томсон, Дж. Н., и Бреннер, С. (1986). Строение нервной системы нематоды Caenorhabditis elegans. Филос. Транс. Р. Соц. Лонд. Б биол. науч. 314, 1–340.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Уильямс Т., Курше Дж., Вайоллет Б., Бренман Дж. Э. и Полле Ф. (2011). Активность AMP-активируемой протеинкиназы (AMPK) не требуется для развития нейронов, но регулирует аксогенез во время метаболического стресса. Проц. Натл. акад. науч. США 108, 5849–5854.
Проц. Натл. акад. науч. США 108, 5849–5854.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Волков, К.А., Кимура, К.Д., Ли, М.С., и Рувкун, Г. (2000). Регуляция продолжительности жизни C. elegans с помощью инсулиноподобной передачи сигналов в нервной системе. Наука 290, 147–150.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Вудрафф-Пак Д. С., Фой М. Р., Акопян Г. Г., Ли К. Х., Зак Дж., Нгуен К. П. и др. (2010). Дифференциальные эффекты и темпы нормального старения мозжечка и гиппокампа. Проц. Натл. акад. науч. США 107, 1624–1629.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ву, Б.С., Ли, Дж.К., Томпсон, К.М., Уокер, В.К., Мойес, К.Д., и Робертсон, Р.М. (2002). Аноксия вызывает термотолерантность в системе полета саранчи. Дж. Эксп. биол. 205, 815–827.
Опубликован Аннотация | Полный текст в публикации
Ву, Б. С., Уокер, В.К., и Робертсон, Р.М. (2001). Индуцированная тепловым шоком термозащита потенциалов действия в системе полета саранчи. Дж. Нейробиол. 49, 188–199.
С., Уокер, В.К., и Робертсон, Р.М. (2001). Индуцированная тепловым шоком термозащита потенциалов действия в системе полета саранчи. Дж. Нейробиол. 49, 188–199.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Вуллшлегер С., Лоевит Р. и Холл М. Н. (2006). Передача сигналов TOR в росте и метаболизме. Сотовый 124, 471–484.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Yan, D., Wu, Z., Chisholm, A.D., and Jin, Y. (2009). Киназа DLK-1 способствует стабильности мРНК и локальной трансляции в синапсах C. elegans и регенерации аксонов. Сотовый 138, 1005–1018.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Янкнер, Б. А., Лу, Т., и Лёрх, П. (2008). Стареющий мозг. год. Преподобный Патол. 3, 41–66.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Яо С., Пэн М., Чжу С., Ченг М. и Ци С. (2007). Белок теплового шока72 защищает нейроны гиппокампа от апоптоза, вызванного хроническим психологическим стрессом. Междунар. Дж. Нейроски. 117, 1551–1564.
(2007). Белок теплового шока72 защищает нейроны гиппокампа от апоптоза, вызванного хроническим психологическим стрессом. Междунар. Дж. Нейроски. 117, 1551–1564.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ye, WZ, and Blain, SW (2010). Вступление в S-фазу вызывает смерть, вызванную гомоцистеином, в то время как атаксия, телеангиэктазия и белок, родственный Rad3, действуют антиапоптотически для защиты нейронов. Мозг 133, 2295–2312.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Йен, К., Патель, Х. Б., Люблин, А. Л., и Моббс, К. В. (2009). Изоформы SOD не играют никакой роли в продолжительности жизни при импровизации или диетических ограничениях, но мутационная инактивация SOD-1 снижает продолжительность жизни при простуде. Мех. Старение Дев. 130, 173–178.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Yi, R., Qin, Y., Macara, I.G., and Cullen, B. R. (2003). Экспортин-5 опосредует ядерный экспорт пре-микроРНК и коротких шпилечных РНК. Гены Дев. 17, 3011–3016.
R. (2003). Экспортин-5 опосредует ядерный экспорт пре-микроРНК и коротких шпилечных РНК. Гены Дев. 17, 3011–3016.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Чжан, Х., Ландманн, Ф., Захреддин, Х., Родригес, Д., Кох, М., и Лабуэс, М. (2011a). Индуцированный натяжением путь механотрансдукции способствует эпителиальному морфогенезу. Природа 471, 99–103.
CrossRef Полный текст
Чжан, X., Забински, Р., Тэн, Ю., Цуй, М., и Хань, М. (2011b). микроРНК играют решающую роль в выживании и восстановлении Caenorhabditis elegans после индуцированной голоданием диапаузы L1. Проц. Натл. акад. науч. США 108, 17997–18002.
CrossRef Full Text
Чжан П., Абрахам В. С., Крафт К. Р., Рабчевский А. Г., Шефф С. В. и Суэйн Дж. А. (2000). Гипертермическое прекондиционирование защищает от ишемического повреждения спинного мозга. Энн. Торак. Surg. 70, 1490–1495.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжан Ю. , Шао З., Чжай З., Шен К. и Пауэлл-Коффман Дж. А. (2009). Фактор, индуцируемый гипоксией HIF-1, модулирует продолжительность жизни C. elegans. PLoS ONE 4, e6348. doi:10.1371/journal.pone.0006348
, Шао З., Чжай З., Шен К. и Пауэлл-Коффман Дж. А. (2009). Фактор, индуцируемый гипоксией HIF-1, модулирует продолжительность жизни C. elegans. PLoS ONE 4, e6348. doi:10.1371/journal.pone.0006348
CrossRef Full Text
Zheng, S., and Zuo, Z. (2004). Прекондиционирование изофлураном индуцирует нейропротекцию против ишемии посредством активации митоген-активируемых протеинкиназ Р38. Мол. Фармакол. 65, 1172–1180.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжоу, Л., и Чжу, Д.Ю. (2009). Нейрональная синтаза оксида азота: структура, субклеточная локализация, регуляция и клиническое значение. Оксид азота 20, 223–230.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжоу, С.Ю., Кастро-Мур, Ф., и Гошгарян, Х.Г. (2001). Активация латентного респираторно-двигательного пути путем стимуляции нейронов в области медуллярных хеморецепторов крысы. Экспл. Нейрол. 171, 176–184.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Чжу, Дж., Ли, В., и Мао, З. (2011). Cdk5: медиатор развития нейронов, гибели и реакции на повреждение ДНК. Мех. Старение Дев. 132, 389–394.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Зиу М., Флетчер Л., Рана С., Хименес Д. Ф. и Дигикайлиоглу М. (2011). Временные различия в паттернах экспрессии микроРНК в астроцитах и нейронах после ишемического повреждения. PLoS ONE 6, e14724. doi:10.1371/journal.pone.0014724
CrossRef Полный текст
Физиология, реакция на стресс — StatPearls
Введение
Любые физические или психологические раздражители, нарушающие гомеостаз, вызывают реакцию на стресс. Стимулы называются стрессорами, а физиологические и поведенческие изменения в ответ на воздействие стрессоров составляют реакцию на стресс. Реакция на стресс опосредована сложным взаимодействием нервных, эндокринных и иммунных механизмов, которые включают активацию симпатико-адрено-медуллярной (SAM) оси, оси гипоталамус-гипофиз-надпочечники (HPA) и иммунной системы. [1] Реакция на стресс является адаптивной, прежде всего, она подготавливает организм к решению проблем, связанных с внутренней или внешней средой (стрессором), например, физиологические реакции организма на травму и инвазивное хирургическое вмешательство служат для смягчения дальнейшего повреждения тканей. Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
[1] Реакция на стресс является адаптивной, прежде всего, она подготавливает организм к решению проблем, связанных с внутренней или внешней средой (стрессором), например, физиологические реакции организма на травму и инвазивное хирургическое вмешательство служат для смягчения дальнейшего повреждения тканей. Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Клеточный
Физиология реакции на стресс состоит из двух компонентов; медленный ответ, опосредованный осью HPA, и быстрый ответ, опосредованный осью SAM. Быстрый ответ вследствие активации SAM приводит к увеличению секреции норадреналина (НЭ) и адреналина (Э) мозговым веществом надпочечников в кровоток и увеличению секреции НЭ из симпатических нервов и, таким образом, к повышению уровня НЭ в головном мозге. Высвобожденные Е и НЭ взаимодействуют с α-адренорецепторами и β-адренорецепторами, присутствующими в центральной нервной системе и на клеточных мембранах гладких мышц и других органов по всему телу. Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Высвобожденные Е и НЭ взаимодействуют с α-адренорецепторами и β-адренорецепторами, присутствующими в центральной нервной системе и на клеточных мембранах гладких мышц и других органов по всему телу. Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Медленный ответ обусловлен активацией оси HPA, что приводит к высвобождению кортикотропин-рилизинг-гормона (CRH) из паравентрикулярного ядра гипоталамуса в кровоток. CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Затем высвобожденный CRH стимулирует переднюю долю гипофиза к высвобождению адренокортикотропного гормона (АКТГ) в кровоток. АКТГ стимулирует кору надпочечников к секреции глюкокортикоидных гормонов, таких как кортизол, в кровоток. Неактивная форма кортизола, кортизон, катализируется 11 бета-гидроксистероиддегидрогеназами до его активной формы, кортизола.
Ось HPA регулируется полипептидом, активирующим аденилатциклазу гипофиза (PACAP). PACAP может играть роль в производстве CRH и играть модулирующую роль на нескольких уровнях оси HPA. Имеющиеся данные также указывают на участие PACAP в вегетативной реакции на стресс посредством увеличения секреции катехоламинов.[5] Рецепторы PACAP связаны с G-белком, и PACAP-R1 наиболее распространен как в центральных, так и в периферических тканях. PACAP также может модулировать роль эстрогена в потенцировании острой реакции на стресс.[6]
PACAP также может модулировать роль эстрогена в потенцировании острой реакции на стресс.[6]
После высвобождения CRH он связывается с белком, связывающим кортизол-рилизинг-гормон (CRH-BP), поскольку CRH имеет более высокое сродство к CRH-BP, чем к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1.[2] Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Вовлеченные системы органов
Стресс обычно влияет на все системы организма, включая сердечно-сосудистую, дыхательную, эндокринную, желудочно-кишечную, нервную, мышечную и репродуктивную системы. Что касается сердечно-сосудистой системы, то острый стресс вызывает учащение пульса, более сильные сокращения сердечной мышцы, дилатацию сердца и перенаправление крови к крупным мышцам. Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм.
Что касается сердечно-сосудистой системы, то острый стресс вызывает учащение пульса, более сильные сокращения сердечной мышцы, дилатацию сердца и перенаправление крови к крупным мышцам. Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Функция
Повышенная вегетативная реакция вызывает увеличение частоты сердечных сокращений и артериального давления. Во время критического состояния высвобождение катехоламинов снижает кровообращение в желудочно-кишечном тракте. Уровни норадреналина и адреналина в плазме во время стресса перераспределяют объем крови, чтобы сохранить кровоснабжение мозга. Стимуляция симпатической нервной системы разнообразна, но включает такие угрозы для организма, как гипогликемия, геморрагический шок, физические нагрузки, превышающие анаэробный порог, и удушье.[7] Эпинефрин также связан с активным побегом, атакой и неподвижным страхом.
Стрессовая ситуация, экологическая или психологическая, может активировать каскад гормонов стресса, вызывающих физиологические изменения. Активация симпатической нервной системы таким образом вызывает острую реакцию на стресс, называемую реакцией «бей или беги». Это позволяет человеку либо бороться с угрозой, либо бежать от ситуации. Выброс адреналина и норадреналина, секретируемых мозговым веществом надпочечников, вызывает одновременную разрядку почти всех отделов симпатической системы в виде широко распространенного эффекта массовой разрядки по всему телу. Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Это позволяет человеку либо бороться с угрозой, либо бежать от ситуации. Выброс адреналина и норадреналина, секретируемых мозговым веществом надпочечников, вызывает одновременную разрядку почти всех отделов симпатической системы в виде широко распространенного эффекта массовой разрядки по всему телу. Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Механизм
Физический стресс стимулирует гипоталамо-гипофизарно-надпочечниковую и симпатическую нервную систему. Кортизол оказывает различные физиологические эффекты, включая высвобождение катехоламинов, подавление инсулина, мобилизацию запасов энергии посредством глюконеогенеза и гликогенолиза, подавление иммунно-воспалительного ответа и замедленное заживление ран.[8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
Кортизол оказывает различные физиологические эффекты, включая высвобождение катехоламинов, подавление инсулина, мобилизацию запасов энергии посредством глюконеогенеза и гликогенолиза, подавление иммунно-воспалительного ответа и замедленное заживление ран.[8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
Рецепторы, связывающие глюкокортикоиды, существуют в головном мозге в виде минералокортикоидных и глюкокортикоидных рецепторов. Первой реакцией мозга на глюкокортикоиды является сохранение функции. Глюкокортикоидные гормоны, такие как кортизол, кортикостерон и дексаметазон, обладают различными эффектами сохранения энергии и поддержания энергоснабжения, такими как уменьшение воспаления, ограничение роста, выработка энергии, удаление ненужных или неисправных клеточных компонентов. [12]
[12]
Родственные испытания
Для измерения стрессовой реакции у людей используются различные методы тестирования. Иммуноанализ кортизола можно использовать для изучения уровня кортизона в сыворотке крови. Симпатические реакции можно измерить с помощью микронейрографии и уровня норадреналина. Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Патофизиология
Хотя восстановление гомеостаза является целью реакции на стресс, хронический стресс приводит к дисфункциональным реакциям, вызывающим болезни сердца, язву желудка, нарушение регуляции сна и психические расстройства. Ось HPA может быть подавлена или нарушена регуляция в этих неадекватных реакциях на стресс. Стресс заставляет сердечно-сосудистую систему реагировать повышенным кровяным давлением и частотой сердечных сокращений, и хроническая активация этой реакции является основной причиной сердечно-сосудистых заболеваний. Ишемическая болезнь сердца, инсульт и артериальная гипертензия чаще встречаются у лиц с психологическими расстройствами, связанными со стрессом. Высвобождение катехоламинов в ответ на стресс может иметь дезадаптационные эффекты в желудочно-кишечном тракте из-за снижения местного кровотока. Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Ишемическая болезнь сердца, инсульт и артериальная гипертензия чаще встречаются у лиц с психологическими расстройствами, связанными со стрессом. Высвобождение катехоламинов в ответ на стресс может иметь дезадаптационные эффекты в желудочно-кишечном тракте из-за снижения местного кровотока. Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Болезнь Аддисона, синдром Кушинга и феохромоцитома — это заболевания надпочечниковой системы, последние из которых играют роль в механизмах стресса организма посредством высвобождения кортизола и адреналина. У больных наблюдается недостаток глюкокортикоидных и/или минералокортикоидных гормонов при болезни Аддисона. [15] При синдроме Кушинга наблюдается гиперкортицизм, обусловленный эндогенными или экзогенными причинами. [16] Феохромоцитомы представляют собой катехоламин-секретирующие опухоли надпочечников. [17]
У больных наблюдается недостаток глюкокортикоидных и/или минералокортикоидных гормонов при болезни Аддисона. [15] При синдроме Кушинга наблюдается гиперкортицизм, обусловленный эндогенными или экзогенными причинами. [16] Феохромоцитомы представляют собой катехоламин-секретирующие опухоли надпочечников. [17]
Общий адаптационный синдром также описывает различные физиологические изменения, вызванные стрессом, на трех разных стадиях, причем последние две стадии демонстрируют патологические изменения продолжительного стресса.[18] Этот синдром подразделяется на стадию реакции тревоги, стадию резистентности и стадию истощения. Стадия реакции тревоги относится к начальным симптомам организма при остром стрессе и реакции «бей или беги». После первоначального шока от стрессового события организм начинает восстанавливаться, снижая уровень кортизола и нормализуя физиологические реакции (например, артериальное давление и частоту сердечных сокращений). Во время этой фазы восстановления организм остается в состоянии боевой готовности до тех пор, пока стрессовое событие не перестанет быть проблемой. Однако, если стрессовое событие продолжается в течение длительного периода времени, организм адаптируется, чтобы справиться с более высоким уровнем стресса. Тело будет продолжать выделять гормоны стресса, которые поддерживают повышенную физическую реакцию организма на стресс. Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Однако, если стрессовое событие продолжается в течение длительного периода времени, организм адаптируется, чтобы справиться с более высоким уровнем стресса. Тело будет продолжать выделять гормоны стресса, которые поддерживают повышенную физическую реакцию организма на стресс. Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Клиническое значение
Физиологические реакции организма на стресс имеют значение в клинической практике во многих областях, включая ведение здоровых и хирургических пациентов с гипонадпочечниками и понимание того, как изменения образа жизни пациентов могут быть связаны с реакцией организма на стресс.
Физиологический стресс во время операции вызывает повышение уровня кортизола в положительной корреляции с тяжестью операции. У пациентов, перенесших серьезные операции по шкале POSSUM, уровень кортизола возвращается к исходному уровню на 1-5-й послеоперационный день.[8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
Инъекции гидрокортизона для пациентов с гипонадпочечниками, перенесших операцию, вводятся для повторения уровней у пациентов, перенесших операцию, с нормальной функцией надпочечников; считается, что это помогает пациентам с гипонадпочечниками выдерживать физиологический стресс хирургического вмешательства. Рекомендации по дозировке различаются, как и метод приема добавок.[8] Европейские рекомендации предлагают 100 мг гидрокортизона внутримышечно перед анестезией независимо от типа операции. Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Рекомендации по дозировке различаются, как и метод приема добавок.[8] Европейские рекомендации предлагают 100 мг гидрокортизона внутримышечно перед анестезией независимо от типа операции. Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Пациенты отделения интенсивной терапии подвергаются физическому стрессу и стрессу окружающей среды, и были предприняты усилия для изучения связи между уровнями кортизола и выздоровлением от болезни, а также для смягчения стрессовых факторов во время пребывания в отделении интенсивной терапии, которые делают его проблемной средой для лечения. Субъективное восприятие пациентом релаксации усиливается при использовании вспомогательных средств для сна, таких как затычки для ушей, маски для глаз и расслабляющая музыка. Однако эти вмешательства не влияли на ночной уровень мелатонина или кортизола [19].]
Однако эти вмешательства не влияли на ночной уровень мелатонина или кортизола [19].]
Длительные физические упражнения помогают предотвратить сердечно-сосудистые заболевания, и считается, что одним из факторов является адаптация исходной сердечной деятельности. Длительные умеренные физические нагрузки полезны для ослабления сердечно-сосудистой реакции, вызванной стрессом, путем изменения заданных значений барорефлекса в ядре солитарного пути для контроля артериального давления и гомеостаза объема крови, регулируемого паравентрикулярным ядром.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Mifsud KR, Reul JMHM. Опосредованный минералокортикоидами и глюкокортикоидными рецепторами контроль геномных ответов на стресс в головном мозге. Стресс. 2018 сен; 21 (5): 389-402. [PubMed: 29614900]
- 2.

Кетчесин К.Д., Стиннетт Г.С., Сишольц А.Ф. Кортикотропин-рилизинг-гормон-связывающий белок и стресс: от беспозвоночных до человека. Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]
- 3.
Westphal NJ, Seasholtz AF. Гонадотропин-рилизинг-гормон (ГнРГ) позитивно регулирует экспрессию кортикотропин-рилизинг-гормон-связывающего белка посредством множественных внутриклеточных сигнальных путей и многокомпонентного ответного элемента ГнРГ в клетках альфа-Т3-1. Мол Эндокринол. 2005 ноябрь; 19 (11): 2780-97. [PubMed: 15976007]
- 4.
Behan DP, Heinrichs SC, Troncoso JC, Liu XJ, Kawas CH, Ling N, De Souza EB. Вытеснение рилизинг-фактора кортикотропина из связывающего его белка как возможное лечение болезни Альцгеймера. Природа. 1995 16 ноября; 378(6554):284-7. [PubMed: 7477348]
- 5.
King SB, Toufexis DJ, Hammack SE. Полипептид, активирующий аденилатциклазу гипофиза (PACAP), стресс и половые гормоны.
 Стресс. 2017 сен; 20 (5): 465-475. [Бесплатная статья PMC: PMC6724739] [PubMed: 28610473]
Стресс. 2017 сен; 20 (5): 465-475. [Бесплатная статья PMC: PMC6724739] [PubMed: 28610473]- 6.
Kudlacek O, Hofmaier T, Luf A, Mayer FP, Stockner T, Nagy C, Holy M, Freissmuth M, Schmid R, Sitte HH. Кокаиновая фальсификация. J Chem Neuroanat. 2017 окт;83-84:75-81. [Бесплатная статья PMC: PMC7610562] [PubMed: 28619473]
- 7.
. Процедурная боль не повышает уровень кортизола или катехоламинов в плазме у взрослых пациентов интенсивной терапии после операции на сердце. Интенсивная терапия Анест. 2016 янв; 44(1):52-6. [PubMed: 26673589]
- 8.
Кху Б., Бошир П.Р., Фрити А., Таракан Г., Саид С., Хилл Н., Уильямс Э.Л., Мурти К., Толли Н., Цзяо Л.Р., Сполдинг Д., Палаццо Ф., Миран К., Тан Т. Переосмысление стрессовой реакции кортизола на операцию. Клин Эндокринол (Oxf). 2017 ноябрь;87(5):451-458. [В паблике: 28758231]
- 9.
Макгрегор Б.А., Мерфи К.М., Альбано Д.Л., Себальос Р.М. Стресс, кортизол и В-лимфоциты: новый подход к пониманию академического стресса и иммунной функции.
 Стресс. 2016;19(2):185-91. [Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]
Стресс. 2016;19(2):185-91. [Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]- 10.
Гарви Б.А., Фрейкер П.Дж. Подавление антигенного ответа В-клеток костного мозга мышей физиологическими концентрациями глюкокортикоидов. Иммунология. 1991 ноябрь; 74 (3): 519-23. [Бесплатная статья PMC: PMC1384649] [PubMed: 1769699]
- 11.
Ahmed S, Oh HB, Kheng DLLS, Krishnan P. Отчет об успешной частичной спленэктомии по поводу абсцесса селезенки у педиатрического пациента. Отчет по делу Int J Surg 2017; 38:176-179. [Бесплатная статья PMC: PMC5536388] [PubMed: 28768231]
- 12.
Ющак Г.Р., Станкевич А.М. Глюкокортикоиды, гены и функция мозга. Прог Нейропсихофармакол Биол Психиатрия. 2018 02 марта; 82: 136-168. [PubMed: 230]
- 13.
Budzyński J, Kłopocka M. Ось мозг-кишка в патогенезе инфекции Helicobacter pylori. Мир J Гастроэнтерол. 2014 14 мая; 20 (18): 5212-25. [Бесплатная статья PMC: PMC4017036] [PubMed: 24833851]
- 14.

Bassett SM, Lupis SB, Gianferante D, Rohleder N, Wolf JM. Качество сна, но не количество сна, влияет на реакцию кортизола на острый психосоциальный стресс. Стресс. 2015;18(6):638-44. [Бесплатная статья PMC: PMC43] [PubMed: 26414625]
- 15.
Мунир С., Кинтанилья Родригес Б.С., Васим М. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 17 мая 2021 г. Болезнь Аддисона. [PubMed: 28723023]
- 16.
Кайрис Н., Швелл А. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 июля 2021 г. Болезнь Кушинга. [PubMed: 28846264]
- 17.
Паравати С., Розани А., Уоррингтон С.Дж. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 22 июля 2021 г. Физиология, катехоламины. [В паблике: 29939538]
- 18.
СЕЛЬЕ Г. Стресс и общий адаптационный синдром. Br Med J. 1950 Jun 17; 1 (4667): 1383-92. [Бесплатная статья PMC: PMC2038162] [PubMed: 15426759]
- 19.

Hu RF, Jiang XY, Hegadoren KM, Zhang YH. Влияние затычек для ушей и масок для глаз в сочетании с расслабляющей музыкой на сон, уровни мелатонина и кортизола у пациентов отделения интенсивной терапии: рандомизированное контролируемое исследование. Критический уход. 2015 27 марта; 19:115. [Бесплатная статья PMC: PMC43
] [PubMed: 25881268]
Физиология, реакция на стресс — StatPearls
Введение
Любые физические или психологические раздражители, нарушающие гомеостаз, вызывают реакцию на стресс. Стимулы называются стрессорами, а физиологические и поведенческие изменения в ответ на воздействие стрессоров составляют реакцию на стресс. Реакция на стресс опосредована сложным взаимодействием нервных, эндокринных и иммунных механизмов, которые включают активацию симпатико-адрено-медуллярной (SAM) оси, оси гипоталамус-гипофиз-надпочечники (HPA) и иммунной системы.[1] Реакция на стресс является адаптивной, прежде всего, она подготавливает организм к решению проблем, связанных с внутренней или внешней средой (стрессором), например, физиологические реакции организма на травму и инвазивное хирургическое вмешательство служат для смягчения дальнейшего повреждения тканей. Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Клеточный
Физиология реакции на стресс состоит из двух компонентов; медленный ответ, опосредованный осью HPA, и быстрый ответ, опосредованный осью SAM. Быстрый ответ вследствие активации SAM приводит к увеличению секреции норадреналина (НЭ) и адреналина (Э) мозговым веществом надпочечников в кровоток и увеличению секреции НЭ из симпатических нервов и, таким образом, к повышению уровня НЭ в головном мозге. Высвобожденные Е и НЭ взаимодействуют с α-адренорецепторами и β-адренорецепторами, присутствующими в центральной нервной системе и на клеточных мембранах гладких мышц и других органов по всему телу. Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Медленный ответ обусловлен активацией оси HPA, что приводит к высвобождению кортикотропин-рилизинг-гормона (CRH) из паравентрикулярного ядра гипоталамуса в кровоток. CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином.
CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Несвязанный кортизол биологически активен.
Затем высвобожденный CRH стимулирует переднюю долю гипофиза к высвобождению адренокортикотропного гормона (АКТГ) в кровоток. АКТГ стимулирует кору надпочечников к секреции глюкокортикоидных гормонов, таких как кортизол, в кровоток. Неактивная форма кортизола, кортизон, катализируется 11 бета-гидроксистероиддегидрогеназами до его активной формы, кортизола.
Ось HPA регулируется полипептидом, активирующим аденилатциклазу гипофиза (PACAP). PACAP может играть роль в производстве CRH и играть модулирующую роль на нескольких уровнях оси HPA. Имеющиеся данные также указывают на участие PACAP в вегетативной реакции на стресс посредством увеличения секреции катехоламинов.[5] Рецепторы PACAP связаны с G-белком, и PACAP-R1 наиболее распространен как в центральных, так и в периферических тканях. PACAP также может модулировать роль эстрогена в потенцировании острой реакции на стресс.[6]
После высвобождения CRH он связывается с белком, связывающим кортизол-рилизинг-гормон (CRH-BP), поскольку CRH имеет более высокое сродство к CRH-BP, чем к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1.[2] Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Вовлеченные системы органов
Стресс обычно влияет на все системы организма, включая сердечно-сосудистую, дыхательную, эндокринную, желудочно-кишечную, нервную, мышечную и репродуктивную системы. Что касается сердечно-сосудистой системы, то острый стресс вызывает учащение пульса, более сильные сокращения сердечной мышцы, дилатацию сердца и перенаправление крови к крупным мышцам. Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Функция
Повышенная вегетативная реакция вызывает увеличение частоты сердечных сокращений и артериального давления. Во время критического состояния высвобождение катехоламинов снижает кровообращение в желудочно-кишечном тракте. Уровни норадреналина и адреналина в плазме во время стресса перераспределяют объем крови, чтобы сохранить кровоснабжение мозга. Стимуляция симпатической нервной системы разнообразна, но включает такие угрозы для организма, как гипогликемия, геморрагический шок, физические нагрузки, превышающие анаэробный порог, и удушье.[7] Эпинефрин также связан с активным побегом, атакой и неподвижным страхом.
Стрессовая ситуация, экологическая или психологическая, может активировать каскад гормонов стресса, вызывающих физиологические изменения. Активация симпатической нервной системы таким образом вызывает острую реакцию на стресс, называемую реакцией «бей или беги». Это позволяет человеку либо бороться с угрозой, либо бежать от ситуации. Выброс адреналина и норадреналина, секретируемых мозговым веществом надпочечников, вызывает одновременную разрядку почти всех отделов симпатической системы в виде широко распространенного эффекта массовой разрядки по всему телу. Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Механизм
Физический стресс стимулирует гипоталамо-гипофизарно-надпочечниковую и симпатическую нервную систему. Кортизол оказывает различные физиологические эффекты, включая высвобождение катехоламинов, подавление инсулина, мобилизацию запасов энергии посредством глюконеогенеза и гликогенолиза, подавление иммунно-воспалительного ответа и замедленное заживление ран. [8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
[8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
Рецепторы, связывающие глюкокортикоиды, существуют в головном мозге в виде минералокортикоидных и глюкокортикоидных рецепторов. Первой реакцией мозга на глюкокортикоиды является сохранение функции. Глюкокортикоидные гормоны, такие как кортизол, кортикостерон и дексаметазон, обладают различными эффектами сохранения энергии и поддержания энергоснабжения, такими как уменьшение воспаления, ограничение роста, выработка энергии, удаление ненужных или неисправных клеточных компонентов.[12]
Родственные испытания
Для измерения стрессовой реакции у людей используются различные методы тестирования. Иммуноанализ кортизола можно использовать для изучения уровня кортизона в сыворотке крови. Симпатические реакции можно измерить с помощью микронейрографии и уровня норадреналина. Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Патофизиология
Хотя восстановление гомеостаза является целью реакции на стресс, хронический стресс приводит к дисфункциональным реакциям, вызывающим болезни сердца, язву желудка, нарушение регуляции сна и психические расстройства. Ось HPA может быть подавлена или нарушена регуляция в этих неадекватных реакциях на стресс. Стресс заставляет сердечно-сосудистую систему реагировать повышенным кровяным давлением и частотой сердечных сокращений, и хроническая активация этой реакции является основной причиной сердечно-сосудистых заболеваний. Ишемическая болезнь сердца, инсульт и артериальная гипертензия чаще встречаются у лиц с психологическими расстройствами, связанными со стрессом. Высвобождение катехоламинов в ответ на стресс может иметь дезадаптационные эффекты в желудочно-кишечном тракте из-за снижения местного кровотока. Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Болезнь Аддисона, синдром Кушинга и феохромоцитома — это заболевания надпочечниковой системы, последние из которых играют роль в механизмах стресса организма посредством высвобождения кортизола и адреналина. У больных наблюдается недостаток глюкокортикоидных и/или минералокортикоидных гормонов при болезни Аддисона. [15] При синдроме Кушинга наблюдается гиперкортицизм, обусловленный эндогенными или экзогенными причинами. [16] Феохромоцитомы представляют собой катехоламин-секретирующие опухоли надпочечников. [17]
[17]
Общий адаптационный синдром также описывает различные физиологические изменения, вызванные стрессом, на трех разных стадиях, причем последние две стадии демонстрируют патологические изменения продолжительного стресса.[18] Этот синдром подразделяется на стадию реакции тревоги, стадию резистентности и стадию истощения. Стадия реакции тревоги относится к начальным симптомам организма при остром стрессе и реакции «бей или беги». После первоначального шока от стрессового события организм начинает восстанавливаться, снижая уровень кортизола и нормализуя физиологические реакции (например, артериальное давление и частоту сердечных сокращений). Во время этой фазы восстановления организм остается в состоянии боевой готовности до тех пор, пока стрессовое событие не перестанет быть проблемой. Однако, если стрессовое событие продолжается в течение длительного периода времени, организм адаптируется, чтобы справиться с более высоким уровнем стресса. Тело будет продолжать выделять гормоны стресса, которые поддерживают повышенную физическую реакцию организма на стресс. Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Клиническое значение
Физиологические реакции организма на стресс имеют значение в клинической практике во многих областях, включая ведение здоровых и хирургических пациентов с гипонадпочечниками и понимание того, как изменения образа жизни пациентов могут быть связаны с реакцией организма на стресс.
Физиологический стресс во время операции вызывает повышение уровня кортизола в положительной корреляции с тяжестью операции. У пациентов, перенесших серьезные операции по шкале POSSUM, уровень кортизола возвращается к исходному уровню на 1-5-й послеоперационный день. [8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
[8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
Инъекции гидрокортизона для пациентов с гипонадпочечниками, перенесших операцию, вводятся для повторения уровней у пациентов, перенесших операцию, с нормальной функцией надпочечников; считается, что это помогает пациентам с гипонадпочечниками выдерживать физиологический стресс хирургического вмешательства. Рекомендации по дозировке различаются, как и метод приема добавок.[8] Европейские рекомендации предлагают 100 мг гидрокортизона внутримышечно перед анестезией независимо от типа операции. Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Пациенты отделения интенсивной терапии подвергаются физическому стрессу и стрессу окружающей среды, и были предприняты усилия для изучения связи между уровнями кортизола и выздоровлением от болезни, а также для смягчения стрессовых факторов во время пребывания в отделении интенсивной терапии, которые делают его проблемной средой для лечения. Субъективное восприятие пациентом релаксации усиливается при использовании вспомогательных средств для сна, таких как затычки для ушей, маски для глаз и расслабляющая музыка. Однако эти вмешательства не влияли на ночной уровень мелатонина или кортизола [19]. ]
]
Длительные физические упражнения помогают предотвратить сердечно-сосудистые заболевания, и считается, что одним из факторов является адаптация исходной сердечной деятельности. Длительные умеренные физические нагрузки полезны для ослабления сердечно-сосудистой реакции, вызванной стрессом, путем изменения заданных значений барорефлекса в ядре солитарного пути для контроля артериального давления и гомеостаза объема крови, регулируемого паравентрикулярным ядром.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Mifsud KR, Reul JMHM. Опосредованный минералокортикоидами и глюкокортикоидными рецепторами контроль геномных ответов на стресс в головном мозге. Стресс. 2018 сен; 21 (5): 389-402. [PubMed: 29614900]
- 2.
Кетчесин К.Д., Стиннетт Г.С., Сишольц А.Ф. Кортикотропин-рилизинг-гормон-связывающий белок и стресс: от беспозвоночных до человека.
 Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]
Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]- 3.
Westphal NJ, Seasholtz AF. Гонадотропин-рилизинг-гормон (ГнРГ) позитивно регулирует экспрессию кортикотропин-рилизинг-гормон-связывающего белка посредством множественных внутриклеточных сигнальных путей и многокомпонентного ответного элемента ГнРГ в клетках альфа-Т3-1. Мол Эндокринол. 2005 ноябрь; 19 (11): 2780-97. [PubMed: 15976007]
- 4.
Behan DP, Heinrichs SC, Troncoso JC, Liu XJ, Kawas CH, Ling N, De Souza EB. Вытеснение рилизинг-фактора кортикотропина из связывающего его белка как возможное лечение болезни Альцгеймера. Природа. 1995 16 ноября; 378(6554):284-7. [PubMed: 7477348]
- 5.
King SB, Toufexis DJ, Hammack SE. Полипептид, активирующий аденилатциклазу гипофиза (PACAP), стресс и половые гормоны. Стресс. 2017 сен; 20 (5): 465-475. [Бесплатная статья PMC: PMC6724739] [PubMed: 28610473]
- 6.

Kudlacek O, Hofmaier T, Luf A, Mayer FP, Stockner T, Nagy C, Holy M, Freissmuth M, Schmid R, Sitte HH. Кокаиновая фальсификация. J Chem Neuroanat. 2017 окт;83-84:75-81. [Бесплатная статья PMC: PMC7610562] [PubMed: 28619473]
- 7.
. Процедурная боль не повышает уровень кортизола или катехоламинов в плазме у взрослых пациентов интенсивной терапии после операции на сердце. Интенсивная терапия Анест. 2016 янв; 44(1):52-6. [PubMed: 26673589]
- 8.
Кху Б., Бошир П.Р., Фрити А., Таракан Г., Саид С., Хилл Н., Уильямс Э.Л., Мурти К., Толли Н., Цзяо Л.Р., Сполдинг Д., Палаццо Ф., Миран К., Тан Т. Переосмысление стрессовой реакции кортизола на операцию. Клин Эндокринол (Oxf). 2017 ноябрь;87(5):451-458. [В паблике: 28758231]
- 9.
Макгрегор Б.А., Мерфи К.М., Альбано Д.Л., Себальос Р.М. Стресс, кортизол и В-лимфоциты: новый подход к пониманию академического стресса и иммунной функции. Стресс. 2016;19(2):185-91.
 [Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]
[Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]- 10.
Гарви Б.А., Фрейкер П.Дж. Подавление антигенного ответа В-клеток костного мозга мышей физиологическими концентрациями глюкокортикоидов. Иммунология. 1991 ноябрь; 74 (3): 519-23. [Бесплатная статья PMC: PMC1384649] [PubMed: 1769699]
- 11.
Ahmed S, Oh HB, Kheng DLLS, Krishnan P. Отчет об успешной частичной спленэктомии по поводу абсцесса селезенки у педиатрического пациента. Отчет по делу Int J Surg 2017; 38:176-179. [Бесплатная статья PMC: PMC5536388] [PubMed: 28768231]
- 12.
Ющак Г.Р., Станкевич А.М. Глюкокортикоиды, гены и функция мозга. Прог Нейропсихофармакол Биол Психиатрия. 2018 02 марта; 82: 136-168. [PubMed: 230]
- 13.
Budzyński J, Kłopocka M. Ось мозг-кишка в патогенезе инфекции Helicobacter pylori. Мир J Гастроэнтерол. 2014 14 мая; 20 (18): 5212-25. [Бесплатная статья PMC: PMC4017036] [PubMed: 24833851]
- 14.

Bassett SM, Lupis SB, Gianferante D, Rohleder N, Wolf JM. Качество сна, но не количество сна, влияет на реакцию кортизола на острый психосоциальный стресс. Стресс. 2015;18(6):638-44. [Бесплатная статья PMC: PMC43] [PubMed: 26414625]
- 15.
Мунир С., Кинтанилья Родригес Б.С., Васим М. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 17 мая 2021 г. Болезнь Аддисона. [PubMed: 28723023]
- 16.
Кайрис Н., Швелл А. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 июля 2021 г. Болезнь Кушинга. [PubMed: 28846264]
- 17.
Паравати С., Розани А., Уоррингтон С.Дж. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 22 июля 2021 г. Физиология, катехоламины. [В паблике: 29939538]
- 18.
СЕЛЬЕ Г. Стресс и общий адаптационный синдром. Br Med J. 1950 Jun 17; 1 (4667): 1383-92. [Бесплатная статья PMC: PMC2038162] [PubMed: 15426759]
- 19.

Hu RF, Jiang XY, Hegadoren KM, Zhang YH. Влияние затычек для ушей и масок для глаз в сочетании с расслабляющей музыкой на сон, уровни мелатонина и кортизола у пациентов отделения интенсивной терапии: рандомизированное контролируемое исследование. Критический уход. 2015 27 марта; 19:115. [Бесплатная статья PMC: PMC43
] [PubMed: 25881268]
Физиология, реакция на стресс — StatPearls
Введение
Любые физические или психологические раздражители, нарушающие гомеостаз, вызывают реакцию на стресс. Стимулы называются стрессорами, а физиологические и поведенческие изменения в ответ на воздействие стрессоров составляют реакцию на стресс. Реакция на стресс опосредована сложным взаимодействием нервных, эндокринных и иммунных механизмов, которые включают активацию симпатико-адрено-медуллярной (SAM) оси, оси гипоталамус-гипофиз-надпочечники (HPA) и иммунной системы.[1] Реакция на стресс является адаптивной, прежде всего, она подготавливает организм к решению проблем, связанных с внутренней или внешней средой (стрессором), например, физиологические реакции организма на травму и инвазивное хирургическое вмешательство служат для смягчения дальнейшего повреждения тканей. Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Клеточный
Физиология реакции на стресс состоит из двух компонентов; медленный ответ, опосредованный осью HPA, и быстрый ответ, опосредованный осью SAM. Быстрый ответ вследствие активации SAM приводит к увеличению секреции норадреналина (НЭ) и адреналина (Э) мозговым веществом надпочечников в кровоток и увеличению секреции НЭ из симпатических нервов и, таким образом, к повышению уровня НЭ в головном мозге. Высвобожденные Е и НЭ взаимодействуют с α-адренорецепторами и β-адренорецепторами, присутствующими в центральной нервной системе и на клеточных мембранах гладких мышц и других органов по всему телу. Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Медленный ответ обусловлен активацией оси HPA, что приводит к высвобождению кортикотропин-рилизинг-гормона (CRH) из паравентрикулярного ядра гипоталамуса в кровоток. CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином.
CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Несвязанный кортизол биологически активен.
Затем высвобожденный CRH стимулирует переднюю долю гипофиза к высвобождению адренокортикотропного гормона (АКТГ) в кровоток. АКТГ стимулирует кору надпочечников к секреции глюкокортикоидных гормонов, таких как кортизол, в кровоток. Неактивная форма кортизола, кортизон, катализируется 11 бета-гидроксистероиддегидрогеназами до его активной формы, кортизола.
Ось HPA регулируется полипептидом, активирующим аденилатциклазу гипофиза (PACAP). PACAP может играть роль в производстве CRH и играть модулирующую роль на нескольких уровнях оси HPA. Имеющиеся данные также указывают на участие PACAP в вегетативной реакции на стресс посредством увеличения секреции катехоламинов.[5] Рецепторы PACAP связаны с G-белком, и PACAP-R1 наиболее распространен как в центральных, так и в периферических тканях. PACAP также может модулировать роль эстрогена в потенцировании острой реакции на стресс.[6]
После высвобождения CRH он связывается с белком, связывающим кортизол-рилизинг-гормон (CRH-BP), поскольку CRH имеет более высокое сродство к CRH-BP, чем к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1.[2] Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Вовлеченные системы органов
Стресс обычно влияет на все системы организма, включая сердечно-сосудистую, дыхательную, эндокринную, желудочно-кишечную, нервную, мышечную и репродуктивную системы. Что касается сердечно-сосудистой системы, то острый стресс вызывает учащение пульса, более сильные сокращения сердечной мышцы, дилатацию сердца и перенаправление крови к крупным мышцам. Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Функция
Повышенная вегетативная реакция вызывает увеличение частоты сердечных сокращений и артериального давления. Во время критического состояния высвобождение катехоламинов снижает кровообращение в желудочно-кишечном тракте. Уровни норадреналина и адреналина в плазме во время стресса перераспределяют объем крови, чтобы сохранить кровоснабжение мозга. Стимуляция симпатической нервной системы разнообразна, но включает такие угрозы для организма, как гипогликемия, геморрагический шок, физические нагрузки, превышающие анаэробный порог, и удушье.[7] Эпинефрин также связан с активным побегом, атакой и неподвижным страхом.
Стрессовая ситуация, экологическая или психологическая, может активировать каскад гормонов стресса, вызывающих физиологические изменения. Активация симпатической нервной системы таким образом вызывает острую реакцию на стресс, называемую реакцией «бей или беги». Это позволяет человеку либо бороться с угрозой, либо бежать от ситуации. Выброс адреналина и норадреналина, секретируемых мозговым веществом надпочечников, вызывает одновременную разрядку почти всех отделов симпатической системы в виде широко распространенного эффекта массовой разрядки по всему телу. Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Механизм
Физический стресс стимулирует гипоталамо-гипофизарно-надпочечниковую и симпатическую нервную систему. Кортизол оказывает различные физиологические эффекты, включая высвобождение катехоламинов, подавление инсулина, мобилизацию запасов энергии посредством глюконеогенеза и гликогенолиза, подавление иммунно-воспалительного ответа и замедленное заживление ран. [8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
[8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
Рецепторы, связывающие глюкокортикоиды, существуют в головном мозге в виде минералокортикоидных и глюкокортикоидных рецепторов. Первой реакцией мозга на глюкокортикоиды является сохранение функции. Глюкокортикоидные гормоны, такие как кортизол, кортикостерон и дексаметазон, обладают различными эффектами сохранения энергии и поддержания энергоснабжения, такими как уменьшение воспаления, ограничение роста, выработка энергии, удаление ненужных или неисправных клеточных компонентов.[12]
Родственные испытания
Для измерения стрессовой реакции у людей используются различные методы тестирования. Иммуноанализ кортизола можно использовать для изучения уровня кортизона в сыворотке крови. Симпатические реакции можно измерить с помощью микронейрографии и уровня норадреналина. Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Патофизиология
Хотя восстановление гомеостаза является целью реакции на стресс, хронический стресс приводит к дисфункциональным реакциям, вызывающим болезни сердца, язву желудка, нарушение регуляции сна и психические расстройства. Ось HPA может быть подавлена или нарушена регуляция в этих неадекватных реакциях на стресс. Стресс заставляет сердечно-сосудистую систему реагировать повышенным кровяным давлением и частотой сердечных сокращений, и хроническая активация этой реакции является основной причиной сердечно-сосудистых заболеваний. Ишемическая болезнь сердца, инсульт и артериальная гипертензия чаще встречаются у лиц с психологическими расстройствами, связанными со стрессом. Высвобождение катехоламинов в ответ на стресс может иметь дезадаптационные эффекты в желудочно-кишечном тракте из-за снижения местного кровотока. Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Болезнь Аддисона, синдром Кушинга и феохромоцитома — это заболевания надпочечниковой системы, последние из которых играют роль в механизмах стресса организма посредством высвобождения кортизола и адреналина. У больных наблюдается недостаток глюкокортикоидных и/или минералокортикоидных гормонов при болезни Аддисона. [15] При синдроме Кушинга наблюдается гиперкортицизм, обусловленный эндогенными или экзогенными причинами. [16] Феохромоцитомы представляют собой катехоламин-секретирующие опухоли надпочечников. [17]
[17]
Общий адаптационный синдром также описывает различные физиологические изменения, вызванные стрессом, на трех разных стадиях, причем последние две стадии демонстрируют патологические изменения продолжительного стресса.[18] Этот синдром подразделяется на стадию реакции тревоги, стадию резистентности и стадию истощения. Стадия реакции тревоги относится к начальным симптомам организма при остром стрессе и реакции «бей или беги». После первоначального шока от стрессового события организм начинает восстанавливаться, снижая уровень кортизола и нормализуя физиологические реакции (например, артериальное давление и частоту сердечных сокращений). Во время этой фазы восстановления организм остается в состоянии боевой готовности до тех пор, пока стрессовое событие не перестанет быть проблемой. Однако, если стрессовое событие продолжается в течение длительного периода времени, организм адаптируется, чтобы справиться с более высоким уровнем стресса. Тело будет продолжать выделять гормоны стресса, которые поддерживают повышенную физическую реакцию организма на стресс. Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Клиническое значение
Физиологические реакции организма на стресс имеют значение в клинической практике во многих областях, включая ведение здоровых и хирургических пациентов с гипонадпочечниками и понимание того, как изменения образа жизни пациентов могут быть связаны с реакцией организма на стресс.
Физиологический стресс во время операции вызывает повышение уровня кортизола в положительной корреляции с тяжестью операции. У пациентов, перенесших серьезные операции по шкале POSSUM, уровень кортизола возвращается к исходному уровню на 1-5-й послеоперационный день. [8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
[8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
Инъекции гидрокортизона для пациентов с гипонадпочечниками, перенесших операцию, вводятся для повторения уровней у пациентов, перенесших операцию, с нормальной функцией надпочечников; считается, что это помогает пациентам с гипонадпочечниками выдерживать физиологический стресс хирургического вмешательства. Рекомендации по дозировке различаются, как и метод приема добавок.[8] Европейские рекомендации предлагают 100 мг гидрокортизона внутримышечно перед анестезией независимо от типа операции. Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Пациенты отделения интенсивной терапии подвергаются физическому стрессу и стрессу окружающей среды, и были предприняты усилия для изучения связи между уровнями кортизола и выздоровлением от болезни, а также для смягчения стрессовых факторов во время пребывания в отделении интенсивной терапии, которые делают его проблемной средой для лечения. Субъективное восприятие пациентом релаксации усиливается при использовании вспомогательных средств для сна, таких как затычки для ушей, маски для глаз и расслабляющая музыка. Однако эти вмешательства не влияли на ночной уровень мелатонина или кортизола [19]. ]
]
Длительные физические упражнения помогают предотвратить сердечно-сосудистые заболевания, и считается, что одним из факторов является адаптация исходной сердечной деятельности. Длительные умеренные физические нагрузки полезны для ослабления сердечно-сосудистой реакции, вызванной стрессом, путем изменения заданных значений барорефлекса в ядре солитарного пути для контроля артериального давления и гомеостаза объема крови, регулируемого паравентрикулярным ядром.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Mifsud KR, Reul JMHM. Опосредованный минералокортикоидами и глюкокортикоидными рецепторами контроль геномных ответов на стресс в головном мозге. Стресс. 2018 сен; 21 (5): 389-402. [PubMed: 29614900]
- 2.
Кетчесин К.Д., Стиннетт Г.С., Сишольц А.Ф. Кортикотропин-рилизинг-гормон-связывающий белок и стресс: от беспозвоночных до человека.
 Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]
Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]- 3.
Westphal NJ, Seasholtz AF. Гонадотропин-рилизинг-гормон (ГнРГ) позитивно регулирует экспрессию кортикотропин-рилизинг-гормон-связывающего белка посредством множественных внутриклеточных сигнальных путей и многокомпонентного ответного элемента ГнРГ в клетках альфа-Т3-1. Мол Эндокринол. 2005 ноябрь; 19 (11): 2780-97. [PubMed: 15976007]
- 4.
Behan DP, Heinrichs SC, Troncoso JC, Liu XJ, Kawas CH, Ling N, De Souza EB. Вытеснение рилизинг-фактора кортикотропина из связывающего его белка как возможное лечение болезни Альцгеймера. Природа. 1995 16 ноября; 378(6554):284-7. [PubMed: 7477348]
- 5.
King SB, Toufexis DJ, Hammack SE. Полипептид, активирующий аденилатциклазу гипофиза (PACAP), стресс и половые гормоны. Стресс. 2017 сен; 20 (5): 465-475. [Бесплатная статья PMC: PMC6724739] [PubMed: 28610473]
- 6.

Kudlacek O, Hofmaier T, Luf A, Mayer FP, Stockner T, Nagy C, Holy M, Freissmuth M, Schmid R, Sitte HH. Кокаиновая фальсификация. J Chem Neuroanat. 2017 окт;83-84:75-81. [Бесплатная статья PMC: PMC7610562] [PubMed: 28619473]
- 7.
. Процедурная боль не повышает уровень кортизола или катехоламинов в плазме у взрослых пациентов интенсивной терапии после операции на сердце. Интенсивная терапия Анест. 2016 янв; 44(1):52-6. [PubMed: 26673589]
- 8.
Кху Б., Бошир П.Р., Фрити А., Таракан Г., Саид С., Хилл Н., Уильямс Э.Л., Мурти К., Толли Н., Цзяо Л.Р., Сполдинг Д., Палаццо Ф., Миран К., Тан Т. Переосмысление стрессовой реакции кортизола на операцию. Клин Эндокринол (Oxf). 2017 ноябрь;87(5):451-458. [В паблике: 28758231]
- 9.
Макгрегор Б.А., Мерфи К.М., Альбано Д.Л., Себальос Р.М. Стресс, кортизол и В-лимфоциты: новый подход к пониманию академического стресса и иммунной функции. Стресс. 2016;19(2):185-91.
 [Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]
[Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]- 10.
Гарви Б.А., Фрейкер П.Дж. Подавление антигенного ответа В-клеток костного мозга мышей физиологическими концентрациями глюкокортикоидов. Иммунология. 1991 ноябрь; 74 (3): 519-23. [Бесплатная статья PMC: PMC1384649] [PubMed: 1769699]
- 11.
Ahmed S, Oh HB, Kheng DLLS, Krishnan P. Отчет об успешной частичной спленэктомии по поводу абсцесса селезенки у педиатрического пациента. Отчет по делу Int J Surg 2017; 38:176-179. [Бесплатная статья PMC: PMC5536388] [PubMed: 28768231]
- 12.
Ющак Г.Р., Станкевич А.М. Глюкокортикоиды, гены и функция мозга. Прог Нейропсихофармакол Биол Психиатрия. 2018 02 марта; 82: 136-168. [PubMed: 230]
- 13.
Budzyński J, Kłopocka M. Ось мозг-кишка в патогенезе инфекции Helicobacter pylori. Мир J Гастроэнтерол. 2014 14 мая; 20 (18): 5212-25. [Бесплатная статья PMC: PMC4017036] [PubMed: 24833851]
- 14.

Bassett SM, Lupis SB, Gianferante D, Rohleder N, Wolf JM. Качество сна, но не количество сна, влияет на реакцию кортизола на острый психосоциальный стресс. Стресс. 2015;18(6):638-44. [Бесплатная статья PMC: PMC43] [PubMed: 26414625]
- 15.
Мунир С., Кинтанилья Родригес Б.С., Васим М. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 17 мая 2021 г. Болезнь Аддисона. [PubMed: 28723023]
- 16.
Кайрис Н., Швелл А. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 июля 2021 г. Болезнь Кушинга. [PubMed: 28846264]
- 17.
Паравати С., Розани А., Уоррингтон С.Дж. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 22 июля 2021 г. Физиология, катехоламины. [В паблике: 29939538]
- 18.
СЕЛЬЕ Г. Стресс и общий адаптационный синдром. Br Med J. 1950 Jun 17; 1 (4667): 1383-92. [Бесплатная статья PMC: PMC2038162] [PubMed: 15426759]
- 19.

Hu RF, Jiang XY, Hegadoren KM, Zhang YH. Влияние затычек для ушей и масок для глаз в сочетании с расслабляющей музыкой на сон, уровни мелатонина и кортизола у пациентов отделения интенсивной терапии: рандомизированное контролируемое исследование. Критический уход. 2015 27 марта; 19:115. [Бесплатная статья PMC: PMC43
] [PubMed: 25881268]
Физиология, реакция на стресс — StatPearls
Введение
Любые физические или психологические раздражители, нарушающие гомеостаз, вызывают реакцию на стресс. Стимулы называются стрессорами, а физиологические и поведенческие изменения в ответ на воздействие стрессоров составляют реакцию на стресс. Реакция на стресс опосредована сложным взаимодействием нервных, эндокринных и иммунных механизмов, которые включают активацию симпатико-адрено-медуллярной (SAM) оси, оси гипоталамус-гипофиз-надпочечники (HPA) и иммунной системы.[1] Реакция на стресс является адаптивной, прежде всего, она подготавливает организм к решению проблем, связанных с внутренней или внешней средой (стрессором), например, физиологические реакции организма на травму и инвазивное хирургическое вмешательство служат для смягчения дальнейшего повреждения тканей. Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Клеточный
Физиология реакции на стресс состоит из двух компонентов; медленный ответ, опосредованный осью HPA, и быстрый ответ, опосредованный осью SAM. Быстрый ответ вследствие активации SAM приводит к увеличению секреции норадреналина (НЭ) и адреналина (Э) мозговым веществом надпочечников в кровоток и увеличению секреции НЭ из симпатических нервов и, таким образом, к повышению уровня НЭ в головном мозге. Высвобожденные Е и НЭ взаимодействуют с α-адренорецепторами и β-адренорецепторами, присутствующими в центральной нервной системе и на клеточных мембранах гладких мышц и других органов по всему телу. Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Медленный ответ обусловлен активацией оси HPA, что приводит к высвобождению кортикотропин-рилизинг-гормона (CRH) из паравентрикулярного ядра гипоталамуса в кровоток. CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином.
CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Несвязанный кортизол биологически активен.
Затем высвобожденный CRH стимулирует переднюю долю гипофиза к высвобождению адренокортикотропного гормона (АКТГ) в кровоток. АКТГ стимулирует кору надпочечников к секреции глюкокортикоидных гормонов, таких как кортизол, в кровоток. Неактивная форма кортизола, кортизон, катализируется 11 бета-гидроксистероиддегидрогеназами до его активной формы, кортизола.
Ось HPA регулируется полипептидом, активирующим аденилатциклазу гипофиза (PACAP). PACAP может играть роль в производстве CRH и играть модулирующую роль на нескольких уровнях оси HPA. Имеющиеся данные также указывают на участие PACAP в вегетативной реакции на стресс посредством увеличения секреции катехоламинов.[5] Рецепторы PACAP связаны с G-белком, и PACAP-R1 наиболее распространен как в центральных, так и в периферических тканях. PACAP также может модулировать роль эстрогена в потенцировании острой реакции на стресс.[6]
После высвобождения CRH он связывается с белком, связывающим кортизол-рилизинг-гормон (CRH-BP), поскольку CRH имеет более высокое сродство к CRH-BP, чем к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1.[2] Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Вовлеченные системы органов
Стресс обычно влияет на все системы организма, включая сердечно-сосудистую, дыхательную, эндокринную, желудочно-кишечную, нервную, мышечную и репродуктивную системы. Что касается сердечно-сосудистой системы, то острый стресс вызывает учащение пульса, более сильные сокращения сердечной мышцы, дилатацию сердца и перенаправление крови к крупным мышцам. Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Функция
Повышенная вегетативная реакция вызывает увеличение частоты сердечных сокращений и артериального давления. Во время критического состояния высвобождение катехоламинов снижает кровообращение в желудочно-кишечном тракте. Уровни норадреналина и адреналина в плазме во время стресса перераспределяют объем крови, чтобы сохранить кровоснабжение мозга. Стимуляция симпатической нервной системы разнообразна, но включает такие угрозы для организма, как гипогликемия, геморрагический шок, физические нагрузки, превышающие анаэробный порог, и удушье.[7] Эпинефрин также связан с активным побегом, атакой и неподвижным страхом.
Стрессовая ситуация, экологическая или психологическая, может активировать каскад гормонов стресса, вызывающих физиологические изменения. Активация симпатической нервной системы таким образом вызывает острую реакцию на стресс, называемую реакцией «бей или беги». Это позволяет человеку либо бороться с угрозой, либо бежать от ситуации. Выброс адреналина и норадреналина, секретируемых мозговым веществом надпочечников, вызывает одновременную разрядку почти всех отделов симпатической системы в виде широко распространенного эффекта массовой разрядки по всему телу. Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Механизм
Физический стресс стимулирует гипоталамо-гипофизарно-надпочечниковую и симпатическую нервную систему. Кортизол оказывает различные физиологические эффекты, включая высвобождение катехоламинов, подавление инсулина, мобилизацию запасов энергии посредством глюконеогенеза и гликогенолиза, подавление иммунно-воспалительного ответа и замедленное заживление ран. [8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
[8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
Рецепторы, связывающие глюкокортикоиды, существуют в головном мозге в виде минералокортикоидных и глюкокортикоидных рецепторов. Первой реакцией мозга на глюкокортикоиды является сохранение функции. Глюкокортикоидные гормоны, такие как кортизол, кортикостерон и дексаметазон, обладают различными эффектами сохранения энергии и поддержания энергоснабжения, такими как уменьшение воспаления, ограничение роста, выработка энергии, удаление ненужных или неисправных клеточных компонентов.[12]
Родственные испытания
Для измерения стрессовой реакции у людей используются различные методы тестирования. Иммуноанализ кортизола можно использовать для изучения уровня кортизона в сыворотке крови. Симпатические реакции можно измерить с помощью микронейрографии и уровня норадреналина. Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Патофизиология
Хотя восстановление гомеостаза является целью реакции на стресс, хронический стресс приводит к дисфункциональным реакциям, вызывающим болезни сердца, язву желудка, нарушение регуляции сна и психические расстройства. Ось HPA может быть подавлена или нарушена регуляция в этих неадекватных реакциях на стресс. Стресс заставляет сердечно-сосудистую систему реагировать повышенным кровяным давлением и частотой сердечных сокращений, и хроническая активация этой реакции является основной причиной сердечно-сосудистых заболеваний. Ишемическая болезнь сердца, инсульт и артериальная гипертензия чаще встречаются у лиц с психологическими расстройствами, связанными со стрессом. Высвобождение катехоламинов в ответ на стресс может иметь дезадаптационные эффекты в желудочно-кишечном тракте из-за снижения местного кровотока. Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Болезнь Аддисона, синдром Кушинга и феохромоцитома — это заболевания надпочечниковой системы, последние из которых играют роль в механизмах стресса организма посредством высвобождения кортизола и адреналина. У больных наблюдается недостаток глюкокортикоидных и/или минералокортикоидных гормонов при болезни Аддисона. [15] При синдроме Кушинга наблюдается гиперкортицизм, обусловленный эндогенными или экзогенными причинами. [16] Феохромоцитомы представляют собой катехоламин-секретирующие опухоли надпочечников. [17]
[17]
Общий адаптационный синдром также описывает различные физиологические изменения, вызванные стрессом, на трех разных стадиях, причем последние две стадии демонстрируют патологические изменения продолжительного стресса.[18] Этот синдром подразделяется на стадию реакции тревоги, стадию резистентности и стадию истощения. Стадия реакции тревоги относится к начальным симптомам организма при остром стрессе и реакции «бей или беги». После первоначального шока от стрессового события организм начинает восстанавливаться, снижая уровень кортизола и нормализуя физиологические реакции (например, артериальное давление и частоту сердечных сокращений). Во время этой фазы восстановления организм остается в состоянии боевой готовности до тех пор, пока стрессовое событие не перестанет быть проблемой. Однако, если стрессовое событие продолжается в течение длительного периода времени, организм адаптируется, чтобы справиться с более высоким уровнем стресса. Тело будет продолжать выделять гормоны стресса, которые поддерживают повышенную физическую реакцию организма на стресс. Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Клиническое значение
Физиологические реакции организма на стресс имеют значение в клинической практике во многих областях, включая ведение здоровых и хирургических пациентов с гипонадпочечниками и понимание того, как изменения образа жизни пациентов могут быть связаны с реакцией организма на стресс.
Физиологический стресс во время операции вызывает повышение уровня кортизола в положительной корреляции с тяжестью операции. У пациентов, перенесших серьезные операции по шкале POSSUM, уровень кортизола возвращается к исходному уровню на 1-5-й послеоперационный день. [8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
[8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
Инъекции гидрокортизона для пациентов с гипонадпочечниками, перенесших операцию, вводятся для повторения уровней у пациентов, перенесших операцию, с нормальной функцией надпочечников; считается, что это помогает пациентам с гипонадпочечниками выдерживать физиологический стресс хирургического вмешательства. Рекомендации по дозировке различаются, как и метод приема добавок.[8] Европейские рекомендации предлагают 100 мг гидрокортизона внутримышечно перед анестезией независимо от типа операции. Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Пациенты отделения интенсивной терапии подвергаются физическому стрессу и стрессу окружающей среды, и были предприняты усилия для изучения связи между уровнями кортизола и выздоровлением от болезни, а также для смягчения стрессовых факторов во время пребывания в отделении интенсивной терапии, которые делают его проблемной средой для лечения. Субъективное восприятие пациентом релаксации усиливается при использовании вспомогательных средств для сна, таких как затычки для ушей, маски для глаз и расслабляющая музыка. Однако эти вмешательства не влияли на ночной уровень мелатонина или кортизола [19]. ]
]
Длительные физические упражнения помогают предотвратить сердечно-сосудистые заболевания, и считается, что одним из факторов является адаптация исходной сердечной деятельности. Длительные умеренные физические нагрузки полезны для ослабления сердечно-сосудистой реакции, вызванной стрессом, путем изменения заданных значений барорефлекса в ядре солитарного пути для контроля артериального давления и гомеостаза объема крови, регулируемого паравентрикулярным ядром.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Mifsud KR, Reul JMHM. Опосредованный минералокортикоидами и глюкокортикоидными рецепторами контроль геномных ответов на стресс в головном мозге. Стресс. 2018 сен; 21 (5): 389-402. [PubMed: 29614900]
- 2.
Кетчесин К.Д., Стиннетт Г.С., Сишольц А.Ф. Кортикотропин-рилизинг-гормон-связывающий белок и стресс: от беспозвоночных до человека.
 Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]
Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]- 3.
Westphal NJ, Seasholtz AF. Гонадотропин-рилизинг-гормон (ГнРГ) позитивно регулирует экспрессию кортикотропин-рилизинг-гормон-связывающего белка посредством множественных внутриклеточных сигнальных путей и многокомпонентного ответного элемента ГнРГ в клетках альфа-Т3-1. Мол Эндокринол. 2005 ноябрь; 19 (11): 2780-97. [PubMed: 15976007]
- 4.
Behan DP, Heinrichs SC, Troncoso JC, Liu XJ, Kawas CH, Ling N, De Souza EB. Вытеснение рилизинг-фактора кортикотропина из связывающего его белка как возможное лечение болезни Альцгеймера. Природа. 1995 16 ноября; 378(6554):284-7. [PubMed: 7477348]
- 5.
King SB, Toufexis DJ, Hammack SE. Полипептид, активирующий аденилатциклазу гипофиза (PACAP), стресс и половые гормоны. Стресс. 2017 сен; 20 (5): 465-475. [Бесплатная статья PMC: PMC6724739] [PubMed: 28610473]
- 6.

Kudlacek O, Hofmaier T, Luf A, Mayer FP, Stockner T, Nagy C, Holy M, Freissmuth M, Schmid R, Sitte HH. Кокаиновая фальсификация. J Chem Neuroanat. 2017 окт;83-84:75-81. [Бесплатная статья PMC: PMC7610562] [PubMed: 28619473]
- 7.
. Процедурная боль не повышает уровень кортизола или катехоламинов в плазме у взрослых пациентов интенсивной терапии после операции на сердце. Интенсивная терапия Анест. 2016 янв; 44(1):52-6. [PubMed: 26673589]
- 8.
Кху Б., Бошир П.Р., Фрити А., Таракан Г., Саид С., Хилл Н., Уильямс Э.Л., Мурти К., Толли Н., Цзяо Л.Р., Сполдинг Д., Палаццо Ф., Миран К., Тан Т. Переосмысление стрессовой реакции кортизола на операцию. Клин Эндокринол (Oxf). 2017 ноябрь;87(5):451-458. [В паблике: 28758231]
- 9.
Макгрегор Б.А., Мерфи К.М., Альбано Д.Л., Себальос Р.М. Стресс, кортизол и В-лимфоциты: новый подход к пониманию академического стресса и иммунной функции. Стресс. 2016;19(2):185-91.
 [Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]
[Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]- 10.
Гарви Б.А., Фрейкер П.Дж. Подавление антигенного ответа В-клеток костного мозга мышей физиологическими концентрациями глюкокортикоидов. Иммунология. 1991 ноябрь; 74 (3): 519-23. [Бесплатная статья PMC: PMC1384649] [PubMed: 1769699]
- 11.
Ahmed S, Oh HB, Kheng DLLS, Krishnan P. Отчет об успешной частичной спленэктомии по поводу абсцесса селезенки у педиатрического пациента. Отчет по делу Int J Surg 2017; 38:176-179. [Бесплатная статья PMC: PMC5536388] [PubMed: 28768231]
- 12.
Ющак Г.Р., Станкевич А.М. Глюкокортикоиды, гены и функция мозга. Прог Нейропсихофармакол Биол Психиатрия. 2018 02 марта; 82: 136-168. [PubMed: 230]
- 13.
Budzyński J, Kłopocka M. Ось мозг-кишка в патогенезе инфекции Helicobacter pylori. Мир J Гастроэнтерол. 2014 14 мая; 20 (18): 5212-25. [Бесплатная статья PMC: PMC4017036] [PubMed: 24833851]
- 14.

Bassett SM, Lupis SB, Gianferante D, Rohleder N, Wolf JM. Качество сна, но не количество сна, влияет на реакцию кортизола на острый психосоциальный стресс. Стресс. 2015;18(6):638-44. [Бесплатная статья PMC: PMC43] [PubMed: 26414625]
- 15.
Мунир С., Кинтанилья Родригес Б.С., Васим М. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 17 мая 2021 г. Болезнь Аддисона. [PubMed: 28723023]
- 16.
Кайрис Н., Швелл А. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 июля 2021 г. Болезнь Кушинга. [PubMed: 28846264]
- 17.
Паравати С., Розани А., Уоррингтон С.Дж. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 22 июля 2021 г. Физиология, катехоламины. [В паблике: 29939538]
- 18.
СЕЛЬЕ Г. Стресс и общий адаптационный синдром. Br Med J. 1950 Jun 17; 1 (4667): 1383-92. [Бесплатная статья PMC: PMC2038162] [PubMed: 15426759]
- 19.

Hu RF, Jiang XY, Hegadoren KM, Zhang YH. Влияние затычек для ушей и масок для глаз в сочетании с расслабляющей музыкой на сон, уровни мелатонина и кортизола у пациентов отделения интенсивной терапии: рандомизированное контролируемое исследование. Критический уход. 2015 27 марта; 19:115. [Бесплатная статья PMC: PMC43
] [PubMed: 25881268]
Физиология, реакция на стресс — StatPearls
Введение
Любые физические или психологические раздражители, нарушающие гомеостаз, вызывают реакцию на стресс. Стимулы называются стрессорами, а физиологические и поведенческие изменения в ответ на воздействие стрессоров составляют реакцию на стресс. Реакция на стресс опосредована сложным взаимодействием нервных, эндокринных и иммунных механизмов, которые включают активацию симпатико-адрено-медуллярной (SAM) оси, оси гипоталамус-гипофиз-надпочечники (HPA) и иммунной системы.[1] Реакция на стресс является адаптивной, прежде всего, она подготавливает организм к решению проблем, связанных с внутренней или внешней средой (стрессором), например, физиологические реакции организма на травму и инвазивное хирургическое вмешательство служат для смягчения дальнейшего повреждения тканей. Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Но если воздействие стрессора на самом деле или воспринимается как интенсивное, повторяющееся (повторяющийся острый стресс) или продолжительное (хронический стресс), реакция на стресс становится неадекватной и пагубной для физиологии, например, воздействие хронических стрессоров может вызвать неадекватные реакции, включая депрессию, тревога, когнитивные нарушения и сердечные заболевания.[2]
Клеточный
Физиология реакции на стресс состоит из двух компонентов; медленный ответ, опосредованный осью HPA, и быстрый ответ, опосредованный осью SAM. Быстрый ответ вследствие активации SAM приводит к увеличению секреции норадреналина (НЭ) и адреналина (Э) мозговым веществом надпочечников в кровоток и увеличению секреции НЭ из симпатических нервов и, таким образом, к повышению уровня НЭ в головном мозге. Высвобожденные Е и НЭ взаимодействуют с α-адренорецепторами и β-адренорецепторами, присутствующими в центральной нервной системе и на клеточных мембранах гладких мышц и других органов по всему телу. Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Норэпинефрин (NE) и адреналин (E), после высвобождения, связываются со специфическими мембранными рецепторами G-белка, чтобы инициировать внутриклеточный сигнальный путь цАМФ, который быстро активирует клеточные ответы. Активация этих рецепторов приводит к сокращению клеток гладких и сердечных мышц, что приводит к сужению сосудов, повышению артериального давления, частоты сердечных сокращений, сердечного выброса, кровотока в скелетных мышцах, увеличению задержки натрия, повышению уровня глюкозы (вследствие гликогенолиза и глюконеогенеза), липолизу, повышенное потребление кислорода и термогенез. Это также приводит к снижению перистальтики кишечника, кожной вазоконстрикции, расширению бронхов. Кроме того, активация SAM вызывает поведенческую активацию (повышенное возбуждение, бдительность, бдительность, познание, сосредоточенное внимание и обезболивание).
Медленный ответ обусловлен активацией оси HPA, что приводит к высвобождению кортикотропин-рилизинг-гормона (CRH) из паравентрикулярного ядра гипоталамуса в кровоток. CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином.
CRH, высвобождаемый из гипоталамуса, действует на два рецептора; CRH-R1 и CRH-R2. CRH-R1 широко экспрессируется в головном мозге млекопитающих. Это ключевой рецептор стресс-индуцированного высвобождения АКТГ передней долей гипофиза. CRH-R2 экспрессируется преимущественно в периферических тканях, включая скелетные мышцы, желудочно-кишечный тракт и сердце, а также в подкорковых структурах головного мозга. Белок, связывающий гормон, высвобождающий кортизол, CRH-BP связывается с CRH с более высоким сродством, чем CRH, к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[3] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[4] При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1. Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Несвязанный кортизол биологически активен.
Затем высвобожденный CRH стимулирует переднюю долю гипофиза к высвобождению адренокортикотропного гормона (АКТГ) в кровоток. АКТГ стимулирует кору надпочечников к секреции глюкокортикоидных гормонов, таких как кортизол, в кровоток. Неактивная форма кортизола, кортизон, катализируется 11 бета-гидроксистероиддегидрогеназами до его активной формы, кортизола.
Ось HPA регулируется полипептидом, активирующим аденилатциклазу гипофиза (PACAP). PACAP может играть роль в производстве CRH и играть модулирующую роль на нескольких уровнях оси HPA. Имеющиеся данные также указывают на участие PACAP в вегетативной реакции на стресс посредством увеличения секреции катехоламинов.[5] Рецепторы PACAP связаны с G-белком, и PACAP-R1 наиболее распространен как в центральных, так и в периферических тканях. PACAP также может модулировать роль эстрогена в потенцировании острой реакции на стресс.[6]
После высвобождения CRH он связывается с белком, связывающим кортизол-рилизинг-гормон (CRH-BP), поскольку CRH имеет более высокое сродство к CRH-BP, чем к его рецепторам. CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
CRH-BP экспрессируется в печени, гипофизе, головном мозге и плаценте.[5] Роль CRH-BP как регулятора биодоступности CRH подтверждается исследованиями, в которых установлено, что от 40 до 60% CRH в головном мозге связано с CRH-BP.[6]
При воздействии стресса экспрессия CRH-BP увеличивается в зависимости от времени, что считается механизмом отрицательной обратной связи для уменьшения взаимодействия CRH с CRH-R1.[2] Уровень кортизола в сыворотке характеризует общий уровень кортизола в организме, из которого 80% связаны с кортизолсвязывающим глобулином (КСГ), а 10% связаны с альбумином. Несвязанный кортизол биологически активен.
Вовлеченные системы органов
Стресс обычно влияет на все системы организма, включая сердечно-сосудистую, дыхательную, эндокринную, желудочно-кишечную, нервную, мышечную и репродуктивную системы. Что касается сердечно-сосудистой системы, то острый стресс вызывает учащение пульса, более сильные сокращения сердечной мышцы, дилатацию сердца и перенаправление крови к крупным мышцам. Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Дыхательная система работает с сердечно-сосудистой системой, чтобы снабжать клетки организма кислородом и удалять отходы углекислого газа. Острый стресс сужает дыхательные пути, что приводит к одышке и учащенному дыханию. Эндокринная система увеличивает выработку стероидных гормонов, в том числе кортизола, для активизации стрессовой реакции организма. Стресс может повлиять на желудочно-кишечный тракт, влияя на скорость прохождения пищи через кишечник. Это также может повлиять на пищеварение и то, какие питательные вещества поглощает кишечник. Что касается нервной системы, стресс активирует симпатическую нервную систему, которая, в свою очередь, активирует надпочечники. Парасимпатическая нервная система способствует восстановлению организма после преодоления острого стрессового кризиса. Стресс влияет на опорно-двигательный аппарат, напрягая мышцы как способ защиты от боли и травм. В репродуктивной системе хронический стресс может негативно повлиять на половое влечение, выработку/созревание сперматозоидов, беременность и менструацию.
Функция
Повышенная вегетативная реакция вызывает увеличение частоты сердечных сокращений и артериального давления. Во время критического состояния высвобождение катехоламинов снижает кровообращение в желудочно-кишечном тракте. Уровни норадреналина и адреналина в плазме во время стресса перераспределяют объем крови, чтобы сохранить кровоснабжение мозга. Стимуляция симпатической нервной системы разнообразна, но включает такие угрозы для организма, как гипогликемия, геморрагический шок, физические нагрузки, превышающие анаэробный порог, и удушье.[7] Эпинефрин также связан с активным побегом, атакой и неподвижным страхом.
Стрессовая ситуация, экологическая или психологическая, может активировать каскад гормонов стресса, вызывающих физиологические изменения. Активация симпатической нервной системы таким образом вызывает острую реакцию на стресс, называемую реакцией «бей или беги». Это позволяет человеку либо бороться с угрозой, либо бежать от ситуации. Выброс адреналина и норадреналина, секретируемых мозговым веществом надпочечников, вызывает одновременную разрядку почти всех отделов симпатической системы в виде широко распространенного эффекта массовой разрядки по всему телу. Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Физиологические изменения этого эффекта сброса массы включают повышение артериального давления, больший приток крови к активным мышцам и меньший приток крови к органам, не нужным для быстрой двигательной активности, повышенную скорость свертывания крови, повышенную скорость клеточного метаболизма в организме, увеличение мышечной силы, повышенная умственная активность, повышенная концентрация глюкозы в крови и повышенный гликолиз в печени/мышцах. Суммарный эффект всех этих эффектов позволяет человеку выполнять более напряженную деятельность, чем обычно. После того, как предполагаемая угроза исчезает, тело возвращается к состоянию до возбуждения.
Механизм
Физический стресс стимулирует гипоталамо-гипофизарно-надпочечниковую и симпатическую нервную систему. Кортизол оказывает различные физиологические эффекты, включая высвобождение катехоламинов, подавление инсулина, мобилизацию запасов энергии посредством глюконеогенеза и гликогенолиза, подавление иммунно-воспалительного ответа и замедленное заживление ран. [8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
[8] Эффектом подавления иммунного ответа является апоптоз В-клеток.[9][10] Заживление ран также замедляется из-за воздействия на синтез коллагена.[11] Альдостерон — это минералокортикоидный гормон, который поддерживает артериальное давление за счет задержки натрия и воды.
Рецепторы, связывающие глюкокортикоиды, существуют в головном мозге в виде минералокортикоидных и глюкокортикоидных рецепторов. Первой реакцией мозга на глюкокортикоиды является сохранение функции. Глюкокортикоидные гормоны, такие как кортизол, кортикостерон и дексаметазон, обладают различными эффектами сохранения энергии и поддержания энергоснабжения, такими как уменьшение воспаления, ограничение роста, выработка энергии, удаление ненужных или неисправных клеточных компонентов.[12]
Родственные испытания
Для измерения стрессовой реакции у людей используются различные методы тестирования. Иммуноанализ кортизола можно использовать для изучения уровня кортизона в сыворотке крови. Симпатические реакции можно измерить с помощью микронейрографии и уровня норадреналина. Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Техника микронейрографии включает введение электрода в периферический нерв для измерения симпатической активности в коже и мышцах верхних или нижних конечностей.
Патофизиология
Хотя восстановление гомеостаза является целью реакции на стресс, хронический стресс приводит к дисфункциональным реакциям, вызывающим болезни сердца, язву желудка, нарушение регуляции сна и психические расстройства. Ось HPA может быть подавлена или нарушена регуляция в этих неадекватных реакциях на стресс. Стресс заставляет сердечно-сосудистую систему реагировать повышенным кровяным давлением и частотой сердечных сокращений, и хроническая активация этой реакции является основной причиной сердечно-сосудистых заболеваний. Ишемическая болезнь сердца, инсульт и артериальная гипертензия чаще встречаются у лиц с психологическими расстройствами, связанными со стрессом. Высвобождение катехоламинов в ответ на стресс может иметь дезадаптационные эффекты в желудочно-кишечном тракте из-за снижения местного кровотока. Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Хронический стресс ослабляет иммунную систему, увеличивая вероятность развития язвенной болезни желудка и кровотечений. [13] Качество и количество сна влияют на реакцию кортизола на острый стресс. Самооценка высокого качества сна показала сильную реакцию кортизола на стресс, а относительно хорошее качество сна показало значительно более слабую реакцию кортизола у мужчин, но не у женщин. Независимо от пола, притупленная реакция кортизола на стресс наблюдалась у людей, которые сообщали о проблемах с бодрствованием и трудностями с поддержанием энтузиазма.[14]
Болезнь Аддисона, синдром Кушинга и феохромоцитома — это заболевания надпочечниковой системы, последние из которых играют роль в механизмах стресса организма посредством высвобождения кортизола и адреналина. У больных наблюдается недостаток глюкокортикоидных и/или минералокортикоидных гормонов при болезни Аддисона. [15] При синдроме Кушинга наблюдается гиперкортицизм, обусловленный эндогенными или экзогенными причинами. [16] Феохромоцитомы представляют собой катехоламин-секретирующие опухоли надпочечников. [17]
[17]
Общий адаптационный синдром также описывает различные физиологические изменения, вызванные стрессом, на трех разных стадиях, причем последние две стадии демонстрируют патологические изменения продолжительного стресса.[18] Этот синдром подразделяется на стадию реакции тревоги, стадию резистентности и стадию истощения. Стадия реакции тревоги относится к начальным симптомам организма при остром стрессе и реакции «бей или беги». После первоначального шока от стрессового события организм начинает восстанавливаться, снижая уровень кортизола и нормализуя физиологические реакции (например, артериальное давление и частоту сердечных сокращений). Во время этой фазы восстановления организм остается в состоянии боевой готовности до тех пор, пока стрессовое событие не перестанет быть проблемой. Однако, если стрессовое событие продолжается в течение длительного периода времени, организм адаптируется, чтобы справиться с более высоким уровнем стресса. Тело будет продолжать выделять гормоны стресса, которые поддерживают повышенную физическую реакцию организма на стресс. Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Это вызывает стадию резистентности и включает симптомы плохой концентрации внимания, раздражительности и разочарования. Если стрессовое событие будет продолжаться, организм войдет в стадию истощения. Симптомы этой стадии включают эмоциональное выгорание, усталость, депрессию, тревогу и снижение стрессоустойчивости. Поскольку стрессовое событие продолжается, иммунная система организма будет продолжать ослабевать. Это связано с подавляющим действием гормонов стресса на клетки иммунной системы.
Клиническое значение
Физиологические реакции организма на стресс имеют значение в клинической практике во многих областях, включая ведение здоровых и хирургических пациентов с гипонадпочечниками и понимание того, как изменения образа жизни пациентов могут быть связаны с реакцией организма на стресс.
Физиологический стресс во время операции вызывает повышение уровня кортизола в положительной корреляции с тяжестью операции. У пациентов, перенесших серьезные операции по шкале POSSUM, уровень кортизола возвращается к исходному уровню на 1-5-й послеоперационный день. [8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
[8] Не было обнаружено, что тяжесть послеоперационной боли коррелирует с уровнем кортизола после операции на сердце [7]. При исследовании уровней кортизола во время малых, средних и больших операций не было обнаружено, что послеоперационная опиоидная анальгезия влияет на реакцию стресса кортизола на операцию.[8] Различный уровень секреции кортизола, коррелирующий со стрессом при определенных хирургических операциях, имеет значение для пациентов с гипонадпочечниками, которым требуется восполнение кортизола во время операции.
Инъекции гидрокортизона для пациентов с гипонадпочечниками, перенесших операцию, вводятся для повторения уровней у пациентов, перенесших операцию, с нормальной функцией надпочечников; считается, что это помогает пациентам с гипонадпочечниками выдерживать физиологический стресс хирургического вмешательства. Рекомендации по дозировке различаются, как и метод приема добавок.[8] Европейские рекомендации предлагают 100 мг гидрокортизона внутримышечно перед анестезией независимо от типа операции. Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Рекомендации эндокринного общества предполагают введение 100 мг гидрокортизона внутривенно с последующей инфузией, в основе которой лежит тяжесть операции. Тестирование уровня кортизола при операциях различной степени тяжести показывает, что пиковый уровень кортизола коррелирует с тяжестью хирургического вмешательства, но было продемонстрировано, что пиковые уровни кортизола ниже, чем предполагалось ранее.[8]
Пациенты отделения интенсивной терапии подвергаются физическому стрессу и стрессу окружающей среды, и были предприняты усилия для изучения связи между уровнями кортизола и выздоровлением от болезни, а также для смягчения стрессовых факторов во время пребывания в отделении интенсивной терапии, которые делают его проблемной средой для лечения. Субъективное восприятие пациентом релаксации усиливается при использовании вспомогательных средств для сна, таких как затычки для ушей, маски для глаз и расслабляющая музыка. Однако эти вмешательства не влияли на ночной уровень мелатонина или кортизола [19]. ]
]
Длительные физические упражнения помогают предотвратить сердечно-сосудистые заболевания, и считается, что одним из факторов является адаптация исходной сердечной деятельности. Длительные умеренные физические нагрузки полезны для ослабления сердечно-сосудистой реакции, вызванной стрессом, путем изменения заданных значений барорефлекса в ядре солитарного пути для контроля артериального давления и гомеостаза объема крови, регулируемого паравентрикулярным ядром.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Mifsud KR, Reul JMHM. Опосредованный минералокортикоидами и глюкокортикоидными рецепторами контроль геномных ответов на стресс в головном мозге. Стресс. 2018 сен; 21 (5): 389-402. [PubMed: 29614900]
- 2.
Кетчесин К.Д., Стиннетт Г.С., Сишольц А.Ф. Кортикотропин-рилизинг-гормон-связывающий белок и стресс: от беспозвоночных до человека.
 Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]
Стресс. 2017 сен;20(5):449-464. [Бесплатная статья PMC: PMC7885796] [PubMed: 28436309]- 3.
Westphal NJ, Seasholtz AF. Гонадотропин-рилизинг-гормон (ГнРГ) позитивно регулирует экспрессию кортикотропин-рилизинг-гормон-связывающего белка посредством множественных внутриклеточных сигнальных путей и многокомпонентного ответного элемента ГнРГ в клетках альфа-Т3-1. Мол Эндокринол. 2005 ноябрь; 19 (11): 2780-97. [PubMed: 15976007]
- 4.
Behan DP, Heinrichs SC, Troncoso JC, Liu XJ, Kawas CH, Ling N, De Souza EB. Вытеснение рилизинг-фактора кортикотропина из связывающего его белка как возможное лечение болезни Альцгеймера. Природа. 1995 16 ноября; 378(6554):284-7. [PubMed: 7477348]
- 5.
King SB, Toufexis DJ, Hammack SE. Полипептид, активирующий аденилатциклазу гипофиза (PACAP), стресс и половые гормоны. Стресс. 2017 сен; 20 (5): 465-475. [Бесплатная статья PMC: PMC6724739] [PubMed: 28610473]
- 6.

Kudlacek O, Hofmaier T, Luf A, Mayer FP, Stockner T, Nagy C, Holy M, Freissmuth M, Schmid R, Sitte HH. Кокаиновая фальсификация. J Chem Neuroanat. 2017 окт;83-84:75-81. [Бесплатная статья PMC: PMC7610562] [PubMed: 28619473]
- 7.
. Процедурная боль не повышает уровень кортизола или катехоламинов в плазме у взрослых пациентов интенсивной терапии после операции на сердце. Интенсивная терапия Анест. 2016 янв; 44(1):52-6. [PubMed: 26673589]
- 8.
Кху Б., Бошир П.Р., Фрити А., Таракан Г., Саид С., Хилл Н., Уильямс Э.Л., Мурти К., Толли Н., Цзяо Л.Р., Сполдинг Д., Палаццо Ф., Миран К., Тан Т. Переосмысление стрессовой реакции кортизола на операцию. Клин Эндокринол (Oxf). 2017 ноябрь;87(5):451-458. [В паблике: 28758231]
- 9.
Макгрегор Б.А., Мерфи К.М., Альбано Д.Л., Себальос Р.М. Стресс, кортизол и В-лимфоциты: новый подход к пониманию академического стресса и иммунной функции. Стресс. 2016;19(2):185-91.
 [Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]
[Бесплатная статья PMC: PMC4837014] [PubMed: 26644211]- 10.
Гарви Б.А., Фрейкер П.Дж. Подавление антигенного ответа В-клеток костного мозга мышей физиологическими концентрациями глюкокортикоидов. Иммунология. 1991 ноябрь; 74 (3): 519-23. [Бесплатная статья PMC: PMC1384649] [PubMed: 1769699]
- 11.
Ahmed S, Oh HB, Kheng DLLS, Krishnan P. Отчет об успешной частичной спленэктомии по поводу абсцесса селезенки у педиатрического пациента. Отчет по делу Int J Surg 2017; 38:176-179. [Бесплатная статья PMC: PMC5536388] [PubMed: 28768231]
- 12.
Ющак Г.Р., Станкевич А.М. Глюкокортикоиды, гены и функция мозга. Прог Нейропсихофармакол Биол Психиатрия. 2018 02 марта; 82: 136-168. [PubMed: 230]
- 13.
Budzyński J, Kłopocka M. Ось мозг-кишка в патогенезе инфекции Helicobacter pylori. Мир J Гастроэнтерол. 2014 14 мая; 20 (18): 5212-25. [Бесплатная статья PMC: PMC4017036] [PubMed: 24833851]
- 14.

Bassett SM, Lupis SB, Gianferante D, Rohleder N, Wolf JM. Качество сна, но не количество сна, влияет на реакцию кортизола на острый психосоциальный стресс. Стресс. 2015;18(6):638-44. [Бесплатная статья PMC: PMC43] [PubMed: 26414625]
- 15.
Мунир С., Кинтанилья Родригес Б.С., Васим М. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 17 мая 2021 г. Болезнь Аддисона. [PubMed: 28723023]
- 16.
Кайрис Н., Швелл А. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 июля 2021 г. Болезнь Кушинга. [PubMed: 28846264]
- 17.
Паравати С., Розани А., Уоррингтон С.Дж. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 22 июля 2021 г. Физиология, катехоламины. [В паблике: 29939538]
- 18.
СЕЛЬЕ Г. Стресс и общий адаптационный синдром. Br Med J. 1950 Jun 17; 1 (4667): 1383-92. [Бесплатная статья PMC: PMC2038162] [PubMed: 15426759]
- 19.


 , д.б.н. Чиркова Т.В., доц., к.б.н. Емельянов В.В., н.с., к.б.н. Ласточкин В.В., аспирант Приказюк Г.Е., студенты Бертова А.Д., Мосина А.А., Шиков А.Е.
, д.б.н. Чиркова Т.В., доц., к.б.н. Емельянов В.В., н.с., к.б.н. Ласточкин В.В., аспирант Приказюк Г.Е., студенты Бертова А.Д., Мосина А.А., Шиков А.Е.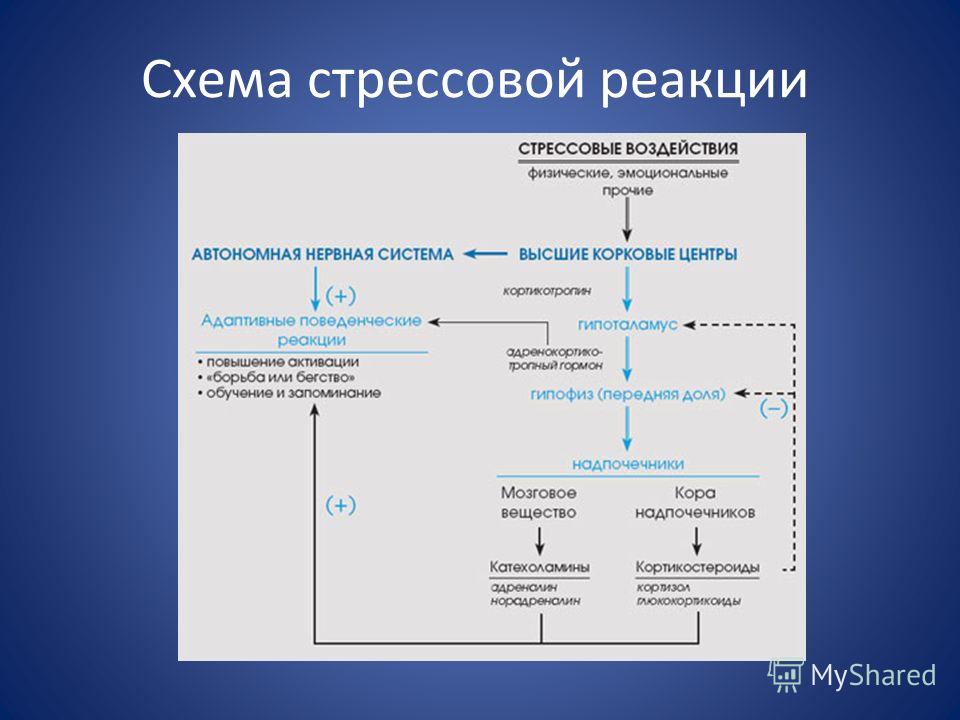 Исследования механизмов адаптации проводятся группой преимущественно на двух модельных объектах: проростках пшеницы и риса, контрастных по устойчивости к недостатку кислорода. Кроме того, для изучения конкретных механизмов гормональной регуляции активно привлекаются мутантные и трансгенные растения резуховидки и табака, а для проведения эколого-физиологических исследований – представители дикорастущей гидро- и гелофитной флоры. Эксперименты по изучению механизмов перцепции и трансдукции анаэробного сигнала проводятся на клеточном уровне: на протопластах и клеточных культурах. Члены группы владеют современными методами физиологического, биохимического, молекулярно-биологического и микроскопического анализа растительного материала.
Исследования механизмов адаптации проводятся группой преимущественно на двух модельных объектах: проростках пшеницы и риса, контрастных по устойчивости к недостатку кислорода. Кроме того, для изучения конкретных механизмов гормональной регуляции активно привлекаются мутантные и трансгенные растения резуховидки и табака, а для проведения эколого-физиологических исследований – представители дикорастущей гидро- и гелофитной флоры. Эксперименты по изучению механизмов перцепции и трансдукции анаэробного сигнала проводятся на клеточном уровне: на протопластах и клеточных культурах. Члены группы владеют современными методами физиологического, биохимического, молекулярно-биологического и микроскопического анализа растительного материала. 
 Такие изменения гормонального статуса вызывают остановку роста у неприспособленных растений, тогда как накопление ауксина в надземной части проростков устойчивого риса позволяет сохранять ее рост, а в корнях, наоборот, ингибирует его.
Такие изменения гормонального статуса вызывают остановку роста у неприспособленных растений, тогда как накопление ауксина в надземной части проростков устойчивого риса позволяет сохранять ее рост, а в корнях, наоборот, ингибирует его. 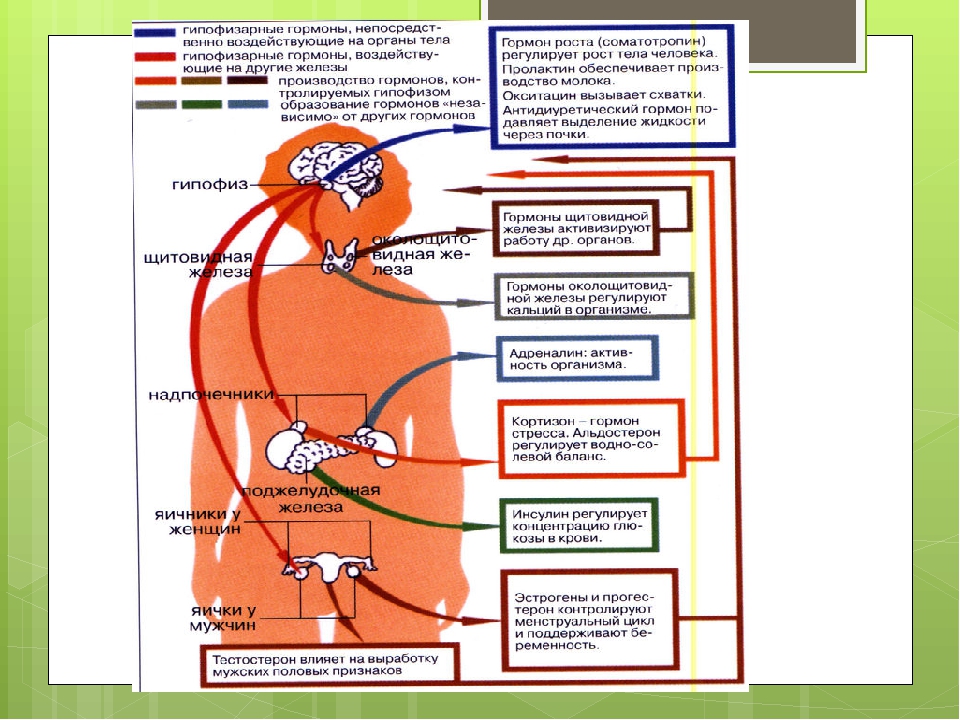

 Подобран оптимальный состав питательных сред для индукции каллусообразования и получены каллусные культуры риса и пшеницы. Каллусная культура пшеницы переведена в суспензионную культуру для выполнения дальнейших экспериментов по получению трансгенных клеточных линий. Для создания трансгенных клеточных линий пшеницы и риса было апробировано несколько методов агробактериальной трансформации, среди которых был выбран наиболее оптимальный. С помощью данного метода были получены трансгенные каллусы риса и пшеницы, селекцию которых проводили на среде, содержащей канамицин. После завершения этапа первичной селекции трансгенная природа полученных каллусов была подтверждена с помощью ПЦР-анализа.
Подобран оптимальный состав питательных сред для индукции каллусообразования и получены каллусные культуры риса и пшеницы. Каллусная культура пшеницы переведена в суспензионную культуру для выполнения дальнейших экспериментов по получению трансгенных клеточных линий. Для создания трансгенных клеточных линий пшеницы и риса было апробировано несколько методов агробактериальной трансформации, среди которых был выбран наиболее оптимальный. С помощью данного метода были получены трансгенные каллусы риса и пшеницы, селекцию которых проводили на среде, содержащей канамицин. После завершения этапа первичной селекции трансгенная природа полученных каллусов была подтверждена с помощью ПЦР-анализа.

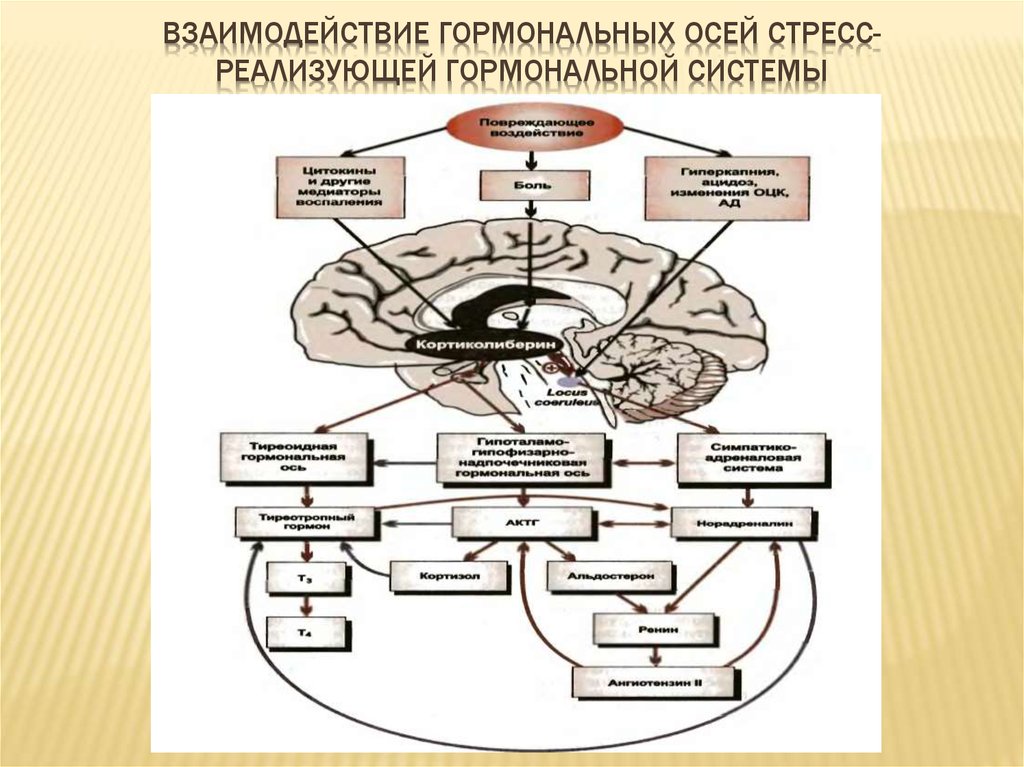
 Prof. Fagerstedt K.V., Dr. Blokhina O.B.) в течение ряда лет проводятся совместные исследования по проблеме анаэробиоза в рамках международного договора между университетами Санкт-Петербурга и Хельсинки. В университете Хельсинки проводили экспериментальные работы аспиранты кафедры Блохина О.Б. и Куличихин К.Ю., на основании которых были защищены кандидатские диссертации.
Prof. Fagerstedt K.V., Dr. Blokhina O.B.) в течение ряда лет проводятся совместные исследования по проблеме анаэробиоза в рамках международного договора между университетами Санкт-Петербурга и Хельсинки. В университете Хельсинки проводили экспериментальные работы аспиранты кафедры Блохина О.Б. и Куличихин К.Ю., на основании которых были защищены кандидатские диссертации. 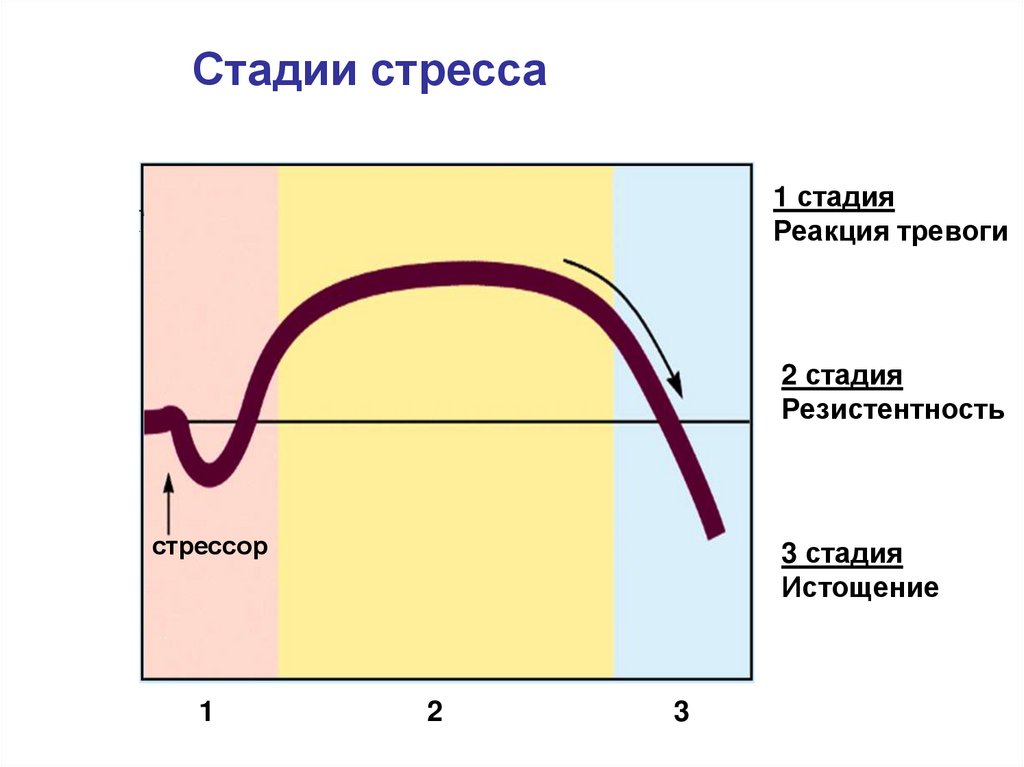 Проект финансировался Шведским институтом и Министерством образования и науки РФ. На протопластах клеток пшеницы и риса показано участие ионов кальция и калия в трансдукции анаэробного сигнала. Совместную работу с Университетом Западной Австралии (School of Biomedical, Biomolecular and Chemical Sciences, Faculty of Life and Physical Science, The University of Western Australia) проводил аспирант Куличихин К.Ю. Экспериментальные данные оформлены в виде статьи, опубликованной в J. of Exp. Botany, 2009.
Проект финансировался Шведским институтом и Министерством образования и науки РФ. На протопластах клеток пшеницы и риса показано участие ионов кальция и калия в трансдукции анаэробного сигнала. Совместную работу с Университетом Западной Австралии (School of Biomedical, Biomolecular and Chemical Sciences, Faculty of Life and Physical Science, The University of Western Australia) проводил аспирант Куличихин К.Ю. Экспериментальные данные оформлены в виде статьи, опубликованной в J. of Exp. Botany, 2009.  На основании полученных результатов готовится к публикации статья.
На основании полученных результатов готовится к публикации статья.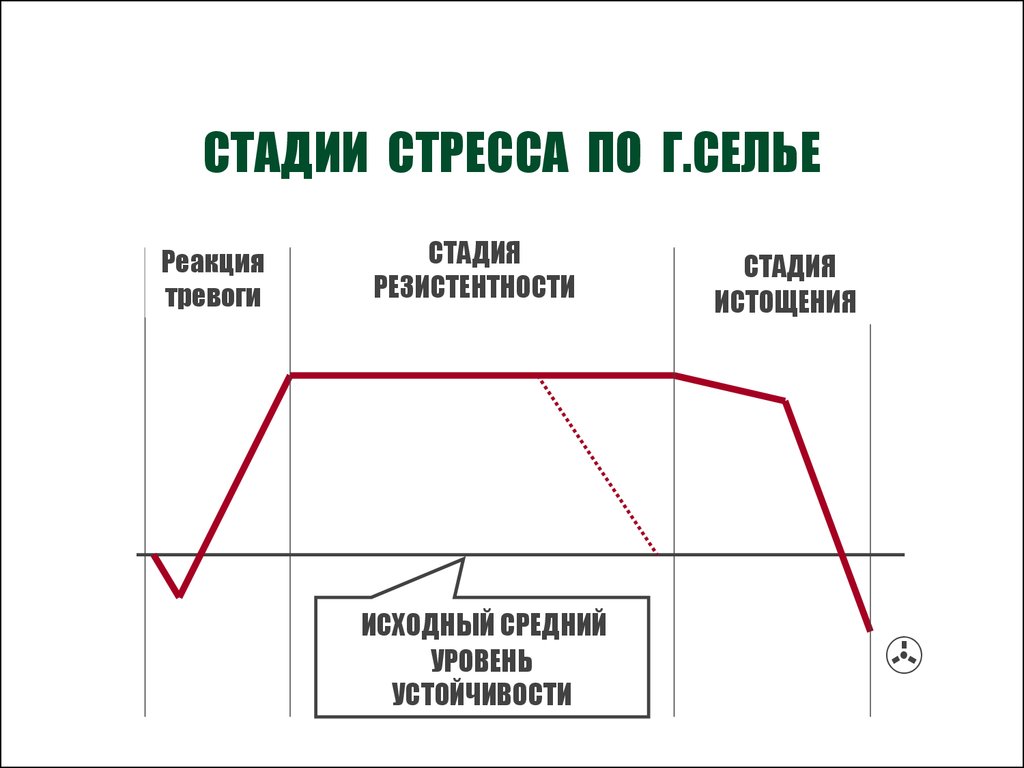 В. Роль клеточных мембран в устойчивости растений к недостатку кислорода // Успехи соврем. биол. 1983. Т. 95. №1. С. 44-56.
В. Роль клеточных мембран в устойчивости растений к недостатку кислорода // Успехи соврем. биол. 1983. Т. 95. №1. С. 44-56. Практикум по фотосинтезу и дыханию растений. Учеб. пособие / Под ред. В.В.Полевого и Т.В.Чирковой. СПб., Изд-во С-Петербург. ун-та. 1997. 162 с.
Практикум по фотосинтезу и дыханию растений. Учеб. пособие / Под ред. В.В.Полевого и Т.В.Чирковой. СПб., Изд-во С-Петербург. ун-та. 1997. 162 с. // Physiologia Plantarum. 1999. V. 105. P. 625-632. https://doi.org/10.1034/j.1399-3054.1999.105405.x
// Physiologia Plantarum. 1999. V. 105. P. 625-632. https://doi.org/10.1034/j.1399-3054.1999.105405.x А., Чиркова Т.В. Физиология дыхания растений. Учеб. пособие. СПб. Изд-во С.-Петерб. ун-та. 2001. 224 с.
А., Чиркова Т.В. Физиология дыхания растений. Учеб. пособие. СПб. Изд-во С.-Петерб. ун-та. 2001. 224 с. // Physiologia Plantarum. 2007. V. 129. P. 507- 518. https://doi.org/10.1111/j.1399-3054.2006.00819.x
// Physiologia Plantarum. 2007. V. 129. P. 507- 518. https://doi.org/10.1111/j.1399-3054.2006.00819.x , Byrne L., Colmer T.D. Regulation of intracellular pH during anoxia in rice coleoptiles in acidic and near neutral conditions. // Journal of Experimental Botany. V. 80. P. 2110-2128. https://doi.org/10.1093/jxb/erp090
, Byrne L., Colmer T.D. Regulation of intracellular pH during anoxia in rice coleoptiles in acidic and near neutral conditions. // Journal of Experimental Botany. V. 80. P. 2110-2128. https://doi.org/10.1093/jxb/erp090 V., Shishova M.F. The role of phytohormones in the control of plant adaptation to oxygen depletion // Phytohormones and abiotic stress tolerance in plants / eds.: N.A. Khan, R. Nazar, A. Iqbal, N.A. Anjum. Springer. 2012. P. 229-248. https://doi.org/10.1007/978-3-642-25829-9_10.
V., Shishova M.F. The role of phytohormones in the control of plant adaptation to oxygen depletion // Phytohormones and abiotic stress tolerance in plants / eds.: N.A. Khan, R. Nazar, A. Iqbal, N.A. Anjum. Springer. 2012. P. 229-248. https://doi.org/10.1007/978-3-642-25829-9_10.
 7/9
7/9  Я очень беспокоюсь о своей работе
Я очень беспокоюсь о своей работе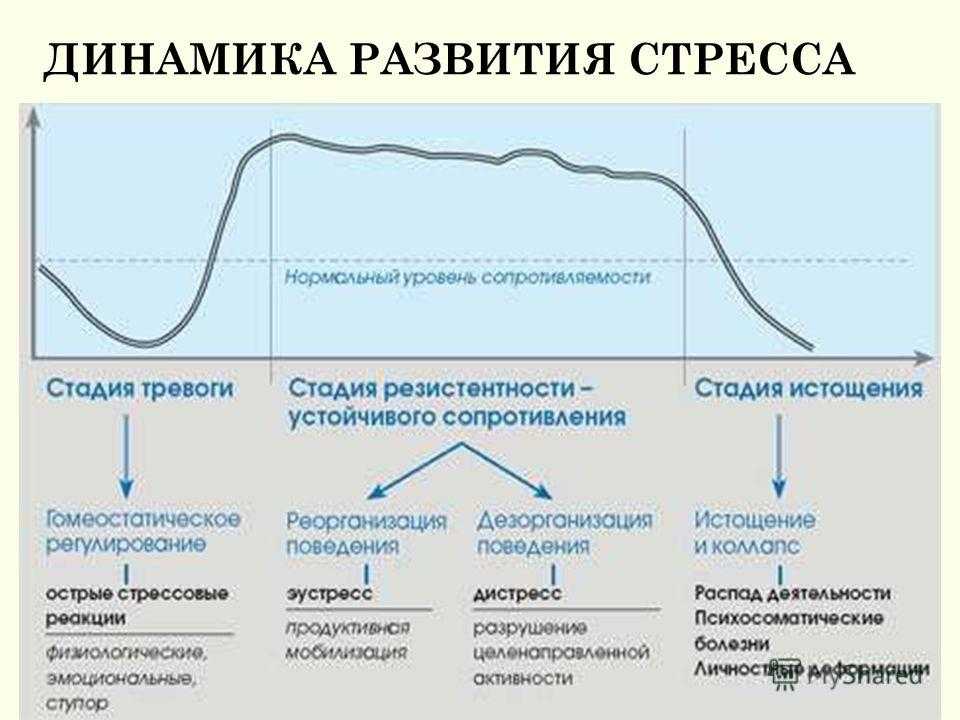 Общаясь с людьми, я часто ощущаю нервное напряжение
Общаясь с людьми, я часто ощущаю нервное напряжение
